ShRNA靶向干扰BHRF1基因抑制鼻咽癌细胞增殖
2015-12-25张艳平,丁矢,李雪兰等
ShRNA靶向干扰BHRF1基因抑制鼻咽癌细胞增殖
张艳平丁矢李雪兰杨杰唐峰欧勇
(常德职业技术学院医学系,湖南常德415100)
摘要〔〕目的针对ShRNA靶向干扰BHRF1基因抑制鼻咽癌细胞增殖以分析癌症靶向治疗的前景。方法通过基因测序法鉴定所构建的siRNA表达载体。用四唑盐比色(MTT)法、流式细胞术评价转染siRNA后对鼻咽癌细胞增殖、凋亡的影响。结果与NC-shRNA组相比,BHRF1-shRNA组细胞凋亡增加,凋亡率为(31.51±1.59)%。结论由慢病毒载体介导的shRNA表达载体进入细胞后,可以有效下调BHRF1基因表达水平,抑制细胞增殖,促进细胞凋亡。
关键词〔〕慢病毒;ShRNA;靶向干扰;BHRF1基因;细胞增殖
中图分类号〔〕R739.63〔
基金项目:2012年度湖南省高等学校科学研究项目(12C0968)
通讯作者:丁矢(1979-),女,讲师,主要从事病理学研究。
第一作者:张艳平(1971-),女,副教授,主要从事医学免疫学与病原学研究。
目前认为鼻咽癌的发生、发展与遗传、环境和Epstein-Barr(EB)病毒感染等多因素有关,特别是与EB病毒(EBV)密切相关〔1〕。该疾病好发于中老年人群,具有较高的致残、致死率。EBV早期基因BamHI-H右向读码框1(BHRF1)基因编码的BHRF1蛋白是一种结构与功能都和细胞Bcl-2 同源的蛋白,很多研究〔2,3〕表明BHRF1 在EBV复制期可以抑制感染细胞的凋亡,延长细胞寿命,有利于病毒的成熟和扩散,但BHRF1基因编码的蛋白最终是通过何种途径抑制细胞凋亡的发生,从而导致细胞癌变的分子机制目前还未完全阐明。鉴于EBV BHRF1 基因与原癌基因bcl-2 同源,具有抑制细胞凋亡的作用,探讨以BHRF1 为靶点对EBV 相关鼻咽癌进行治疗的巨大潜在价值。
1资料与方法
1.1一般资料我院2010年1月至2013年12月老年鼻咽癌手术患者20例,男13例,女7例;平均年龄(65.32±3.78)岁,术中病理切片,并分离出人鼻咽癌CNE2细胞,将这些细胞分为两组,一组为BHRF1 shRNA质粒载体转染过的CNE2细胞(BHRF1-shRNA组),一组为未进行转染的CNE2细胞(NC-shRNA组)。Trizol totalRNA试剂盒,BHRF1 shRNA序列,由Qiagen公司合成,构建靶向表达载体,应用体外转染试剂转染CNE2细胞。
1.2方法运用四唑盐比色(MTT)法绘制生长曲线。选择对数生长期细胞0.25%胰酶消化,悬浮计数,接种于96孔板,约500个/孔。慢病毒感染后置于37℃、5% CO2培养箱孵育10 h。每孔加入5 mg/ml MTT溶液,继续细胞培养箱内培养4 h。移除培养液,每孔加入150 μl二甲基亚砜(DMSO),低速震荡10 min,酶联免疫检测仪。570 nm处测量每孔吸光值光密度(OD)值,OD值表示细胞增殖能力大小。连续观察7 d绘制细胞生长曲线。同时设置调零孔(培养基、MTT、DMSO),空白对照孔,每个样本设3个复孔。
运用异硫氰酸荧光素(FITC)-Annexin V/碘化丙啶(PI)双染色法测定细胞凋亡。按FITC-Annexin V/PI试剂盒操作说明,取不同时间点细胞用不含乙二胺四乙酸(EDTA)的胰酶消化,1 000 r/min离心5 min,收集1×105~5×105细胞,用磷酸盐缓冲液(PBS)洗涤细胞二次,1 000 r/min,离心5 min。加入500 μl的结合缓冲液,轻轻摇晃或者吹打,使细胞悬浮,先加入5 μl Annexin V-增强绿色荧光蛋白(EGFP)混匀后,再加入相同体积 Propidium Iodide混匀。在室温下,避光环境中,反应5~15 min。1 h内,进行流式细胞仪上样检测,激发波长Ex=488 nm;发射波长Em=530 nm。Annexin V-EGFP 的绿色荧光通过FITC 通道(FL1)检测;PI 红色荧光通过PI 通道(FL2 或FL3)检测。荧光补偿调节:使用未经凋亡诱导处理的正常细胞,作为对照进行荧光补偿调节去除光谱重叠和设定十字门的位置。以β-actin为内参,运用Western印迹法分析各感染组BHRF1基因蛋白表达情况,获得各组BHRF1基因表达量,以相同观察时间点空白组细胞BHRF1基因表达量为100%,利用公式:BHRF1表达率(%)=100%×(BHRF1-shRNA组或NC-shRNA组BHRF1基因蛋白表达量/空白组hTERT 表达量),计算各组细胞中BHRF1基因蛋白相对表达水平。酶标仪分析各组细胞,在570 nm处测量每孔吸光值OD,以空白组细胞OD值为100%,通过公式:100%×(处理组OD值/空白组OD值)。流式细胞分析选择感染后48 h作为观察时间点,流式细胞图中,右下象限(FITC+/PI-)为早期凋亡细胞,而右上象限(FITC+/PI+)是晚期凋亡细胞,凋亡率=早期凋亡率+晚期凋亡率。
1.3统计学分析采用SPSS13.0软件进行成组t检验。
2结果
2.1转染后BHRF1基因蛋白表达情况空载体组与NC-shRNA组比较,感染后0、24、48、72 h,BHRF1表达量无改变(P值均>0.05);BHRF1-shRNA组与NC-shRNA组比较,感染后0 h,BHRF1蛋白表达量无改变(P>0.05),感染后24、48、72 h,BHRF1表达量明显降低(P值均<0.05)。BHRF1-shRNA组表现明显时间依赖性,随着观察时间的延长,后一个观察时间点都较前一个观察时间点细胞中BHRF1表达量出现明显下降。见表1。
2.2MTT绘制生长曲线空载体组与NC-shRNA组比较,转染细胞后1~7 d,细胞增殖出现减慢趋势,但无统计学意义(P值均>0.05)。BHRF1-shRNA组与NC-shRNA组比较,感染后1 d就出现了增殖减慢趋势,但差异不显著(P>0.05),2 d后,增殖减慢作用逐渐增强(P值均<0.05)。见表2。
2.3流式细胞检测BHRF1-shRNA对细胞凋亡的影响空载体组与NC-shRNA组凋亡率(9.68%±1.50% vs 10.53%±1.43%)差异不显著(P>0.05)。BHRF1-shRNA组(31.51%±1.59%)与NC-shRNA组、空载体组比较,凋亡作用明显增加(P<0.05)。
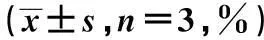
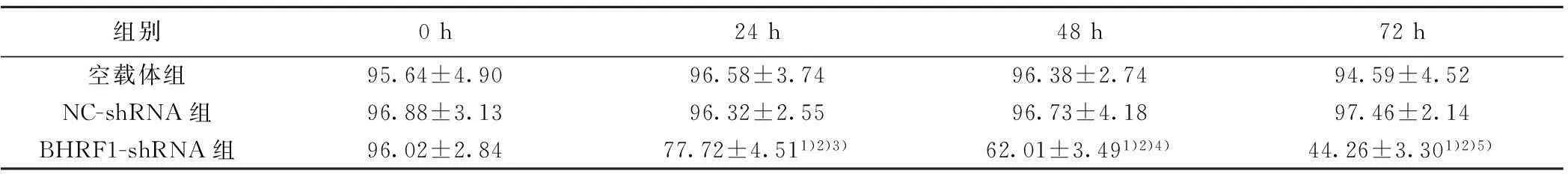
组别0h24h48h72h空载体组95.64±4.9096.58±3.7496.38±2.7494.59±4.52NC-shRNA组96.88±3.1396.32±2.5596.73±4.1897.46±2.14BHRF1-shRNA组96.02±2.8477.72±4.511)2)3)62.01±3.491)2)4)44.26±3.301)2)5)
与空载体组比较:1)P<0.05;与NC-shRNA组比较:2)P<0.05;与0 h比较:3)P<0.05;与24 h比较:4)P<0.05;与48 h比较:5)P<0.05;下表同
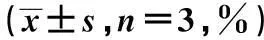

组别1d2d3d4d5d6d7d空载体组89.78±8.0583.72±9.8188.35±9.3587.26±7.9589.14±7.9788.57±6.8590.28±5.60NC-shRNA组87.16±9.2187.68±6.8588.14±9.2686.01±8.1587.16±7.8487.90±7.7188.01±8.62BHRF1-shRNA组82.58±9.2170.02±6.941)2)56.39±5.401)2)50.32±5.881)2)58.38±5.711)2)56.33±4.231)2)59.97±5.451)2)
3讨论
已有研究〔4〕以端粒酶为研究切入点,试图探索鼻咽癌新的治疗靶点和新的治疗模式。端粒酶与鼻咽癌发生发展的密切联系已被许多研究学者证实。范才文等〔5〕使用端粒重复序列扩增法(TRAP)测定了136例原发性鼻咽癌的手术切除标本中端粒酶的活性,其中癌组织中端粒酶的活性阳性率为80.1%,而邻近正常组织标本4.4%;其中小细胞鼻咽癌(SCLC)100%〔6〕。刘瑾等〔7〕首次运用meta分析结果显示,端粒酶活性阳性(标本来源于肺)者患鼻咽癌的危险性是端粒酶阴性者的66.43倍;端粒酶阳性在鼻咽癌人群中出现的概率是非鼻咽癌人群的12.13倍;端粒酶阴性在鼻咽癌人群中出现的概率仅为非鼻咽癌人群的0.22倍〔7〕。Meta分析结果显示端粒酶是一种高灵敏度和特异度的肿瘤标志物〔8〕。
无论是采用何种方式制备shRNA,都需要考虑如何将shRNA高效地导入靶细胞,采用何种基因导入系统是基因治疗的关键,这决定进入靶细胞的基因量,影响基因治疗效果。虽然可以将体外化学合成的siRNA利用阳离子脂质体阳离子脂质体(如LipofectamineTM2000)直接转染细胞,并能特异性抑制哺乳动物细胞内同源基因的表达。但双链siRNA是带负电的聚合物,难以直接通过疏水性的细胞膜〔9,10〕。且shRNA分子易被RNA酶降解。为了解决这些难题,而又不影响shRNA的生物活性,目前常采用的方法是将shRNA序列插入到质粒中,构建shRNA稳定表达载体,然后包裹在脂质体内运输。相比之下,通过构建shRNA表达载体能在细胞内长时间、稳定地生成shRNA。
慢病毒载体本身以及NC-shRNA序列不影响靶基因及其表达蛋白的改变,但会使细胞增殖速度出现减慢趋势,细胞生长受到一定程度的抑制,细胞凋亡率增加〔11,12〕。可见慢病毒颗粒对细胞有一定程度的毒性作用。针对mRNA设计的siRNA序列能特异性地与目的基因BHRF1-shRNA结合,并降解mRNA,进一步使CNE2 mRNA表达下降,引起细胞生长受到抑制,细胞增殖速度减慢,细胞凋亡增加。
4参考文献
1Yang CF,Peng LX,Huang TJ,etal.Cancer stem-like cell characteristics induced by EB virus-encoded LMP1 contribute to radioresistance in nasopharyngeal carcinoma by suppressing the p53-mediated apoptosis pathway〔J〕.Cancer Lett,2014;344(2):260-71.
2Li Z,Chen X,Li L,etal.EBV encoded miR-BHRF1-1 potentiates viral lytic replication by downregulating host p53 in nasopharyngeal carcinoma〔J〕.Int J Biochem Cell Biol,2012;44(2):275-9.
3Kim dN,Lee SK.Biogenesis of Epstein-Barr virus microRNAs〔J〕.Mol Cell Biochem,2012;365(1-2):203-10.
4Jemal A,Bray F,Center MM,etal.Global cancer statistics〔J〕.CA Cancer J Clin,2011;61(2):69-90.
5范才文,田晶,王建红,等.Stathmin表达抑制的鼻咽癌细胞系建立〔J〕.中国现代医学杂志,2012;22(9):43-7.
6Yang F,Zhuo L,Ananda S,etal.Role of reactive oxygen species in triptolide-induced apoptosis of renal tubular cells and renal injury in rats〔J〕.J Huazhong Univ Sci Technolog Med Sci,2011;31(3):335-41.
7刘瑾,杨青,兰亚佳,等.肺癌患者端粒酶表达的meta分析〔J〕.中国肺癌杂志,2001;4(4):299-302.
8宋玉姣,韩继波,陈始明,等.腺病毒介导的shRNA沉默hTERT基因表达对鼻咽癌细胞增殖和凋亡的影响〔J〕.肿瘤防治研究,2011;38(12):1351-5.
9Fu Q,Jiang ZZ,Zhang LY.Impairment of triptolide on liver mitochondria in isolated liver mitochondria and HL7702 cell line〔J〕.Chin J Integr Med,2013;19(9):683-8.
10Borja-Cacho D,Yokoyama Y,Chugh RK,etal.TRAIL and triptolide:an effective combination that induces apoptosis in pancreatic cancer cells〔J〕.J Gastrointest Surg,2010;14(2):252-60.
11李刚,谭晓虹.RNA干扰survivin对口腔表皮样癌细胞株KB生长的抑制作用〔J〕.肿瘤防治研究,2011;38(3):257-60.
12Yinjun L,Jie J,Yungui W.Triptolide inhibits transcription factor NF-kappaB and induces apoptosis of multiple myeloma cells〔J〕.Leukemia Res,2005;29(1):99-105.
〔2013-09-15修回〕
(编辑冯超)
