沉默单酰基甘油脂肪酶mRNA对肝癌大鼠的作用及机制
2015-12-25王金龙,张俊勇,陈懿等
沉默单酰基甘油脂肪酶mRNA对肝癌大鼠的作用及机制
王金龙张俊勇陈懿王晓波1龚建平
(重庆医科大学附属第二医院肝胆外科,重庆400010)
摘要〔〕目的研究沉默单酰基甘油脂肪酶(MAGL)mRNA对大鼠肝癌的作用及其机制。方法CBRH7919大鼠肝癌细胞原位移植法建立大鼠肝癌模型,建模后免疫组化检测肝癌组织及正常肝组织甲胎蛋白(AFP)表达。分为PBS液组;MAGL-shRNA质粒微泡组;空白微泡+超声辐照组;MAGL-shRNA质粒微泡+超声辐照组(A);MAGL-shRNA质粒微泡+超声辐照组(B);MAGL-shRNA质粒微泡+超声辐照组(C)。每只大鼠经尾静脉注射1 ml相应试剂,并对空白微泡+超声辐照组和MAGL-shRNA质粒微泡+超声辐照A、B、C组的大鼠肝区给予超声辐照。前4组:免疫印迹检测大鼠肝癌组织MAGL表达,荧光定量PCR检测MAGL mRNA表达情况,ELISA检测癌组织游离脂肪酸(FFAs)。解剖并比较各组大鼠的肿瘤大小、转移情况。B组给予高脂饮食1 w后与C组一同处死,比较其肿瘤组织MAGL表达情况、FFAs含量以及肿瘤大小。结果肿瘤病理检测符合原发性肝癌。前四组:免疫印迹检测显示,MAGL-shRNA质粒微泡+超声辐照组A的MAGL蛋白表达趋势明显降低;PCR结果显示,该组MAGL-mRNA明显低于其他3组 (P<0.05);ELISA显示该组FFAs含量明显低于其余各组(P<0.05);该组肿瘤平均大小及转移率明显小于其余三组 (P<0.05)。后两组:高脂饮食组癌组织MAGL蛋白表达、FFAs浓度明显高于正常饮食组,且前者肿瘤明显大于后者(P<0.05)。结论沉默MAGL mRNA能够明显抑制大鼠肝癌生长;高脂饮食能够逆转MAGL沉默基因的治疗作用;MAGL作用机制可能是通过调控FFAs及下游因子实现。
关键词〔〕肝癌;单酰基甘油脂肪酶;超声微泡
中图分类号〔〕R73〔
基金项目:重庆市卫生局重点科研项目(2011-1-123)
通讯作者:龚建平(1961-),男,博士,教授,主任医师,主要从事肝胆外科学研究。
1重庆市涪陵中心医院肝胆外科
第一作者:王金龙(1979-),男,硕士,主治医师,主要从事肝胆外科学研究。
现阶段针对肝细胞癌的有效治疗手段以手术和索拉菲尼等药物化疗为主。近年来的研究结果表明脂质代谢紊乱、肥胖等与肝细胞癌的发生密切相关〔1~4〕。单酰基甘油脂肪酶(MAGL)作为甘油三酯代谢的关键酶,可能通过调控游离脂肪酸(FFAs)的生成,并进一步影响FFAs的下游代谢产物,在侵袭性肿瘤的生长、侵袭中发挥重要作用〔5〕。FFAs的几个代谢产物如前列腺素E2(PGE2)、溶血性磷脂酸(LPA)等已经在既往的研究中被证实在肝细胞癌的进展中起重要的促进作用〔6~11〕。本文通过超声微泡靶向转染技术,在大鼠肝癌组织局部转染MAGL-shRNA,通过抑制大鼠肝癌组织MAGL的表达,观察对大鼠肝细胞癌的生长、浸润及转移的影响,并初步探讨其可能的机制。
1材料及方法
1.1动物及饲养健康裸小鼠5只,健康SPF级雄性SD大鼠40只,购自重庆医科大学动物实验中心并在该中心进行饲养。动物使用许可证号:CQLA-2011-2443。实验遵循《重庆市实验动物管理办法》,并已取得重庆医科大学伦理委员会批准。
1.2CBRH7919细胞培养及裸鼠皮下种植及传代CBRH7919大鼠肝癌细胞株购自上海生命科学研究院。培养基采用含10%胎牛血清及青霉素、链霉素双抗的1640培养基,在37℃含5%CO2的恒温孵箱内培养。细胞悬液接种于裸小鼠肩胛部皮下。待其肿块长大至直径约1.0 cm时,麻醉荷瘤裸小鼠完整取出肿块,取生长旺盛之鱼肉样组织切成小块接种于另外一只裸小鼠肩胛皮下传代培养。如此连续传代培养3次后,得到生长旺盛的肿瘤组织,取其边缘生长旺盛的鱼肉样组织切成1 mm3备用〔12~14〕。
1.3SD大鼠移植法原位肝癌模型构建在术前1 d,术后3 d分别给予地塞米松2 mg肌注,2次/d。使用苯巴比妥腹腔麻醉,常规消毒皮肤,取腹部正中切口打开腹腔并暴露肝脏。取肝中叶用眼科镊斜行刺入建立一隧道,将准备好的瘤块放入,使用棉签压迫止血,关闭腹腔,完成操作〔14〕。
1.4判断建模成功麻醉下逐只打开大鼠腹腔观察成瘤情况,发现有32只大鼠建模成功,局部有肿瘤生长,显露的瘤体呈白色,包块偏硬。处死大鼠,病理检测符合原发性肝细胞癌特征。
1.5试验用质粒制备及携MAGL-shRNA超声微泡合成制备好的MAGL-shRNA质粒购自美国Santa Cruz公司,使用紫外分光光度计调整质粒的浓度为1 g/L。按照文献〔15〕的步骤制备超声微泡并将其与质粒DNA进行表面连接,将其浓度调整为0.1 g/L。
1.6治疗方法荷瘤大鼠30只随机分为6组,PBS液组、MAGL-shRNA质粒微泡组(MAGL-shRNA+MB)、空白微泡+超声辐照组(MB+US)、MAGL-shRNA质粒微泡+超声辐照组A(MAGL-shRNA+MB+US A)、MAGL-shRNA质粒微泡+超声辐照组B(MAGL-shRNA+MB+US B)、MAGL-shRNA质粒微泡+超声辐照组C(MAGL-shRNA+MB+US C)。分别经尾静脉注射入1 ml相应试剂。空白质粒微泡+超声辐照组和MAGL-shRNA质粒微泡+超声辐照组A,B,C注射后立即采用超声辐照治疗:频率300 kHz,2 W/cm2,辐照时间为10 s,间隔10 s,总时间20 min〔15〕。3 w后处死前4组大鼠,对于MAGL-shRNA+MB+US B,C组则继续饲养1 w:MAGL-shRNA+MB+US B改为给予高脂饮食饲养,MAGL-shRNA+MB+US C继续给予常规饮食饲养,1 w后处死进行检测。
1.7检测指标及检测方法转染后3 w采用断颈法处死前4组大鼠:(1)认真解剖大鼠,比较各组大鼠肿瘤大小及远处转移情况。(2)Western印迹检测肿瘤组织MAGL蛋白的表达情况。收集大鼠肝癌组织并按照以下步骤进行操作:肿瘤组织匀浆蛋白的提取;检测蛋白浓度;配制分离胶和电泳胶;电泳及转膜;封闭及显色。(3)Q-PCR检测肿瘤组织MAGL mRNA表达情况。首先从收集的大鼠肝癌组织中提取总RNA,按照常规体系配置反应液去基因组。检测总RNA纯度及其完整性无误,进行逆转录。最后进行定量PCR检测,并在PCR仪及电脑上完成操作。(4)肿瘤组织病理学检查,取出肿瘤组织用4%多聚甲醛溶液固定,石蜡切片;HE染色,观察肿瘤组织的病理学分型;免疫2步法测定正常组织及肝癌组织甲胎蛋白(AFP)表达。(5)ELISA检测各组大鼠FFAs含量。
对于后2组大鼠,则继续饲养1 w处死:取肿瘤组织检测MAGL在蛋白水平表达及FFAs浓度,比较2组肿瘤的平均大小,具体方法同上述。
2结果
2.1大鼠肿瘤病理学结果打开大鼠腹腔,可见灰白色肿块位于大鼠肝脏表面,切开后肿瘤组织呈鱼肉样,其与周围组织分界不清,无明显包膜。HE染色后于镜下观察可见弥漫排列的肿瘤细胞,呈浸润性生长,肿瘤细胞形态不规则,较多核分裂相,胞质丰满,内有较多空泡。见图1。
2.2免疫组化检测结果检查结果显示大鼠肝细胞癌组织AFP表达明显较正常肝组织高,其镜下表现在细胞胞质内呈棕黄色或者棕褐色,弥漫分布,如图2。
2.3Western印迹结果检测显示各组实验大鼠肝癌组织在33 kD处都显现特异性条带;其中前4组比较,MAGL-shRNA+MB+US组A(4组)的MAGL蛋白表达趋势明显弱于其他各组;后两组比较,高脂饮食组(5组)明显较常规饮食组(6组)表达升高,见图3。
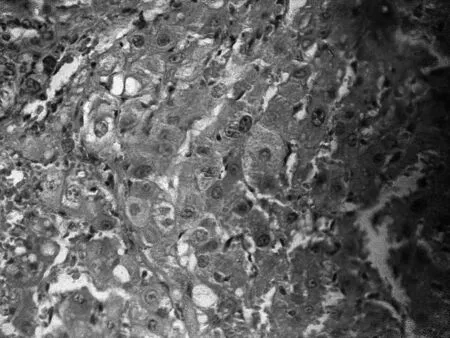
图1 大鼠肝癌HE染色镜检结果(×400)
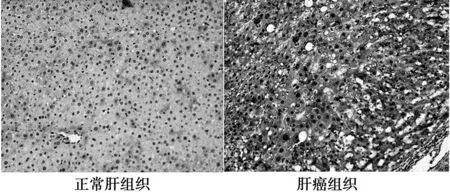
图2 正常与肝癌组织AFP表达(DAB)
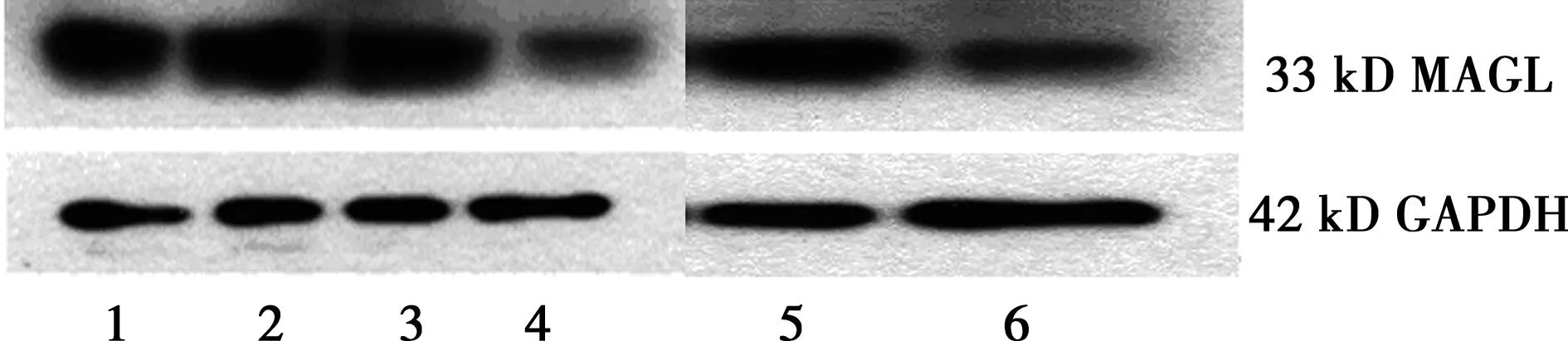
1:PBS组, 2:MAGL-shRNA+MB组,3:MB+US组,4:MAGL-shRNA+MB+US组A,5:MAGL-shRNA+MB+US组B,6:MAGL-shRNA+MB+US组C 图3 大鼠肝癌组织MAGL的Western印迹测定结果
2.4肝癌组织RT-PCR检测结果MAGL-shRNA+MB+US组A(4组)较其余3组MAGL mRNA表达明显降低(P<0.05)。
2.5癌组织FFAs检测结果MAGL-shRNA+MB+US组A较其余三组FFAs浓度明显降低(P<0.05);高脂饮食组较常规饮食组明显升高(P<0.05)。
2.6肿瘤大小及转移情况MAGL-shRNA+MB+US A组肿块平均大小(0.35 cm3)及转移率(20%)较其余三组(PBS组0.80 cm3,80%;MAGL-shRNA+MB组0.78 cm3,100%;MB+US组0.82 cm3,80%)均明显降低(P<0.05),高脂饮食组肿瘤直径(1.1 cm)明显大于正常饮食组(0.6 cm)。
3讨论
肝癌以我国的发病率最高,目前治疗方案效果都不够满意,亟需在治疗手段上取得突破。脂质代谢和基因治疗是随着医学的发展出现的关于多种肿瘤治疗的热点并且取得了许多重要的进展;作为脂代谢的主要器官,目前认为肝癌的发生发展与脂代谢紊乱有明显相关性。那么在肝癌方面,能否通过改变肝癌相关脂代谢的基因信息来有效治疗肝癌成为我们一个亟需解决的问题。
近年来对于MAGL的研究取得了重要进展,研究者们发现作为甘油三酯代谢的一个关键酶不止在正常组织的能量代谢中起重要作用,而且可能在肿瘤组织中作为一个脂质代谢的调节中心通过促进FFAs及其下游脂质代谢产物的生成,从而促进肿瘤的增殖、浸润和转移,这已经在恶性黑色素瘤、乳腺癌、大肠癌等恶性肿瘤的研究中得到了证实〔5〕。本研究结果表明肿瘤组织FFAs的含量与MAGL呈正相关,这表明MAGL可能通过调节FFAs的生成进而影响FFAs的下游代谢产物中肿瘤信号因子的含量,调控肝癌细胞的增殖、浸润及转移。另外高脂饮食的摄入能够逆转基因沉默的治疗效果,而其作用机制可能与MAGL及FFAs的再次升高有关。这也表明,高脂饮食有可能会促进肝癌的生长,为肝癌患者的饮食治疗提供了可能的依据。
我们在试验中用到的鼠类移植性肝癌模型,而在此前的试验中我们采用过化学诱导建模,在建模成功后我们发现肿瘤弥散性生长,无法观察其肿瘤生长情况,我们仅能通过比较肿瘤转移率发现敲低该基因治疗可能有效。因此我们再次采用大鼠肝癌细胞株原位移植法进行建模,建模成功后肿瘤单发生长且分泌AFP明显增加,与临床上肝癌的病理表现近似,是理想的肝癌研究动物模型〔16~21〕。
综上所述,MAGL通过基因转染并敲低了MAGL在肝癌组织的表达,肿瘤的生长及转移率均呈明显下降。这个发现为肝细胞癌的治疗提供了一个可能的治疗靶点。同时我们使用高质饮食逆转MAGL基因沉默造成的治疗效果以及对于癌组织FFAs测定的结果也为肝癌患者饮食治疗及相关研究提供了可能的依据和机制。我们期待后续的试验能够更进一步,为临床治疗肝细胞癌打开一扇新的大门。
4参考文献
1World Health Organization.Mortality database.www.who.int/whosis/en.Accessed February,2014.
2Kurosaki M,Hosokawa T,Matsunaga K,etal.Hepatic steatosis in chronic hepatitis C is a significant risk factor for developing hepatocellular carcinoma independent of age,sex,obesity,fibrosis stage and response to interferon therapy〔J〕.Hepatol Res,2010;40(9):870-7.
3Kessler SM,Simon Y,Gemperlein K,etal.Fatty acid elongation in non-alcoholic steatohepatitis and hepatocellular carcinoma〔J〕.Int J Mol Sci,2014;15(4):5762-73.
4Choi J,Corder NL,Koduru B,etal.Oxidative stress and hepatic Nox proteins in chronic hepatitis C and hepatocellular carcinoma〔J〕.Free Radic Biol Med,2014;14(1):191-9.
5Nomura DK,Long JZ,Niessen S,etal.Monoacylglycerol lipase regulates a fatty acid network that promotes cancer pathogenesis〔J〕.Cell,2010;140(1):49-61.
6Skill NJ,Scott RE,Wu J,etal.Hepatocellular carcinoma associated lipid metabolism reprogramming〔J〕.J Surg Res,2011;169(1):51-6.
7Park SY,Jeong KJ,Panupinthu N,etal.Lysophosphatidic acid augments human hepatocellular carcinoma cell invasion through LPA1 receptor and MMP-9 expression〔J〕.Oncogene,2011;30(11):1351-9.
8Bai X,Wang J,Zhang L,etal.Prostaglandin E2receptor EP1-mediated phosphorylation of focal adhesion kinase enhances cell adhesion and migration in hepatocellular carcinoma cells〔J〕.Int J Oncol,2013;42(5):1833-41.
9Geis NA,Katus HA,Bekeredjian R.Microbubbles as a vehicle for gene and drug delivery:current clinical implications and future perspectives〔J〕.Curr Pharm Res,2012;18(15):2166-83.
10Nomikou N,McHale AP.Microbubble-enhanced ultrasound-mediated gene transfer-towards the development of targeted gene therapy for cancer〔J〕.Int J Hyperthermia,2012;28(4):300-10.
11Wirth T,Parker N,Ylä-Herttuala S.History of gene therapy〔J〕.Gene,2013;525(2):162-9.
12Kiessling F,Fokong S,Koczera P,etal.Ultra-sound microbubbles for molecular diagnosis,therapy,and theranostics〔J〕.J Nucl Med,2012;53(3):345-8.
13De Minicis S,Kisseleva T,Francis H,etal.Liver carcinogenesis:rodent models of hepatocarcinoma and cholangiocarcinoma〔J〕.Dig Liver Dis,2013;45(6):450-9.
14Jiang HC,Meng QH,Tan HT,etal.Antiangiogenic therapy enhances the efficacy of transcatheter arterial embolization for hepatocellular carcinomas〔J〕.Int J Cancer,2007;121(2):416-24.
15Jiang ZZ,Xia GY,Zhang Y,etal.Attenuation of hepatic fibrosis through ultrasound-microbubble-mediated HGF gene transfer in rats〔J〕.Clin Imaging,2013;37(1):104-10.
16Zhong XG,He S,Yin W.Selective tropism of liver stem cells to hepatocellular carcinoma in vivo〔J〕.World J Gastroenterol,2007;13(28):3886-91.
17Sun X,Jiang H,Jiang X,etal.Antisense hypoxia-inducible factor-1alpha augments transcatheter arterial embolization in the treatment of hepatocellular carcinomas in rats〔J〕.Hum Gene Ther,2009;20(4):314-24.
18Sun RR,Noble ML,Sun SS,etal.Development of therapeutic microbubbles for enhancing ultrasound-mediated gene delivery〔J〕.J Control Release,2014;182:111-20.
19Alejandro F,Josep ML,Jordi B,etal.Hepatocellular carcinoma〔J〕.Lancet,2012; 379(11):1245-55.
20Samuele DM,Tatiana K,Heather F,etal.Liver carcinogenesis:rodent models of hepatocarcinoma and cholangiocarcinoma〔J〕.Dig Liver Dis,2013;45(6):450-9.
21陈懿,王晓波,张俊勇,等.超声微泡携MAGL-shRNA靶向释放对大鼠肝细胞肝癌转移作用的实验研究〔J〕.第三军医大学学报,2013:35(16):1709-11.
〔2013-10-17修回〕
(编辑徐杰)
