水飞蓟宾通过上调P15INK4B和P21WAF1/CIP1活化JNK诱导人胰腺癌细胞G1期阻滞及细胞凋亡
2015-12-24张晓凯王娟娟吴志慧蒋建伟
王 莉,张晓凯,张 鹏,王娟娟,吴志慧,林 晨,蒋建伟
(1.广州市番禺区中心医院检验科,广东广州511400;2.南阳市第一人民医院普外科,河南南阳473000;暨南大学医学院3.生物化学教研室,4.微生物与免疫学教研室,广东广州510632)
水飞蓟宾通过上调P15INK4B和P21WAF1/CIP1活化JNK诱导人胰腺癌细胞G1期阻滞及细胞凋亡
王 莉1,张晓凯2,3,张 鹏4,王娟娟3,吴志慧3,林 晨4,蒋建伟3
(1.广州市番禺区中心医院检验科,广东广州511400;2.南阳市第一人民医院普外科,河南南阳473000;暨南大学医学院3.生物化学教研室,4.微生物与免疫学教研室,广东广州510632)
目的:探讨水飞蓟宾对胰腺癌AsPC-1细胞的增殖抑制作用及其作用机制.方法:MTT法和克隆形成抑制实验观察水飞蓟宾对人胰腺癌AsPC-1细胞的增殖抑制作用,碘化丙锭(PI)单染色检测细胞周期改变,Annexin V-FITC/PI双染流式细胞术检测细胞凋亡水平,Western blotting检测细胞周期及细胞凋亡相关蛋白的表达.结果:不同浓度的水飞蓟宾对胰腺癌AsPC-1细胞的生长均有抑制作用,且呈剂量-效应和时间-效应关系(P<0.05),水飞蓟宾作用于AsPC-1细胞48、72 h的IC50浓度分别为224.20、87.25 μmol/L;克隆形成抑制实验显示,随着水飞蓟宾浓度增加,AsPC-1细胞克隆形成逐渐减少.细胞周期检测结果显示,随着水飞蓟宾浓度的增加,胰腺癌AsPC-1细胞出现明显G1期阻滞;水飞蓟宾处理组细胞的周期蛋白CyclinD1、CyclinE2、CyclinA、CyclinB1表达下降,细胞周期蛋白激酶CDK4、CDK6表达不变,细胞周期素依赖性蛋白激酶抑制蛋白P15INK4B、P21WAF1/CIP1表达升高,与流式检测的结果相一致.不同浓度水飞蓟宾作用48 h后,出现明显的凋亡细胞群;同时发现Caspase-9、Caspase-3活化降解,Caspase3下游效应蛋白PARP出现切割条带.JNK蛋白表达增加并磷酸化活化,Bcl-2蛋白家族中抗凋亡蛋白Bcl-2、Bcl-xL、Mcl-1表达明显降低,促凋亡蛋白Bax表达基本不变,BH3-only蛋白Bclxs、Bid、Bim表达增加.结论:水飞蓟宾明显抑制胰腺癌细胞增殖,通过诱导P15INK4B、P21WAF1/CIP1表达阻滞细胞周期在G1期,并通过诱导JNK活化激活线粒体细胞凋亡途径,进而诱导胰腺癌AsPC-1细胞凋亡.
水飞蓟宾;胰腺癌AsPC-1细胞;细胞周期;凋亡
胰腺癌,主要发生在胰外分泌腺的恶性肿瘤,是一种常见的恶性程度很高的消化道肿瘤,位居美国恶性肿瘤死亡原因的第4位,占中国恶性肿瘤死亡原因的第5位,胰腺癌的发病率和死亡率近些年来在中国呈逐年上升趋势[1].胰腺癌起病隐匿,早期多无特殊临床表现,目前能够发现属于Ⅰ期的病人的机会是非常少.同时,即使是早期的胰腺癌,诊断时经常已经发生转移.手术治疗仍然是胰腺癌的主要治疗方法,但是临床上确诊胰腺癌患者中仅有10%~20%的人能够行外科手术治疗,胰腺癌切除后的5年生存率不超过10%,而5年生存的患者中50%将在随后的5年内死于复发,更早期的切除或更广泛的切除并不能明显改变此现状[2].无手术切除机会的胰腺癌病人,需要化疗或者放疗等辅助治疗手段延长生存期.目前胰腺癌的化疗通常选用吉西他滨、卡培他滨、爱斯万、氟尿嘧啶、丝裂霉素、阿霉素、三氧化二砷等药物联合化疗,但胰腺癌对于化疗不敏感,疗效不佳[2-3].因此,寻找对胰腺癌敏感的化疗药物或者提高胰腺癌对化疗药物敏感性的方法、减轻放化疗的毒副作用,对于目前提高胰腺癌的治疗效果,改善预后具有十分重要的意义.
水飞蓟宾(silibinin)是从菊科植物水飞蓟中提取的黄酮类化合物.水飞蓟已经被用于解毒和治疗肝脏疾病,被称为天然的护肝药物,在治疗肝脏疾病、糖尿病、蕈类中毒、神经变性疾病和各种类型的癌症等疾病中具有潜在的临床价值[4-5].研究发现,水飞蓟宾能抑制许多不同类型的肿瘤细胞增殖:皮肤癌、乳腺癌、宫颈癌、前列腺癌、结肠癌、胃癌、膀胱癌、肺癌、卵巢癌、肾癌、舌癌、肝癌及白血病等,其主要机制为:预防肿瘤发生,抗炎、诱导细胞凋亡、抗迁移和抗血管生成[6-10].但是对胰腺癌的研究报道较少,本实验以人胰腺癌AsPC-1细胞为实验对象,探讨水飞蓟宾对胰腺癌细胞的增殖抑制作用及其作用机制.
1 材料与方法
1.1 材料
转移性胰腺腺癌细胞AsPC-1由暨南大学医学院生物化学教研室提供;水飞蓟宾标准品购自于四川省维克奇生物科技有限公司;胎牛血清、RPMI 1640干粉培养基、胰蛋白酶和EDTA购自美国Gbico公司;噻唑蓝(3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-diphenytetrazoliumromide,MTT)、二甲基亚砜(dimethylsulphoxide,DMSO)、膜连蛋白-异硫氢酸荧光素(AnnexinV-FITC)、碘化丙锭(propidium iodide,PI)购自于美国Sigma公司;CyclinD1、CyclinE2、CyclinA、CyclinB2、CDK4、CDK6、P15、P21、Bax、Bcl-2、Bcl-xL、Mcl-1、Bid、Bim、Caspase-9、Caspase-3、PARP、GAPDH一抗均购于美国Cell Signaling Technology公司.电化学发光液(electrochemiluminescence,ECL)购于南京凯基生物科技发展有限公司.
1.2 方法
(1)细胞培养 人胰腺癌AsPC-1细胞加入含体积分数为5%胎牛血清的RPMI 1640培养基,置37℃、体积分数为5%CO2的细胞培养箱常规培养,细胞贴壁达到70%时,以质量分数为0.25%胰蛋白酶与0.01%EDTA的细胞消化液消化传代.
(2)细胞生长抑制实验 取对数生长期AsPC-1细胞和L02细胞,用含有体积分数为5%胎牛血清RPMI 1640培养液调细胞密度5.0×104/mL,接种到96孔板,每孔100 μL,即每孔5 000个细胞.培养24 h后,分别加入浓度为25、50、100、200、300、400和500 μmol/L的水飞蓟宾,每组设5个复孔,同时设不加药物的细胞对照组和溶剂对照组,置37℃、体积分数为5%CO2培养箱培养,24、48和72 h时,每孔加入质量浓度5 mg/mL的MTT溶液20 μL,继续培养4 h,吸弃上清液,每孔加入150 μL DMSO,振荡10 min,用酶联免疫检测仪于波长570 nm处(参考波长为600 nm)测定各孔吸光度(A)值,并计算各组抑制率,抑制率(%)=(1-A实验组/A对照组)×100%.
(3)克隆形成抑制实验 取对数生长期Aspc-1细胞,用含体积分数10%胎牛血清的RPMI-1640培养液调细胞悬液为300个/孔接种于12孔培养板,每组设2个复孔,水飞蓟宾终浓度为0、12.5、25、50 μmol/L,置37℃,体积分数为5%CO2培养箱培养7 d,吸去培养液,PBS洗涤两次后,V甲醇∶V冰醋酸=3∶1固定液固定10 min,结晶紫染色20 min后流水冲洗,照相.
(4)碘化丙锭(propidine iodide,PI)单染色流式细胞术检测细胞周期 取对数生长期胰腺癌AsPC-1细胞,调细胞3.0×105/mL,接种于6孔板.培养24 h之后分别加入浓度为50、100和200 μmol/L的水飞蓟宾,同时设细胞对照组和DMSO溶剂对照组,终体积2 mL.继续培养48 h后,消化收集细胞,1 000 r/min离心5 min,弃去上清.预冷PBS重悬细胞,离心、洗涤2次,用体积分数为75%乙醇4℃固定过夜.上机前用预冷的PBS洗涤3次后,加入PI染色液(含RNA酶),终质量浓度500 g/L,避光染色30 min,用300目尼龙网过滤后,流式细胞术分析细胞DNA含量的变化,每个样本分析104个细胞.
(5)Annexin V-FITC/PI双染色流式细胞仪检测细胞早期凋亡 取对数生长期胰腺癌AsPC-1细胞,调细胞3.0×105/mL,接种于6孔板.培养24 h后分别加入浓度为50、100和200 μmol/L的水飞蓟宾,同时设细胞对照组和DMSO溶剂对照组,终体积2 mL.培养48 h后,消化收集细胞,1 000 r/min离心5 min,弃去上清.PBS重悬细胞,离心、洗涤2次,以染色缓冲液重悬,分别加入10 μL Annexin VFITC和5 μL PI,轻轻混匀,室温避光反应15 min.加入200 μL染色缓冲液,流式细胞术检测,并分析早期凋亡细胞和晚期凋亡细胞的百分率,每个样本分析104个细胞.
(6)免疫印迹法检测蛋白表达的变化 取对数生长期AsPC-1细胞,调细胞3.0×105/mL,接种于6孔板.培养24 h后,分别加入浓度为50、100、150和200 μmol/L的水飞蓟宾,同时设细胞对照组和DMSO溶剂对照组,终体积2 mL.培养48 h后,收集悬浮及贴壁的细胞,1 000 r/min离心5 min,用PBS洗2次,吸尽PBS;细胞裂解液于冰上裂解30 min,12 000 r/min离心15 min,收集上清液.经BCA法测蛋白浓度后,以上样30 μg为基准,计算出上样体积.样品蛋白置于1×SDS凝胶加样缓冲液中,95℃5 min;电泳后将蛋白转印至PVDF膜上,质量分数为5%脱脂奶粉封闭后,一抗孵育过夜,再以辣根过氧化物酶标记的二抗室温孵育1 h,ECL发光液孵育后,在凝胶成像系统中拍照.
1.3 统计学处理
实验结果均3次独立实验,数据采用SPSS 13.0统计软件处理,计量资料以(均数±标准差)(±s)表示,P<0.05有统计学差异.
2 结果
2.1 水飞蓟宾对人胰腺癌AsPC-1细胞的生长抑制作用
MTT法检测发现,细胞对照组(0浓度组)和DMSO组相比,差异无显著性(P>0.05).不同浓度的水飞蓟宾分别作用于人胰腺癌AsPC-1细胞24、48、72 h后,高浓度组出现明显的增殖抑制作用,与对照组相比,差异具有统计学意义(P<0.05),水飞蓟宾作用于AsPC-1细胞在48和72 h的IC50分别为224.20、87.25 μmol/L.随着水飞蓟宾药物浓度的增加以及作用时间的增加,AsPC-1细胞增殖抑制现象越来越明显,表明水飞蓟宾以剂量依赖和时间依赖的方式抑制细胞增殖(图1).

图1 不同浓度的水飞蓟宾对胰腺癌AsPC-1细胞的增殖抑制作用Fig.1 Proliferation inhibition of pancreatic cancer AsPC-1 cells by Silibinin of different concentration
2.2 水飞蓟宾对人胰腺癌Aspc-1细胞克隆形成的影响
水飞蓟宾作用于胰腺癌AsPC-1细胞7 d,随着水飞蓟宾药物浓度的增加,低浓度组(12.5 μmol/L)出现细胞克隆较对照组增多,具有促增殖作用,与MTT法的结果相一致.高浓度组(50 μmol/L)与DMSO对照组比较,细胞克隆明显减少(图2).

图2 不同浓度的水飞蓟宾对胰腺癌AsPC-1细胞的克隆形成抑制作用Fig.2 Clone formation inhibition of pancreatic cancer AsPC-1 cells by silibinin of different concentration
2.3 PI单染色检测胰腺癌AsPC-1细胞周期改变
流式细胞术PI单染色分析显示:不同浓度的水飞蓟宾作用于胰腺癌AsPC-1细胞48 h后,与对照组相比,随着药物浓度的增加,细胞G1期DNA的含量明显增加,S期和G2期百分比减少,表明细胞周期阻滞于G1期(图3).
2.4 Western blot检测细胞周期相关蛋白表达
水飞蓟宾作用于人胰腺癌AsPC-1细胞48 h后,免疫印迹法检测细胞周期相关蛋白表达情况,结果显示,与G1期相关的细胞周期蛋白Cyclin D的表达明显减少,与G1晚期、S期、G2期相关的细胞周期蛋白Cyclin E2、Cyclin A、Cyclin B1的表达均减少,细胞周期蛋白激酶CDK4和CDK 6的表达变化不明显,与G1期相关的负性调节蛋白P15INK4B和P21WAF1/CIP1的表达则明显增加,表明细胞周期被阻滞于G1期,与流式细胞术检测细胞周期的结果一致(图4).
2.5 Annexin V-FITC/PI双染色检测细胞凋亡
水飞蓟宾作用于胰腺癌AsPC-1细胞48 h后,利用Annexin V-FITC/PI双染流式细胞术检测,左下限(LL)为正常细胞群,右下限(LR)为早期凋亡细胞群,左上限(LU)为自噬性死亡和非特异性死亡细胞群,右上限(UR)为晚期凋亡细胞,与DMSO对照组相比,加药处理组细胞的早期凋亡率和晚期凋亡率随药物浓度的增加而增多,200 μmol/L的水飞蓟宾作用胰腺癌AsPC-1细胞48 h后,细胞凋亡率为29.44%(图5).

图3 水飞蓟宾对AsPC-1细胞细胞周期的影响Fig.3 Effect of silibinin on cell cycle distribution of AsPC-1 cells

图4 Western blotting检测细胞周期相关蛋白表达水平Fig.4 The expression of cell cycle associate proteins analyzed by Western blotting
2.6 Western blotting检测Caspase-9、Caspase-3和PARP的表达
水飞蓟宾作用于胰腺癌AsPC-1细胞48 h后,Caspase-9、Caspase-3蛋白表达减少,PARP蛋白也减少,且出现了切割条带,提示发生细胞凋亡(图6).
2.7 Western blotting检测SAPK/JNK通路蛋白的表达
免疫印迹法检测SAPK/JNK通路蛋白JNK和P-JNK.不同浓度的水飞蓟宾作用于人胰腺癌AsPC-1细胞后,磷酸化JNK表达增加,提示JNK通路的活化(图7).
2.8 Western blotting检测Bcl-2家族蛋白表达
水飞蓟宾处理后的细胞,Bcl-2家族中的抗凋亡蛋白Bcl-2、Mcl-1、Bcl-xL的表达均减少,BH3-only蛋白家族成员Bcl-xs、Bid、Bim表达明显增加,促凋亡蛋白Bax的表达未见明显变化.Bcl-2/Bax、Mcl-1/Bax、Bcl-xL/Bax比值下降,表明激活线粒体凋亡途径(图8).

图5 不同浓度水飞蓟宾对AsPC-1细胞凋亡的影响Fig.5 Effect of Silibinin on the induction of apoptosis in AsPC-1 cells

图6 Western blotting检测Caspase-9、Caspase-3和PARP的表达水平Fig.6 The expression of Caspase-9,Caspase-3 and PARP analyzed by Western blotting

图7 Western blotting检测JNK和P-JNK的表达水平Fig.7 The expression of JNK and P-JNK analyzed by westernblotting
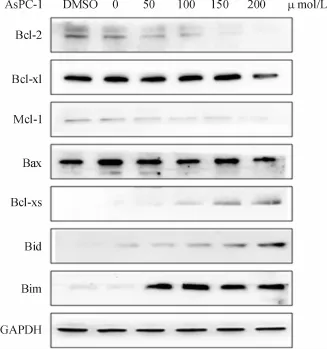
图8 Western blotting检测Bcl-2家族蛋白的表达水平Fig.8 The expression of Bcl-2 family analyzed by Western blotting
3 讨论
研究发现,水飞蓟宾对多种肿瘤细胞生长均具有抑制作用,包括皮肤癌、乳腺癌、宫颈癌、前列腺癌、结肠癌、胃癌、膀胱癌、肺癌、卵巢癌、肾癌、舌癌、肝癌和白血病等[6-10].最近有研究报道,水飞蓟宾抑制胰腺癌细胞生长,但对作用机制研究较少[11-12].本研究采用MTT法证实,水飞蓟宾对人胰腺癌AsPC-1细胞具有显著的增殖抑制作用,且呈时间和浓度依赖关系,水飞蓟宾作用于胰腺癌AsPC-1细胞48、72 h的IC50浓度分别为224.20、87.25 μmol/L;同时,随着水飞蓟宾作用浓度增加,AsPC-1细胞克隆形成逐渐减少.
细胞通过多种周期相关蛋白调控细胞周期进展,保证细胞周期的顺利交替.细胞周期相关蛋白有细胞周期蛋白(Cyclins)和细胞周期蛋白依赖性蛋白激酶(cyclin-dependent kinases,CDKs)、细胞周期蛋白依赖性蛋白激酶抑制因子(cyclin-dependent kinase inhibitors,CKIs),其中Cyclins、CDKs对细胞周期进展起正调控作用,CKIs起负性调控作用,如CDK 4、CDK 6和CDK 2与Cyclin D、Cyclin E的复合体激活能直接促进G1/S转折,同时CKIs家族中的P15、P16、P18与P19可以特异性抑制CDK4或CDK6的活性,而P21与P27可以广泛地抑制CDKs-Cyclins复合物的活性.在本实验中,水飞蓟宾处理胰腺癌AsPC-1细胞48 h后,细胞周期被阻滞于G1期,进一步检测发现,与G1/S检验点调控有关的Cyclin D1与Cyclin E2的表达减少,细胞周期蛋白激酶CDK4和CDK 6的表达变化不明显,与G1期相关的负性调节蛋白P15INK4B和P21WAF1/CIP1的表达则明显增加,Cyclin D1/CDK4、Cyclin D1/CDK6活性抑制,胰腺癌细胞发生G1期阻滞,与流式细胞术检测结果一致.
目前研究发现有3条细胞凋亡途径,即死亡受体相关途径、线粒体凋亡途径、内质网相关的细胞凋亡途径,最终都引起Caspase级联反应的激活.Caspase家族属于半胱氨酸蛋白酶,其中Caspase-9是线粒体细胞凋亡途径的1个蛋白,线粒体凋亡途径活化将导致Caspase-9的酶切活化,切割下游Caspase-3,进而切割聚ADP-核糖多聚酶(PARP).Caspase-3和PARP的降解,是细胞凋亡的分子标志.本实验中,流式细胞术检测表明,水飞蓟宾处理AsPC-1细胞后,细胞发生了凋亡,并导致Caspase-9、Caspase-3与PARP蛋白酶切活化,提示水飞蓟宾通过诱导线粒体凋亡途径促进胰腺癌AsPC-1细胞凋亡.
SAPK/JNK信号通路对凋亡具有调控作用,JNK的磷酸化活化,促进Bcl-2、Bcl-xL的磷酸化,导致Bax/Bcl-2、Bax/Bcl-xL异二聚体解离,促进Bax寡聚化,促进线粒体凋亡途径的发生[13-14].本研究结果提示水飞蓟宾作用于AsPC-1细胞,JNK的表达增加,且JNK磷酸化水平增加,与Duan的报道相一致[15],表明水飞蓟宾作用于胰腺癌细胞后,激活了JNK信号通路,并进一步诱导细胞通过线粒体凋亡途径诱导细胞凋亡.
线粒体凋亡途径与Bcl-2蛋白家族表达和活化相关.Bcl-2蛋白家族分Bcl-2抗凋亡蛋白家族和促凋亡蛋白家族.抗凋亡蛋白家族成员有Bcl-2、BclxL、Mcl-1、A1/BFL-1、Bcl-w、Boo/DIVA与NR-13等;促凋亡的Bcl-2家族蛋白根据BH结构域的数量分为两个亚家族,包含3个BH结构域(BH1-3)的Bax、Bak和Bok,以及只含有BH3结构域的BH-3 only蛋白包括Bid、Bad、Bcl-xs、Bik/NBK、BLK、HRK、Bim、BNIP3、NIX与NOXA等[16].Bcl-2蛋白家族成员调控着线粒体细胞凋亡途径[17-19].本实验中,水飞蓟宾处理AsPC-1细胞后,随着水飞蓟宾作用浓度的增加,抗凋亡蛋白Bcl-2,Mcl-1和Bcl-xL的表达下降或被降解,而BH3-only蛋白Bid,Bim和Bcl-xs的表达则逐步增加,且呈浓度依赖性,促凋亡蛋白Bax表达不变.BH3-only蛋白Bid,Bim和Bclxs可通过与Bcl-2,Mcl-1和Bcl-xL等形成异二聚体,促进Bcl-2/Bax、Mcl-1/Bax、Bcl-xL/Bax异二聚体的解离,促进Bax的游离和寡聚化,促进线粒体释放细胞色素C,促进线粒体凋亡途径发生.同时抗凋亡蛋白Bcl-2,Mcl-1和Bcl-xL的蛋白水平下降,Bax/Bcl-2、Bax/Mcl-1、Bax/Bcl-xL比值增高,促进Bax的游离,促进线粒体凋亡途径的发生.
综上所述,水飞蓟宾明显抑制胰腺癌细胞增殖,通过诱导P15INK4B、P21WAF1/CIP1表达阻滞细胞周期在G1期,并诱导JNK活化激活线粒体细胞凋亡途径,进而诱导胰腺癌AsPC-1细胞凋亡.JNK的活化可转录激活p53,p53的活化可转录激活p21,水飞蓟宾诱导胰腺癌细胞周期阻滞是否存在此代谢通路的活化还有待进一步证明,水飞蓟宾活化JNK后是否促进Bcl-2与Bax,Bcl-xL与Bax的解离,进而促进Bax的寡聚化,另外,水飞蓟宾在整体水平如何抑制胰腺癌肿瘤生长还有待进一步证明.
[1]黄志强.胰腺癌外科近况[J].中华腔镜外科杂志,2012,5(1):1-4.
[2]张群华,倪泉兴.胰腺癌2340例临床病例分析[J].中华医学杂志,2004,84(3):41-45.
[3]HEINEMANN V,HAAS M,BOECK S.Systemic treatment of advanced pancreatic cancer[J].Cancer Treat Rev,2012,38(7):843-853.
[4]CHEUNG C W,GIBBONS N,JOHNSON D W,et al.Silibinin-a promising new treatment for cancer[J].Anticancer Agent Me,2010,10(3):186-195.
[5]GAZAK R,WALTEROVA D,KREN V.Silybin and silymarin-New and emerging applications in medicine[J].Curr Med Chem,2007,14(3):315-338.
[6]巫秀美,刘光明,冯玉冰,等.水飞蓟宾类黄酮木质素衍生物的研究进展[J].国际药学研究杂志,2010,37(3):187-197.
[7]鲁小梅,王 盛,刘瑞江,等.水飞蓟素抗肿瘤作用及其机制研究进展[J].中国药理学与毒理学杂志,2009,23(4):320-324.
[8]WANG Y X,CAI H,JIANG G,et al.Silibinin inhibits proliferation,induces apoptosis and causes cell cycle arrest in human gastric cancer MGC803 cells via STAT3 pathway inhibition[J].Asian Pac J Cancer Prev,2014,15(16):6791-6798.
[9]ZHANG Y,LI Q,GE Y,et al.Silibinin triggers apoptosis and cell-cycle arrest of SGC7901 cells[J].Phytother Res,2013,27(3):397-403.
[10]ZHANG Y,GE Y,CHEN Y,et al.Cellular and molecular mechanisms of silibinin induces cell-cycle arrest and apoptosis on HeLa cells[J].Cell Biochem Funct,2012,30(3):243-248.
[11]GE Y K,ZHANG Y X,CHEN Y P,et al.Silibinin causes apoptosis and cell aycle arrest in some human pancreatic cancer cells[J].Int J Mol Sci,2011,12,4861- 4871.
[12]NAMBIAR D,PRAJAPATI V,AGARWAL R,et al.In vitro and in vivo anticancer efficacy of silibinin against human pancreatic cancer BxPC-3 and PANC-1 cells[J].Cancer Lett,2013,334,109-117.
[13]ZHOU F F,YANG Y,XING D.Bcl-2 and Bcl-xL play important roles in the crosstalk between autophagy and apoptosis[J].FEBS J,2011,278:403-413.
[14]WEI Y,LEBINE S B.Dual role of JNK1-mediated phosphorylation of Bcl-2 in autophagy and apoptosis regulation[J].Autophagy,2008,4(7):949-951.
[15]DUAN W J,LI Q S,XIA M Y,et al.Silibinin activated p53 and induced autophagic death in human fibro sarcoma HT1080 cells via reactive oxygen species-p38 and c-Jun N-terminal kinase pathways[J].Biol Pharm Bull,2011,34(1):47-53.
[16]KANG M H,REYNOLDS C P.Bcl-2 Inhibitors:targeting mitochondrial apoptotic pathways in cancer therapy[J].Clin Cancer Res,2009,15,1126-1132.
[17]LETAI A,BASSIK M C,WALENSKY L D,et al.Distinct BH3 domains either sensitize or activate mitochondrial apoptosis,serving as prototype cancer therapeutics[J].Cancer Cell,2002,2:183-192.
[18]ESKES R,DESAGHER S,ANTONSSON B,et al.Bid induces the oligomerization and insertion of Bax into the outer mitochondrial membrane[J].Mol Cell Biol,2000,20(3):929-935.
[19]MAIURI M C,ZALCKVA E,KIMCHI A,et al.Selfeating and self-killing:crosstalk between autophagy and apoptosis[J].Nat Rev Mol Cell Biol,2007,8,741-752.
[责任编辑:朱颖嫄]
Silibinin trigged G1 arrest and apoptosis of human pancreatic cancer cells via upregulating P15INK4B,P21WAF1/CIP1and activating JNK
WANG Li1,ZHANG Xiaokai2,3,ZHANG Peng4,WANG Juanjuan3,WU Zhihui3,LIN Chen4,JIANG Jianwei3
(1.Department of Laboratory,Panyu Center Hospital,Guangzhou 511440,China;2.Department of General Surgery,the First Hospital of Nanyang,Henan 473000,China;3.Department of Biochemistry,4.Department of Microbiology and Immunology,Medical College,Jinan University,Guangzhou 510632,China)
Aim:To investigate the inhibitory effects of Silibinin on pancreatic cancer AsPC-1 cells and the possible mechanism.Methods:MTT and cell clone formation inhibitory assay were used to in-vestigate the inhibitory effects of Silibinin on human pancreatic cancer AsPC-1 cells.Cell cycle distribution and cell apoptosis were determined by flow cytometry staining with propidium iodide(PI)or AnnexinⅤ-FITC and PI respectively.The expressions of cell cycle and apoptosis related proteins were analyzed by Western blotting.Results:MTT results showed that Silibinin inhibited pancreatic cancer AsPC-1 cells′proliferation in dose and time-dependent manner(P<0.05).The IC50of Silibinin against pancreatic cancer AsPC-1 cells for 48 hours and 72 hours was 224.20 μmol/L and 87.25 μmol/L,respectively.Cell colony formation inhibition assay showed that the number of cell clones were decreased with the increasing of Silibinin′s concentration.PI staining analysis showed that cell cycle was arrested at G1 phase.Western blotting assay showed that the levels of Cyclins(D1,E2,A,B1)decreased,without changes in cyclin-dependent kinases(CDK4 and CDK6),but cyclin-dependent kinase inhibitors(P15INK4B,P21WAF1/CIP1)increased,which was in consistence with the results of flow cytometric analysis.Annexin VFITC/PI staining analysis also showed a dose-dependent effect on apoptotic cells when the pancreatic cancer cells were incubated with Silibinin for 48 hrs.Caspase-9,Caspase-3 were cleaved,and the cleaved bands of PARP were detected.The expression of JNK and phospho-JNK were found to be increased,while the anti-apoptotic proteins of Bcl-2,Bcl-xL and Mcl-1 were decreased,and pro-apoptotic proteins Bax was not changed.The BH-3 only proteins,Bcl-xs,Bid and Bim,were found to be increased by Western blotting.Conclusion:Silibinin inhibits proliferation of pancreatic cancer AsPC-1 cells,induces G1 phase arrest via upregulating P15INK4Band P21WAF1/CIP1,and induces cell apoptosis through the mitochondrial pathway with activation of JNK.
Silibinin;pancreatic cancer AsPC-1 cells;cell cycle distribution;apoptosis
R329.24,329.25
A
1000-9965(2015)01-0021-08
10.11778/j.jdxb.2015.01.004
2014-06-16
广东省科技计划项目(2011B031800012);广东省医学基金项目(A2013338)
王 莉(1969-),女,主任技师,硕士,研究方向:免疫学,肿瘤分子生物学
蒋建伟(1966-),男,副教授,博士,硕士生导师,Tel:020-85220256;E-mail:jjw703@163.com
