miR-133a对滋养层细胞系HTR8-SVneo的粘附及侵袭功能的影响
2015-12-24刘媛李博陈书强王东孙惠君董杰周晶郭雯娓王晓红
刘媛,李博,陈书强,王东,孙惠君,董杰,周晶,郭雯娓,王晓红
(第四军医大学唐都医院妇产科,西安 710038)
复发性自然流产(RSA)指连续发生3次或者以上自然流产[1]。其发病率占到不孕不育人群的10%~15%[2-3],引起RSA 的病因各异,如染色体异常、内分泌异常、免疫因素感染因素和解剖因素等,但约有50%RSA 原因不明[4],因此治疗效果欠佳,严重影响了广大妇女的生殖健康。微小RNA 分子(microRNA,miRNA)是广泛分布于动植物细胞体内,是一类内源性非编码的小分子RNA。我们课题组前期研究发现,人绒毛组织中miR-133a的高表达与RSA 的发生显著相关[5],但具体的调控机制仍有待进一步证实。本文拟研究miR-133a对HTR8-SVneo细胞黏附和侵袭能力的影响,为临床干预提供理论依据和新的靶点。
材料与方法
一、实验材料
1.细胞系:人类滋养层细胞系HTR8-SVneo由本实验室保存。
2.主要试剂及仪器:miR-133a的mimics、inhibitor、无义序列(上海吉玛),脂质体Lipfectamine 3000(Invitrogen,美国),DMEM/F12(1:1)培养基(Hyclone,美国),胎牛血清(Gibco,美国),Matrigel胶(BD,美国),光学显微镜、酶标仪、荧光定量PCR分析仪(伯乐,美国)。
二、研究方法
1.细胞培养:HTR8-SVneo 细胞培养于含10%胎牛血清的DMEM/F12(1:1)培养基中,细胞置于5%CO2、95%湿度、37 ℃的培养箱中培养。
2.细胞转染及分组:按照Lipfectamine 3000说明书进行转染,转染前1d接种适量HTR8-SVneo细胞于6孔板中,细胞融合度达到50%~70%时转染miR-133a的mimics、inhibitor、无义序列。以无义序列为空白对照。miR-133a的mimics序列为 5’-UUUGGUCCCCUUCAACCAGCUG-3’,miR-133a 的 inhibitor 序 列 为 5 ’-CAGCUGGUUGAAGGGGACCAAA-3’,无义序列 为:5’-U UGUACUACACAAAAGUACUG-3’。转染48h后,收集各组HTR8-SVneo细胞进行以下实验。
3.实时荧光RT-PCR 技术检测各组HTR8-SVneo中miR-133a的表达:转染后48h 后,采用miRNA 提取试剂盒(lifetechnologes,美国)提取各组细胞的总RNA,紫外分光光度仪测定RNA 浓度后,按照RT 试剂(上海吉玛)说明书合成cDNA。miR-133a的引物序列,以U6 为内参,引物序列见表1。引物由上海吉玛公司合成。参照实时荧光RT-PCR 试剂盒(上海吉玛)说明书配制实时定量PCR 反应体系,每个体系为20μl。PCR 反应条件如下:95 ℃,3min;95 ℃12s,60 ℃40s,40个循环。具体操作按说明书进行。以2△△t方法计算目的基因的表达水平,实验重复3次。

表1 PCR 实验引物序列
4.MTT 法检测细胞黏附能力:铺每孔2μg层粘连蛋白(LN)于96 孔板中,室温干燥后,用2%BSA 的磷酸盐缓冲液(PBS)20μl 37 ℃封闭1h,PBS洗3 次,每孔加入5×104个转染后48h 的HTR8-SVneo细胞,5%CO2、95%湿 度、37 ℃培 养箱中培养1.5h后,PBS轻轻洗2次,洗去未黏附细胞,弃去残余PBS,每孔加入20μl MTT(5mg/ml),于细胞培养箱中继续培养4h,弃上清,每孔加入150μl二甲基亚砜(DMSO)溶液,震荡混匀后,于酶标仪上测定550nm 处OD 值,实验重复5次。按下式计算药物对细胞的抑制率(IR):
IR(%)=(1—实验组平均OD 值/对照组平均OD 值)×100%。黏附率=(1-抑制率)×100%。
5.Transwell法测细胞侵袭能力:Transwell小室的上下室之间以孔径为8μm 的聚碳酸酯膜孔分隔开,滤膜上层铺盖人工基底胶(Matrigel,BD,美国)。室温过夜干燥。在小室中加入100 μl 的DMEM 培养液,置于孵箱中孵育2h,使Matrigel水化。用0.25% 胰蛋白酶消化预先转染48h 的HTR8-SVneo细胞,800r/min离心5 min,收集细胞,用PBS洗涤细胞2次,最后用2% DMEM 培养基重悬细胞,调整细胞数为5×105个/ml。吸出小室内的培养基,洗去500μl含10%血清的DMEM于下室中作为趋化因子,加100μl细胞悬液于内室中,5%CO2、95% 湿度、37℃的培养箱中培养24h。取出Transwell小室,吸除培养基,用棉签擦拭净Transwell小室滤膜上层的Matrigel及未穿过滤膜的细胞。将小室侵入4% 的多聚甲醛中固定10min,风干后于苏木素染色液中染色20 min,采用蒸馏水冲洗,实验中每组每次同时做3个重复小室,显微镜下观察计数,取平均值。
三、统计学分析
结 果
一、转染后各组miR-133a表达
运用实时荧光定量PCR 检测各组转染后miR-133a的表达情况,结果发现:转染mimics的上调组miR-133a的表达明显高于对照组(NC),转染inhibitor的下调组miR-133a的表达明显低于对照组,差异有统计学意义(P<0.05)(图1)。
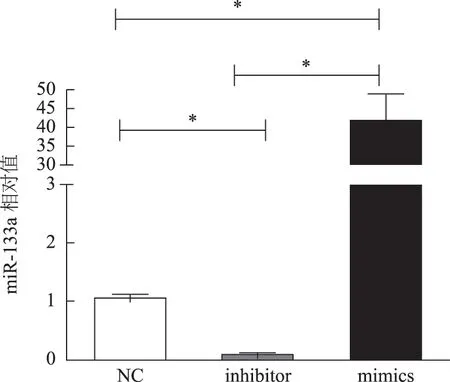
图1 转染后各组miR-133a的表达
二、MTT 法检测转染后各组细胞黏附能力的变化
转染mimics的上调组细胞黏附能力较对照组显著降低(P<0.05),转染inhibitor的下调组细胞的黏附能力较对照组显著升高(P<0.05)(表2)。

表2 miR-133a对滋养细胞黏附能力的影响[(
三、Transwell实验检测转染后各组细胞侵袭力的变化
通过比较各组细胞穿过人基质胶细胞数量的多少,评估各组细胞的侵袭能力,每组取5个高倍镜视野。结果显示:转染mimics的上调组细胞侵袭能力较对照组显著降低(P<0.01),转染inhibitor的下调组细胞的侵袭能力较对照组显著升高(P<0.01)(图2)。

图2 转染后各组细胞侵袭能力的变化。A、B、C分别为NC、inhibitor、mimics各组光学显微镜下观察图像 苏木素染色 ×200;D:各组细胞侵袭能力统计学直方图。
讨 论
妊娠过程中,胎盘绒毛外滋养层细胞在囊胚着床后便开始分化迁移,向子宫脱膜层和基层血管侵袭,启动螺旋动脉的重塑过程[6],这一过程是建立母胎循环的关键。绒毛外滋养层细胞具有的侵袭功能是保证子宫螺旋动脉重塑和妊娠顺利完成的重要基础。滋养层是独特的上皮细胞,滋养层细胞的侵润能力与其粘附能力是紧密关联[7]。miRNAs作为生物体重要的基因调控分子,在不同生理、病理期以及不同的组织细胞类型中,miRNAs的表达丰度不同[8]。miRNAs的异常表达可能与多种疾病的发生相关[9-14]。
前期研究提示:miR-133a在RSA 患者流产绒毛中表达量显著上调。但是其具体的表达调控机制尚不清楚。本研究首先采用脂质体转染降调或者上调滋养层细胞系中miR-133a的表达,并通过实时荧光定量PCR 检测其转染结果,采用MTT 法研究miR-133a对滋养层细胞粘附,同时利用Transwell方法检测miR-133a对滋养层细胞侵袭的影响,结果显示下调miR-133a的表达,能增强HTR8-SVneo细胞的黏附能力,以及侵袭能力。而上调miR-133a的表达,细胞的黏附能力和侵袭能力均降低。体外实验与前期的研究结果分析,说明复发性自然流产患者可能存在某种机制致使滋养层细胞中miR-133a表达量上调,导致细胞粘附及侵袭功能降低,而导致流产。
综上所述,miR-133a在调控滋养层细胞粘附和侵袭方面发挥重要作用,很可能成为复发性自然流产侵袭的新的调节基因,为复发性自然流产临床基因治疗提供新的靶点。
[1] Pandey MK,Rani R,Aqrawal S.An update in recurrent spontaneous abortion[J].Arch Gynecol Obstet,2005,272:95-108.
[2] Fertility and Employment.Danish Data Archives[M].Denmark:Odense University,1979.
[3] Zaima A,Ash A.Fibroid in pregnancy:characteristics,complications,and management[J].Postgrad Med J,2011,87:819-828.
[4] Emmer PM,Nelen WL,Steegers EA,et al.Peripheral natural killer cytotoxicity and CD56(pos)CD16(pos)cells increase during early pregnancy in women with a history of recurrent spontaneous abortion[J].Hum Reprod,2000,15:1163-1169.
[5] Wang X,Li B,Wang J,et al.Evidence that miR-133acauses recurrent spontaneous abortion by reducing HLA-G expression[J/OL] .Reprod Biomed Online,2012,25:415-424.
[6] Reus AD,El-Harbachi H,Rousian M,et a1.Early firsttrimester trophoblast volume in pregnancies that result in live birth or miscarriage[J].Ultrasound Obstet Gynecol,2013,42:577-584.
[7] Nadeem L,Munir S,Fu G,et a1.Nodal signals through activin receptor-like kinase7to inhibit trophoblast migration and invasion:implication in the pathogenesis of preeclampsia[J].Am J Pathol,2011,178:1177-1189.
[8] Bandres E,Agirre X,Ramirez N,et al.MicroRNAs as cancer players:potential clinical and biological effects[J].DNA Cell Biol,2007,26:273-282.
[9] 杨烨,朱晓明,苗霞,等.Mir-18b对滋养细胞HTR-8细胞功能的影响[J].现代生物医学进展,2013,13:2221-2224.
[10] 李立平,吴炜景,赵亚刚.microRNA 与胃癌的研究进展[J].中国肿瘤防治杂志,2013,20:316-320.
[11] Chung AC,Lan HY.MicroRNAs in renal fibrosis[J].Front Physiol,2015,6:50.doi:10.3389/fphys.2015.00050.eCollection 2015.
[13] 万淑琼,张军.miRNA 在HPV 阳性和阴性宫颈癌组织之间的差异研究[J].海南医学院学报,2013,19:101-103.
[14] 冯琼,雷章,卢宏达.miRNA 与肿瘤关系的研究[J].中华临床医师杂志(电子版),2012,6:4390-4393.
