子宫内膜缺血在子宫内膜异位症中的作用及分子机制
2015-12-24王敬华祁建青尤莉芳吴宏宇卢艳阳任琼珍
王敬华,祁建青,尤莉芳,吴宏宇,卢艳阳,任琼珍
(江苏苏州市第七人民医院,苏州 215151)
子宫内膜异位症是导致妇女痛经、不孕甚至癌症的一大原因。研究显示,子宫内膜异位症患者在月经早中期内膜组织处于缺血或者低灌注状态[1],而短暂的缺血缺氧促进血管新生,抑制细胞凋亡,从而导致子宫内膜的异常增生。课题组前期研究显示,缺血缺氧模型组织中血管内皮生长因子的表达增强[2]。由于伦理学原因,目前对子宫内膜异位症的研究尤其是机制的研究采用的是子宫内膜异位症动物模型,该模型种类较多,但是较为符合“经血逆流内膜种植”学说[3]的是“腹腔注射内膜法”,但是目前对于“腹腔注射内膜法”形成的子宫内膜缺血模型在子宫内膜异位症中的作用及其可能分子机制,尚未定论。
材料与方法
一、主要仪器及试剂
仪器:BCM-1000超净工作台(广州雷得生物);溶氧微电极(Unisense,丹麦);DM750 病理显微镜(LEICA,上海);DY89-1 型电动玻璃超速匀浆器(宁波新芝生物);垂直电泳槽、转移电泳槽、电泳仪(BIO-RAD,美 国);ABI7700 Real-time PCR 仪(ABI,美国)。
主要试剂:卡前列素氨丁三醇注射液(欣母沛,辉瑞制药,美国,批准文号H20080251);TUNEL 试剂盒(罗氏,美国,批号ZK-8006);PI3K 抑制剂LY294002(Sigma,美国,批号934987-87-2);Akt以及p-Akt(Ser473)单克隆抗体(Santa Cruz,美国,批号sc-8312、sc-9318);Bcl-2 以 及Bax 单 克 隆 抗 体(Cell Signaling,美国)、Trizol试剂盒(Invitrogen,美国)、RNA 酶抑制剂(Promega,美国)
二、试验方法
1实验动物:选择SPF 级,8~10 周龄雌性C57BL/6小鼠(苏州爱尔麦特科技),体重为20~23g,性周期在3~5周左右。饲养条件:根据性周期一致的原则,将5只老鼠合并为1笼,室温为19~25 ℃,光照明暗时间为12/12h,每隔1~2d换一次垫料,及时补充水分及饲料。
2 实验动物造模:根据参考文献[3]以及课题组前期研究,选择经阴道涂片检测处于动情期小鼠作为供体鼠,肌肉注射0.5 mg/kg欣母沛(缺血预处理,IPC)或者生理盐水0.1ml,qd×3d;注射第4天后采用5%水合氯醛以0.001ml/g进行腹腔麻醉,麻醉后,结扎双侧子宫动脉宫端支及卵巢端(缺血处理,ISCH)或不作任何处理,2h后处死供体小鼠,收集内膜切成1mm×1mm 大小;同时选择经阴道涂片检测处于动情期雌性小鼠作为受体小鼠,将供体小鼠子宫内膜注射到受体鼠腹腔内,每只小鼠体内注射8片内膜。观察移植内膜存活情况及存活率。
3.实验分组:根据供体小鼠处理方式,对应受体小鼠分为5 组:对照组(CON 组)、预缺血处理(IPC)组、缺血处理(ISCH)组、ISCH+IPC 组以及Akt抑制剂(LY294002)预处理的ISCH+IPC 组(ISCH+IPC+LY 组)。
46只供体雌性小鼠,随机分为5 组(10×4+6)。5组供体小鼠预处理完毕,第4天采集各组内膜组织注射到受体小鼠腹腔内,每只注射8片,每组25只受体小鼠。(1)ISCH 组:小鼠不做预缺血处理,第4天做缺血处理(开腹结扎双侧子宫动脉宫端支及卵巢端2h);(2)IPC组:小鼠做预缺血处理,第4天打开腹腔后不作缺血处理;(3)ISCH+IPC 组:小鼠做预缺血处理后,第4天开腹做缺血处理;(4)CON 组:小鼠不做预缺血处理,第4天打开腹腔后不作缺血处理;(5)IPC+ISCH+LY 组:小鼠注射欣 母 沛 前15 min 给 予Akt 抑 制 剂(LY294002)10μmol/kg静脉注射,其余按照ISCH+IPC 组进行处理。
4.受体小鼠腹腔移植内膜观察及测定:造模前,各处理组留取部分供体小鼠内膜组织为造模前对照组织。造模后第7天,采用颈椎脱臼处死受体小鼠,观察并测量受体小鼠腹腔移植内膜大小,结合组织学评分判断病灶是否存活(根据改良的Ishak组织学评分),计算存活率。
5.组织HE染色:受体小鼠腹腔移植内膜组织经4%多聚甲醛固定24h后,行常规石蜡切片,切片组织经二甲苯脱蜡以及不同浓度乙醇脱水后,采用HE染色,在光学显微镜下观察组织形态。
6.TUNEL测定细胞凋亡情况:分别取造模前内膜组织和受体小鼠造模第7天后腹腔移植内膜,采用TUNEL试剂盒检测细胞凋亡情况,严格按照试剂盒说明书执行操作(每组10只)。将所得标本切片在400倍光镜下随机选取5个视野,其中正常细胞呈蓝色、凋亡细胞为棕黄色,计算细胞凋亡指数,即凋亡指数(AI)=凋亡细胞数/总细胞数×100%。
7.RT-PCR 检测Akt、Bcl-2以及Bax表达:采用Trizol法提取造模前内膜及受体小鼠移植内膜组织总RNA,并进行逆转录,PCR 扩增Akt、Bcl-2以及Bax基因,且扩增β-actin作为内参。配置逆转录反 应 体 系:无RNA 酶 双 蒸 水14.75 μl,0.5μl RNase抑制剂,1μl逆转录酶。将100ng总RNA、2μl RT 引物以及5μl Buffer加入到上述反应体系中,43 ℃50min、95 ℃5min进行逆转录反应。取逆转录产物上游及下游引物各1μl、12.5μl 2×Master Mix,补 充 双 蒸 水 至25μl。95 ℃预 变 性5min,95 ℃变性25s、50 ℃退火30s、70 ℃延伸40s,35个循环,72 ℃后延伸5min。RT 引物以及PCR 引物见表1。记录各个反应管中的荧光信号所设立的阈值时循环数(CT 值),将原始数据取3 次以上重复扫描后取平均值。

表1 一氧化氮合酶基因异构体以及β-actin引物序列
8.Western Blot检测Akt、p-Akt以及Bcl-2、Bax表达:取各受体小鼠移植内膜组织100 mg,直接加入200μl细胞裂解液及15μl PMSF 进行匀浆,将匀浆后的液体置于冰上裂解30min,4 ℃下以12 000r/min离心30min,去上清,经考马斯亮蓝法定量。蛋白质样品同1/4倍量5×SDS上样缓冲液混合均匀,热水煮沸7~8min,在10%SDS-PAGE 115V 进行电泳,200mA 恒流2h,湿转至硝酸纤维膜上,再以5%脱脂奶粉TBST 缓冲液室温封闭3h,加 一 抗(即 鼠 抗 人p-Akt、Akt 以 及Bcl-2、Bax)。TBST 洗膜3次,每次10min,然后与结合有辣根过氧化物酶标记的山羊抗小鼠IgG 室温孵育1h,TBS洗膜3 次,每次10 min,与化学发光剂ECL反应,X 线胶片曝光显影。组织中p-Akt、Akt以及Bcl-2、Bax蛋白含量的测定采用的是灰度值扫描,通过与β-actin进行比较得出灰度值比。
三、统计学处理
分别采用SPSS17.0及ImageJ 4.2对数据及图片进行分析处理。正态计量资料用±s表示,组间比较采用t检验;对于计数资料采用卡方检验。以P<0.05为差异有统计学意义。
结 果
一、各组移植内膜形态学观察
造模后第7天肉眼观察,所有组别均可见病灶。通过镜下检查发现,有明显的血管形成(图1)。
IPC组成模率高于其他各组(P<0.05);IPC+ISCH 组成模率以及内膜存活率均高于ISCH 组(P<0.05)(表2)。
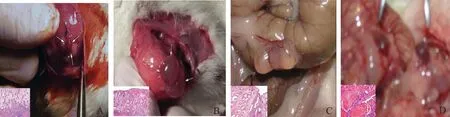
图1 各组移植内膜形态学观察
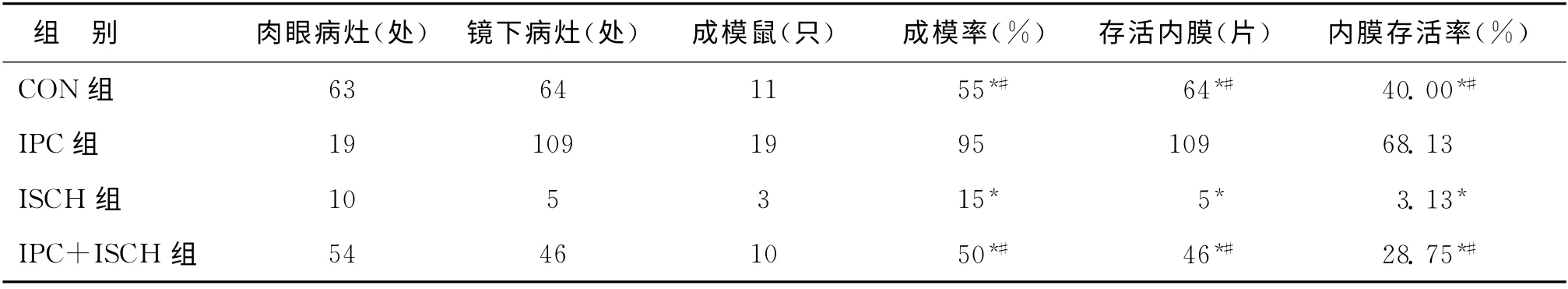
表2 各组造模成功率及内膜存活率
二、各组移植内膜组织细胞凋亡情况
ISCH 组以及IPC+ISCH 组细胞出现萎缩、变圆,细胞边缘破裂,细胞浆内出现沉积,而CON 组、IPC组细胞完整性较好(图2)。
造模后ISCH 组以及IPC+ISCH 组凋亡细胞数量明显增加。其中,CON 组细胞凋亡指数(AI)为(16.21±2.91)%,略 高 于IPC 组 的(14.89±3.75)%,但差异无统计学意义(P=0.979);IPC+ISCH 组AI为(57.64±7.62)%,低于ISCH 组的(83.45±8.11)%,而高于IPC 组,均有统计学差异(P<0.05)。此外,ISCH 组AI高于IPC 组,有统计学差异(P<0.001)(图3)。
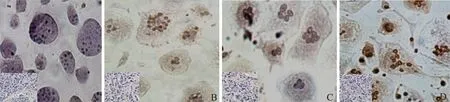
图2 各组移植内膜细胞凋亡情况 TUNEL染色 ×400
三、RT-PCR 检测受体小鼠移植内膜组织中Akt-mRNA、Bcl-2-mRNA 以 及Bax-mRNA 表 达
通 过RT-PCR 检 测 发 现,IPC 组、ISCH 组 以 及IPC+ISCH 组中Akt-mRNA、Bcl-2-mRNA 以及Bax-mRNA 表达均呈不同程度升高,其中IPC 组Akt、Bcl-2以及Bax等mRNA 均高于CON 组且具有 统 计 学 差 异(P <0.05);ISCH 组 以 及IPC+ISCH 组Akt-mRNA、Bcl-2-mRNA 低于IPC 组,而Bax高于IPC 组(P<0.05);IPC+ISCH+LY 组Akt-mRNA、Bcl-2-mRNA 低 于IPC 组 及IPC+ISCH 组,而Bax高于IPC组但低于IPC+ISCH 组(P<0.05);IPC+ISCH 组与ISCH 组之间三种mRNA 表达无统计学差异(P>0.05)(图4)。

图3 TUNEL检测各组移植内膜细胞凋亡指数(%)
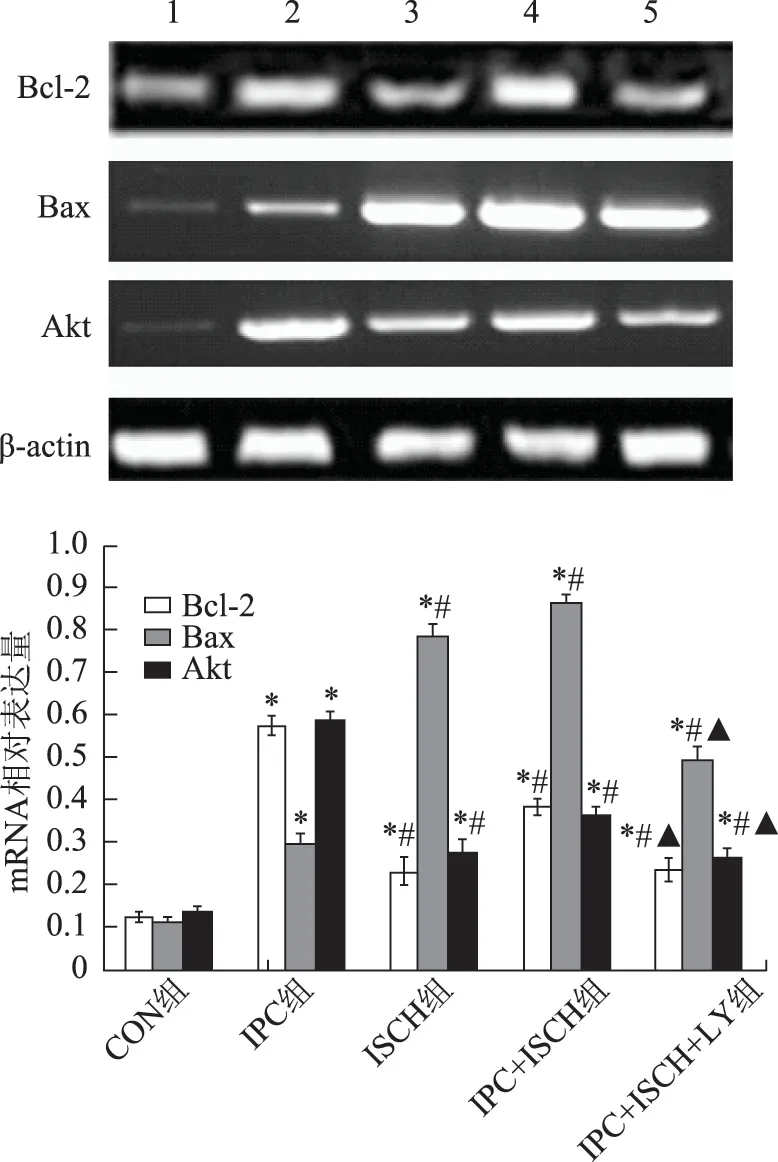
图4 不同组别移植内膜组织Akt-mRNA、Bcl-2-mRNA 以 及Bax-mRNA 表 达
四、Western blot检测移植内膜组织中p-Akt、Akt、Bcl-2以及Bax表达
Western blot检测发现,IPC 组p-Akt、Bcl-2及Bax蛋白表达量均高于CON 组,具有统计学差异(P<0.05);ISCH 组p-Akt、Bcl-2蛋白表达量低于IPC组(P<0.05);IPC+ISCH 组p-Akt、Bcl-2 蛋白表达量高于ISCH 组、而Bax 蛋白表达量低于ISCH 组,具有统计学差异(P<0.05);IPC+ISCH+LY 组p-Akt、Bcl-2蛋白表达量低于IPC+ISCH组(P<0.05),而Bax蛋白表达量高于IPC+ISCH组(P<0.05)(图5)。
讨 论
目前对于子宫内膜异位症存在多种学说,其中以Sampson[3]提出的“经血逆流内膜种植学说”能更好地解释这一临床现象,但是该学说却不能解释“为何90%以上妇女出现经血逆流,却只有15%的女性出现子宫内膜异位症”这一现象[1]。
近年来,有学者认为子宫内膜异位症异位内膜腺体类似于恶性肿瘤细胞,能够产生“粘附、侵袭、血管新生以及抗凋亡”的作用[4]。目前对于“凋亡抵抗”是形成子宫内膜异位症病灶的研究已成为热点。子宫内膜细胞凋亡受卵巢甾体激素调节,增生期雌激素促进内膜细胞增生、抑制细胞凋亡,而分泌期孕激素抑制内膜细胞增生,促进细胞凋亡[5]。子宫内膜异位症受到多种凋亡和抗凋亡蛋白的影响,如TNF-α、IL-8、p53等,此外多条信号转导通路参与其中,Akt信号通路是其中之一[6-8]。研究证实,PI3K/Akt信号通路与血管新生密切相关,也有研究显示该通路与子宫内膜异位症发生发展有着一定的关系,PI3K 蛋白在磷脂酰肌醇依赖的蛋白激酶协同作用下,可与Akt结合,促进其Ser73 位点或者Thr308位点出现磷酸化,从而激活该通路以及下游的靶向因子或蛋白的表达[9-10]。因此,本实验选择了PI3K/Akt信号通路作为研究对象。
课题组前期研究显示,正常预缺血处理(IPC)可以促进血管内皮生长因子的表达[2]。本研究显示缺血预处理能够增强组织对于随后出现的严重缺血缺氧的耐受能力,可能是缺血预处理后刺激血管新生通路,从而达到了抑制细胞凋亡的结果。本研究显示,采用“腹腔注射内膜法”模型成功率尚可,但是缺血处理组(即ISCH 组)造模成功率偏低,其可能原因是实验中结扎子宫动脉宫端支以及卵巢端时,由于缺血导致血供不足,使得供体小鼠体内内膜出现坏死,因此在注射到受体小鼠体内时很难存活。

图5 Western blot检测移植内膜组织中p-Akt、Akt、Bcl-2以及Bax表达
LY294002是PI3K 特异性抑制剂,能够阻断磷脂酰肌醇-3 磷酸(PIP3)生成,进而阻断Akt磷酸化,影响其下游靶向因子或者蛋白的表达。本研究显示,短暂缺血预处理(即IPC)的小鼠异位内膜组织p-Akt表达以及Akt mRNA 表达明显高于其他组别,而缺血处理组(ISCH)出现p-Akt表达以及Akt mRNA 表 达 下 降,低 于IPC 组 以 及ISCH+IPC组,说明IPC处理可能具有促进血管新生、抑制细胞凋亡的作用,这也从TUNEL 的测定结果得到证实。LY+IPC+ISCH 组异位内膜Akt基因以及p-Akt蛋白表达均低于IPC组以及ISCH+IPC组,说明LY29004抑制PI3K 以及Akt蛋白磷酸化,从而抑制血管新生通路,这一结果也支持IPC 处理效果可能是通过PI3K/Akt通路完成。
子宫内膜异位症妇女在月经前期或者早中期出现子宫收缩,而子宫收缩将会导致子宫内膜出现短暂缺血或者处于低灌注状态[11],导致局部组织出现短暂缺血、缺氧,而短暂的缺血、缺氧状态导致机体血管新生,抑制细胞凋亡。正常妇女机体内出现细胞凋亡其目的是排除衰老或者损伤的细胞,保证机体正常的形成代谢,正常子宫内膜细胞凋亡出现周期性变化,而子宫内膜异位症患者由于短暂的缺血、缺氧导致细胞继续存活,从而引起子宫内膜增厚,进一步引起病变[12]。细胞凋亡由相关凋亡基因控制,而Bcl-2、Bax是在线粒体膜上具有调节作用的细胞凋亡重要分子,线粒体在细胞凋亡起着重要角色,外界刺激能够引起线粒体的通透性的改变,引起细胞色素C 等小分子的释放,Bcl-2出现下调而Bax 上调导致细胞凋亡[13-14]。有研究显示子宫内膜异位症患者Bcl-2表达明显高于正常妇女,而Bax与正常妇女相比较无显著性差异[15];另有研究显示,子宫内膜异位症患者在位、异位内膜以及腹腔液巨噬细胞中Bcl-2的表达均明显高于非子宫内膜异位症患者,而Bax却低于非子宫内膜异位症患者[16]。
PI3K/Akt信号通路与促进细胞生存、抑制细胞凋亡有关,其下游信号分子有Bcl-2、Bax等。研究表明,Bcl-2/Bax 比例增高将抑制细胞凋亡,而Bcl-2/Bax比例下降将出现细胞凋亡[17]。本研究显示,IPC 处理组异位内膜Akt、Bcl-2基因及蛋白表达均高于ISCH 组,而Bax基因表达低于ISCH 组;同时,ISCH+IPC 组Bcl-2 基因及蛋白表达高于ISCH 组、Bax基因及蛋白表达低于ISCH 组。说明IPC处理影响到了Bcl-2以及Bax基因及蛋白的表达。此外,LY+IPC+ISCH 组Bcl-2基因及蛋白表达低于ISCH+IPC 组,而Bax 基因及蛋白表达高于ISCH+IPC组。这些结果提示,腹腔注射内膜法形成子宫内膜异位症可能是通过激活Akt磷酸化、进一步导致其下游靶蛋白Bcl-2、Bax的活化,从而抑制细胞凋亡。但是研究却发现,ISCH+IPC 组Bax表达与ISCH 组并无显著性差异,有待进一步解释。
总之,子宫内膜缺血能够抑制子宫内膜细胞凋亡,而这一机制可能与Akt信号通路磷酸化以及激活其下游靶蛋白Bcl-2、Bax的活化有关。
[1] Liu H,Lang JH.Is abnormal eutopic endometrium the cause of endometriosis? The role of eutopic endometrium in pathogenesis of endometriosis[J].Med Sci Monit,2011,17:92-99.
[2] 徐珍珍.缺血/缺氧预处理对子宫内膜异位症鸡胚模型血管生成的影响[D].苏州:苏州大学,2009.
[3] Sampson JA.Peritoneal endometriosis due to menstrual dissemination of endometrial tissue intothe peritoneal cavity[J].Am J Obstet Gynecol,1927,3:93-110.
[4] Chen QH,Zhou WD,Su ZY,et al.Change of proinflammatory cytokines follows certain patterns after induction of endometriosis in a mouse model[J].Fertil Steril,2010,93:1448-1454.
[5] 陈琼华,邱娜璇,颜晓红,等.BALB/c小鼠子宫内膜异位症模型的建立及其形态学的动态观察[J].中国微创外科杂志,2010,10:238-242.
[6] Li J,Xuan W,Yan R,et al.Remote preconditioning provides potent cardioprotection via PI3K/Akt activation and is associated with nuclear accumulation ofβ-catenin[J].Clin Sci,2011,120:451-462.
[7] Ren QZ,Qian ZH,Jia SH,et al.Vascular endothelial growth factor expression up-regulated by endometrial ischemia in secretory phase plays an important role in endometriosis[J].Fertil Steril,2011,95:2687-2689.
[8] Bhardwaj A,Sethi G,Vadhan-raj S,et al.Resveratrol inhibits proliferation,induces apoptosis,and overcomes chemoresistance through down-regulation of STAT 3and nuclear factor-kappaB-regulated antiapoptotic and cell survival gene products in human multiple myeloma cells[J].Blood,2007,109:2293-2302.
[9] Li J,Xuan W,Yan R,et al.Remote preconditioning provides potent cardioprotection via PI3K/Akt activation and is associated with nuclear accumulation ofβ-catenin[J].Clin Sci,2011,120:451-462.
[10] Meijer L,Flajolet M,Greengard P.Pharmacological inhibitors of glycogen synthase kinase 3[J].Trends Pharmacol Sci,2004,25:471-480.
[11] Asante A,Taylor RN.Endometriosis:the role of neuroangiogenesis[J].Annu Rev Phyciol,2011,73:163-182.
[12] Dmowski WP,Ding J,Shen J,et al.Apoptosis in endome-trial glandular and stromal cells in women with and without endometriosis[J].Hum Reprod,2001,16:1802-1808.
[13] Zeng KW,Wang XM,Ko H,et al.Hyperoside protects primary rat cortical neurons from neurotoxicity induced by amyloid p-protein via the PI3K/Akt/Bad/Bcl-XL-regulated mitochondrial apoptotic pathway[J].Euro J Pharmacol,2011,672:45-55.
[14] Kroemer G,Reed JC.Mitochondrial control of cell death[J].Nat Med,2000,6:513-519.
[15] Meresman GF,Bilotas MA,Lombardi E,et al.Effect of GnRH analogues on apoptosis and release of interleukin-Ibeta and vascular endothelial growth factor in endometrial cell cultures from patients with endometriosis[J].Hum Reprod,2003,18:1767-1771.
[16] 王云霞,李亚里,黄靖香.凋亡调节基因bcl-2,bax和fas在子宫内膜异位症中的表达[J].解放军医学杂志,2001,26:69-71.
[17] 周瑞祥,刘昌勤,孙圣刚.钙拮抗剂对大鼠缺血性脑损伤后Bcl-2和Bax基因表达的作用[J].临床神经病学杂志,2004,17:195-197.
