精子空泡对ICSI患者胚胎发育及临床结局的影响
2015-12-24孟祥黔曾泳梅刘思瑶黄军周建明钟影
孟祥黔,曾泳梅,刘思瑶,黄军,周建明,钟影
(四川省成都市锦江区妇幼保健院生殖医学中心,成都 610016)
不孕不育夫妇中约40%因男方因素所致,其中50%不育男性的精子形态异常,男性不育可能与精子形态异常有关。在形态异常的精子中,精子头部异常是精子形态异常的主要类型,约占70%[1-3]。其中,精子空泡头异常比例最高,其次是梨形头和小头异常,双头和大头异常的发生率最低。截至目前,研究人员普遍认为精子空泡与精子活力和男性生育能力息息相关,尤其是精子头部核区域出现的空泡,认为其是男性精子畸形的表现[4]。
自1992年卵胞浆内单精子注射(ICSI)技术诞生以来,传统的ICSI往往在200~400倍镜下挑选所谓的“好精子”注射入卵,随着科学技术的不断发展,一种新的技术诞生了,即活精子细胞器形态学检查(MSOME)[5]。该技术是利用高质量的Nomarshi光学系统实时检查精子动态,通过数字化处理图像,放大倍数可以超过6 000倍,并经电脑显示器放大系统选择形态好的精子。该技术最大的优点就是对活动精子进行实时观察,且对精子无任何损伤性。相比而言,传统ICSI对挑选的精子进行评估时具有一定的局限性,仅仅评估顶体和核[6]。而利用精子放大系统则能更好地观察精子形态,可以清晰地观察到精子头部的细微结构。早期对精子细微结构的研究发现,精子核区域常常出现至少1个空泡[7],只有在高倍镜下才能发现精子顶体到核区域的空泡[8]。关于精子空泡的起源机制目前仍不明确。有研究认为精子空泡是一种正常的自然现象[8];亦有研究表明精子空泡起源于精子顶体,同时暗示精子顶体的存在[9];但其他研究人员对圆头精子进行观察时,在精子头部同样也发现了空泡,从而提示空泡的起源并非顶体。到目前为止,人类对精子头部空泡是否导致男性不育及其潜在的其他作用尚不明确。
本研究利用精子MSOME 放大系统对ICSI患者的精子放大6 000倍后进行观察,并对含有空泡的精子进行拍照,测量空泡直径及其位置,随后将不同类别的精子注射入卵并单独培养,进一步了解精子空泡对胚胎发育、胚胎移植后临床结局的影响。研究结果报告如下。
资料与方法
一、研究对象
选择2014年1~11月在我院接受辅助生殖治疗的患者57例,其中9例为重复周期。所有患者均由同一位医生接诊治疗,均行常规长方案促排卵并常规ICSI助孕治疗。
ICSI指征[10]:(1)严重少、弱、畸精子症;(2)不可逆的梗阻性无精子症;(3)生精功能障碍(遗传缺陷疾病所致者除外);(4)男性免疫性不育;(5)体外受精(IVF)失败;(6)精子顶体异常。
二、研究方法
1.卵母细胞的采集与处理:所有患者均使用常规长方案促排卵:黄体中期予以促性腺激素释放激素激动剂(GnRH-a,达必佳,Ferring,瑞士)0.05mg肌注,14d后予以重组卵泡刺激素(rFSH,果纳芬,Merck Serono,德国)150~300U 对卵巢进行刺激,B超监测卵泡生长发育状况,待卵泡直径大于18mm后,给予重组人绒毛膜促性腺激素(rHCG,艾泽,Merck Serono,德国)250 mg肌注,36h后在B超介导下经阴道穿刺取卵。将获得的卵母细胞于透明质酸酶(Hyaluronidase,80 U/ml,Sage,美国)中消化去除颗粒细胞后,置于含Vitrolife序贯培养液(G-IVF,Vitrolife,瑞典)的培养皿中放置37℃、6%CO2的培养箱(Thermo Scientific Forma 3110,美国)培养备用。
2.精子准备:采用梯度离心法洗涤精液,将洗涤好的精液加入精子缓冲液(Spermrinse,Vitrolife,瑞典)中混匀后置于37℃、6%CO2的培养箱中备用。
3.常规ICSI:将处理后的精液吸取少许加入注射皿中的聚乙烯吡咯烷酮(PVP)里,在200~400倍显微镜下挑选形态较好的精子(挑选要求:精子顶体完整、形态正常;精子头部外部形态完好无损;精子颈部形态正常或颈部液滴较小;精子尾部形态正常且无断缺;尽量挑选前行精子;如果死精子较多时可选微动精子或尾部弯曲的精子),进行制动(精子制动时,制动位点应在精子尾部靠近精子头部的1/3处,注射针下压后横向快速向右拉动注射针,待看到精子尾部明显折痕时,表示制动完成),制动1~2次即可,然后放置PVP标记过的位置,之后把准备好的卵母细胞转入注射皿中的缓冲液滴(G-mops,Vitrolife,瑞典)中,注射时,卵母细胞的极体调整为6点或12点方向进行注射。
4.精子放大系统的使用:在200~400 倍下挑选精子并确定后,注射前利用精子Nomarshi光学系统(OCTAX CytoScreenTM,德国)行MSOME 对精子进行放大观察,同时对头部有空泡的精子进行拍照,测量空泡直径并观察空泡所在位置。整个实时观察过程中对精子不造成任何损伤,观察结束后按照ICSI的常规流程进行注射,注射时按照精子拍照时的顺序一一对应地将精子注射入卵母细胞,随后按照注射顺序进行单独培养,以便观察精子形态对胚胎发育的影响。
5.胚胎培养及质量评估:显微注射后的卵母细胞均置于序贯培养液(卵裂期胚胎用G-1 液,囊胚 用G-2 液,Vitrolife,瑞 典)中,在37℃、6%CO2的培养箱中培养。显微注射16~20h后观察受精情况,出现两原核(2PN)为正常受精。采用本实验室常规评分法对胚胎进行评分,第3 天(D3)胚胎采用WIH 评分法[11],囊胚采用Gardner评 分 法[12]。
6.胚胎移植与妊娠结果判断:选择优质胚胎或囊胚1~2个在B超下进行胚胎移植,移植后4周超声检查显示子宫腔内可见孕囊及胎心搏动者确定为临床妊娠。
三、统计学分析
采用SPSS 19.0软件进行统计学分析,实验结果以百分率(%)表示,采用卡方检验,P<0.05为差异有统计学意义。
结 果
一、精子放大系统下的精子形态
在精子放大系统下对精子行MSOME 观察精子形态,对头部有空泡的精子进行拍照(图1、图2),测量空泡直径并观察空泡所在位置。
二、有无空泡与胚胎发育
观察空泡精子和无空泡精子注射后胚胎发育的情况,发现两组的胚胎冷冻率、妊娠率有显著性差异(P<0.05),其余各实验室指标比较均无显著性差异(P>0.05),无空泡组的正常受精率和胚胎着床率略高于空泡组,妊娠者中无空泡精子者比例较高(表1)。
二、空泡位置与胚胎发育

图1 空泡位于顶体+核位置 ×6 000
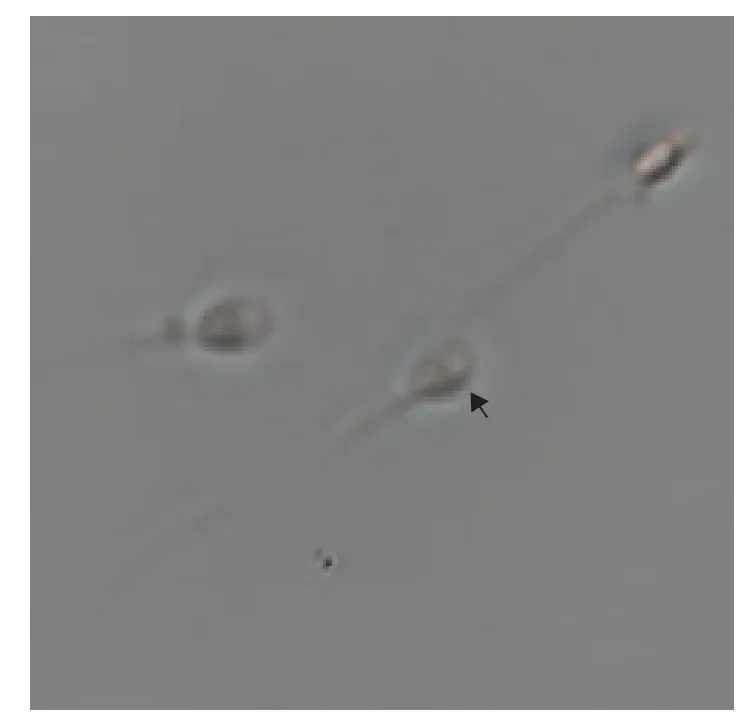
图2 空泡位于精子顶体位置 ×6 000
比较精子头部空泡的位置与胚胎发育的关系。由于两组样本量的原因,因此实验室各指标均无显著性差异(P>0.05)(表2)。
三、空泡直径与胚胎发育
本次研究中所观察到的精子空泡直径均低于2μm。3组不同空泡直径的精子注射入卵后实验室各指标比较均无显著性差异(P>0.05)(表3)。

表1 空泡精子和无空泡精子注射后各实验室指标比较[n(%)]

表2 不同空泡位置对胚胎发育的影响[n(%)]

表3 不同空泡直径对胚胎发育的影响[n(%)]
讨 论
关于精子空泡的起源到目前为止仍不明确,因此精子空泡引起了众多研究者的兴趣[13]。精子空泡是否仅出现在不育男性精子中,或者畸形精子症患者中,或者如少数研究者认为的那样,精子空泡是一种自然现象?为了解决上述的疑问,Watanabe等[14]于2011年对不同男性精液进行分析,结果显示,具有生育能力的男性精液中,95.80%的精子头部含有空泡。其他研究者对不育男性精液的研究发现,在其他指标正常的情况下,精子空泡分别占97.70%[8]和98.40%[15];不育男性精液指标不正常的 情 况 下,空 泡 精 子 分 别 占98.80%[8]和99.40%[14]。最近,研究者对不育2年以上、接受辅助生殖治疗的患者51例和有生育能力者50例的精液进行比较分析,结果发现,精子空泡数量、位置均无显著性差异[16]。在普遍认为男性精子中有空泡出现的基础上,人们开始关注精子空泡大小,围绕“大空泡”(指空泡体积占精子头部>4%)展开了一系列研究,并获得不同结果。较早对ICSI患者的研究表明,“大空泡”在精子中的比例为30% ~40%[11]。Monqaut等[17]研 究 表 明,“大 空 泡”占 不育男性精子比例的61.8%。另外有研究者将“大空泡”定义为空泡占头部体积的50%,在此基础上研究大空泡所占比例,结果分别为(25.2±19.2)%[18]或(30.1±17.8)%[19]。上述研究中,精子空泡大小仅仅是依靠操作者的主观评估。与此同时,研究者对精子空泡进行精确测量得知,有生育能力男性精液中,“大空泡”(指空泡体积占精子头部>13%)精子占(9.2±7.2)%,少弱畸精子症患者中,该类精子占(38±5.1)%[20]。
随着MSOME 技术与ICSI技术的相互结合,胞浆内选择性单精子注射(IMSI)技术就此诞生并逐步取得进展。该技术对精子进行实时观察并放大6 000倍,放大后能观察到传统ICSI时400倍镜下所挑选精子时无法观察到的细微结构,如精子空泡。同时,精子空泡相关研究也表明,精子空泡与受精低下[21]、低 的 线 粒 体 膜 电 位[22]、高 的 染 色 体 异 常[22]、精子DNA 损伤[23]有关。然而,精子空泡与胚胎发育之间的关系仍不明确。本中心借助精子放大系统对精子拍照并运用软件测量精子空泡直径,进一步研究精子空泡对正常受精、D3优胚及可用囊胚的形成以及移植后患者临床结局的影响。本研究结果表明,无空泡组的正常受精率略高于空泡组(74.1%vs.71.4%),但无统计学差异,这可能与空泡组样本较少存在一定的偏倚有关;另外,本次研究中所观察到的精子空泡直径均低于2μm,可能对正常受精结果并不造成显著影响。Greco等[24]对男性精子进行分类,第1类(精子头部形态正常,无空泡或空泡体积<头部的4%)和第2类(精子头部形态正常或头部最多含2个空泡,一个<头部的4%,另一个>头部的4%)为第1组,第3类(头部形态正常伴3个及以上小空泡,空泡体积<头部的4%)和第4类(精子头部形态异常,有大空泡和小空泡)为第2组,两组的受精率(73.7%vs.66.9%)比较,无显著性差异。
精子空泡在注射入卵后对患者胚胎发育的影响也引起研究者们的关注。有研究显示,由于精子的个体形态差异,导致胚胎具有不同的发育潜力,精子头部无空泡或者少于2个小空泡相比其他形态精子而言,囊胚形成率较高[25]。亦有研究认为精子空泡的存在影响囊胚的形成[26]。2014年,Vingris等[27]对72对行辅助生殖治疗夫妇的14 400条精子进行分组分析,研究发现精子空泡数低于2个的精子比例与囊胚形成、胚胎种植率呈正相关,且无空泡的精子流产率较低。
为了能更好地观察精子空泡对胚胎发育的影响,本研究将精子注射入卵后进行了单独培养,观察胚胎发育情况,结果显示虽然各组间比较无显著性差异,但无空泡组的可用囊胚形成率和D3 优胚率均高于空泡组,而进一步将空泡精子进行分组后发现,空泡直径分别为<1μm、1~1.5μm、>1.5~2μm的精子注射入卵后,3组的正常受精率、D3优胚率、可用囊胚形成率均无显著性差异,这一方面可能与本研究所纳入的样本量较少有关,另一方面可能与在低倍镜下挑选精子时,往往对存在清晰可见的大空泡精子放弃使用,因此本研究所纳入的精子空泡直径均较小有关。Watanabe 等[14]在400 倍下,观察不育和有生育能力男性的精子形态发现,空泡>1.5μm 所占比例分别是4.6%和4.2%。有研究显示,精液指标正常和不正常男性精子空泡大小的平 均 值:前 者 空 泡 平 均 大 小 为1.49 μm[8],1.8μm[15];后 者 为1.59μm[8],1.9μm[15]。Setti等[28]对60 对接受ICSI治疗患者的549 枚胚胎进行观察,结果发现,精子大空泡的出现会影响受精卵的卵裂、D3优胚、囊胚的形成以及形成囊胚的滋养层细胞和内细胞团的细胞数,同时还建议大空泡的体积应该低于精子头部的24.5%,当大空泡体积低于19.5%时,所形成的囊胚质量较高。2013 年,Knez等[29]在研究中首次运用精子放大系统和胚胎动态观察系统,发现无空泡精子形成的胚胎卵裂至4细胞和形成囊胚均要早于大空泡精子。
相关研究还显示,精子空泡的存在不会影响卵母细胞的受精和受精卵的早期卵裂,但是D3 胚胎移植后,患者的临床结局和活产率有显著性差异,且IMSI技术的运用能提高临床妊娠率和胚胎种植率[30-31]。本研究结果显示,无空泡组与空泡组D3胚胎移植后的着床率(40.3%vs.22.2%)比较无显著性差异,但临床妊娠率(77.3%vs.22.7%)比较有显著性差异,研究结果与前述研究有所不同,可能与样本量较小、精子空泡直径均较小有关。本研究中无空泡组的临床妊娠患者无一例流产,胚胎质量亦相对好于空泡组,这与之前研究报道精子放大系统能有效提高胚胎质量[32]、增加临床妊娠率[33]、相比传统ICSI周期更能降低流产率[34-35]的结果相似。
综上所述,精子头部空泡直径低于2μm 时,与无空泡精子相比,两者注射入卵后,仅胚胎冷冻率和妊娠率有显著性差异,而胚胎着床率和其余实验室指标均无显著性差异。但样本量较少是本次研究存在的主要问题,后续研究应加大样本量以验证精子空泡对胚胎着床率和临床妊娠率的影响,并做好长期的随访工作以观察妊娠后新生儿的健康状况,为临床应用提供一定参考。
[1] Check ML,Bollendorf A,Check JH,et al.Reevaluation of the clinical importance of evaluating sperm morphology using strict criteria[J].Arch Androl,2002,48:1-3.
[2] Cooper TG,Yeung CH,Fetic S,et al.Cytoplasmic droplets are normal structures of human sperm but are not well preserved by routine procedures for assessing sperm morphology[J].Hum Reprod,2004,19:2283-2288.
[3] 韩树标,韩伟,黄国宁.短时受精结合早期补救ICSI技术的临床应用[J].生殖医学杂志,2014,23:211-213.
[4] Bartoov B,Eltes F,Pansky M,et al.Improved diagnosis of male fertility potential via a combination of quantitative ultramorphology and routine semen analyses[J]. Hum Reprod,1994,9:2069-2075.
[5] Bartoov B,Berkovitz A,Eltes F.Selection of spermatozoa with normal nuclei to improve the pregnancy rate with intracytoplasmic sperm injection[J].N Engl J Med,2001,345:1067-1068.
[6] Baccetti B,Collodel G,Piomboni P.Apoptosis in human ejaculated sperm cells(notulae seminologicae 9)[J].J Submicrosc Cytol Pathol,1996,28:587-596.
[7] Schultz-Larsen J.The morphology of the human sperm;electron microscopic investigations of the ultrastructure[J].Acta Pathol Microbiol Scand Suppl,1958,44(Suppl 128):1-121.
[8] Tanaka A,Nagayoshi M,Tanaka I,et al.Human sperm head vacuoles are physiological structures formed during the sperm development and maturation process[J].Fertil Steril,2012,98:315-320.
[9] Montjean D,Belloc S,Benkhalifa M,et al.Sperm vacuoles are linked to capacitation and acrosomal status[J].Hum Reprod,2012,27:2927-2932.
[10] 中华医学会 编著.临床诊疗指南 辅助生殖技术与精子库分册[M].北京:人民卫生出版社,2009:9.
[11] Berkovitz A,Eltes F,Ellenbogen A,et al.Does the presence of nuclear vacuoles in human sperm selected for ICSI affect pregnancy outcome?[J].Hum Reprod,2006,21:1787-1790.
[12] Jequier AM.Clinical andrology-still a major problem in the treatment of infertility [J]. Hum Reprod,2004,19:1245-1249.
[13] Perdrix A,Rives N.Motile sperm organelle morphology examination(MSOME)and sperm head vacuoles:state of the art in 2013[J].Hum Reprod Update,2013,19:527-541.
[14] Watanabe S,Tanaka A,Fujii S,et al.An investigation of the potential effect of vacuoles in human sperm on DNA damage using a chromosome assay and the TUNEL assay[J].Hum Reprod,2011,26:978-986.
[15] Perdrix A,Saidi R,Menard JF,et al.Relationship between conventional sperm parameters and motile sperm organelle morphology examination(MSOME)[J].Int J Androl,2012,35:491-498.
[16] Gatimel N,Leandri RD,Marino L.Sperm vacuoles cannot help to differentiate fertile men from infertile men with normal sperm parameter values[J].Hum Reprod,2014,29:2359-2367.
[17] Monqaut AL,Zavaleta C,Lopez G,et al.Use of highmagnification microscopy for the assessment of sperm recovered after two different sperm processing methods[J].Fertil Steril,2011,95:277-280.
[18] Oliveira JB,Petersen CG,Massaro FC,et al.Motile sperm organelle morphology examination(MSOME):intervariation study of normal sperm and sperm with large nuclear vacuoles[J].Reprod Biol Endocrinol,2010,8:56.
[19] Franco JG Jr,Mauri AL,Petersen CG,et al.Large nuclear vacuoles are indicative of abnormal chromatin packaging in human spermatozoa[J].Int J Androl,2012,35:46-51.
[20] Perdrix A,Travers A,Chelli MH,et al.Assessment of acrosome and nuclear abnormalities in human spermatozoa with large vacuoles[J].Hum Reprod,2011,26:47-58.
[21] Mundy AJ,Ryder TA,Edmonds DK.A quantitative study of sperm head ultrastructure in subfertile males with excess sperm precursors[J].Fertil Steril,1994,61:751-754.
[22] Garolla A,Fortini D,Menegazzo M,et al.High-power microscopy for selecting spermatozoa for ICSI by physiological status[J/OL].Reprod Biomed Online,2008,17:610-616.
[23] Bartoov B,Berkovitz A,Eltes F,et al.Real-time fine morphology of motile human sperm cells is associated with IVF-ICSI outcome[J].J Androl,2002,23:1-8.
[24] Greco E,Scarselli F,Fabozzi G.Sperm vacuoles negatively affect outcomes in intracytoplasmic morphologically selected sperm injection in terms of pregnancy,implantation,and livebirth rates[J].Fertil Steril,2013,100:379-385.
[25] Knez K,Tomazevic T,Zorn B,et al.Intracytoplasmic morphologically selected sperm injection improves development and quality of preimplantation embryos in teratozoospermia patients[J/OL].Reprod Biomed Online,2012,25:168-179.
[26] Balaban B,Yakin K,Alatas C,et al.Clinical outcome of intracytoplasmic injection of spermatozoa morphologically selected under high magnification:aprospective randomized study[J/OL].Reprod Biomed Online,2011,22:472-476.
[27] Vingris L,Setti AS,De Almeida Ferreira Braga DP,et al.Sperm morphological normality under high magnification predicts laboratory and clinical outcomes in couples undergoing ICSI[J].Hum Fertil(Camb),2015,18:81-86.
[28] Setti AS,Braga DP,Vingris L.Sperm morphological abnormalities visualised at high magnification predict embryonic development,from fertilisation to the blastocyst stage,in couples undergoing ICSI[J].J Assist Reprod Genet,2014,31:1533-1539.
[29] Knez K,Tomazevic T,Vrtacnik-Bokal E.Developmental dynamics of IMSI-derived embryos:a time-lapse prospective study[J/OL].Reprod Biomed Online,2013,27:161-171.
[30] Setti AS,Figueira RD,Braga DP,et al.Intracytoplasmic morphologically selected sperm injection benefits for patients with oligoasthenozoospermia according to the 2010 World Health Organization reference values[J].Fertil Steril,2011,95:2711-2714.
[31] Setti AS,de Almeida Ferreira Braga DP,Vingris L,et al.The prevalence of sperm with large nuclear vacuoles is a prognostic tool in the prediction of ICSI success[J].J Assist Reprod Genet,2014,31:307-312.
[32] Vanderzwalmen P,Hiemer A,Rubner P,et al.Blastocyst development after sperm selection at high magnification is associated with size and number of nuclear vacuoles[J/OL].Reprod Biomed Online,2008,17:617-627.
[33] Hazout A,Dumont-Hassan M,Junca AM,et al.Highmagnification ICSI overcomes paternal effect resistant to conventional ICSI[J/OL].Reprod Biomed Online,2006,12:19-25.
[34] Cassuto NG,Bouret D,Plouchart JM,et al.A new real-time morphology classification for human spermatozoa:a link for fertilization and improved embryo quality[J].Fertil Steril,2009,92:1616-1625.
[35] Wilding M,Coppola G,di Matteo L,et al.Intracytoplasmic injection of morphologically selected spermatozoa(IMSI)improves outcome after assisted reproduction by deselecting physiologically poor quality spermatozoa[J].J Assist Reprod Genet,2011,28:253-262.
