一种建立大鼠动脉硬化模型的方法
2015-12-23张宪陈阳
张 宪 陈 阳
(皖南医学院,安徽 芜湖 241002)
一种建立大鼠动脉硬化模型的方法
张 宪 陈 阳
(皖南医学院,安徽 芜湖 241002)
目的利用大剂量维生素D3注射和高脂喂养结合的方法建立大鼠动脉粥样硬化(AS)模型。方法6周龄雄性SD大鼠腹腔注射维生素D3,高脂饲料喂养大鼠。连续监测大鼠不同时间段的血脂水平、血液生化指标以及其病理变化。结果①AS模型组的TC、TG、HDL、LDL、血钙(Ca2+)显著高于正常对照组。②HE染色,模型组大鼠的主动脉内膜下可见巨噬细胞及钙沉积,内弹力膜断裂,少量斑块沉积,而正常大鼠无病变的产生。结论该方法能够诱导大鼠高脂血症症状的发生,并逐渐在动脉内膜下形成粥样斑块,大鼠动脉硬化模型可成功建立。
动脉粥样硬化;模型;大鼠;病理学
动脉粥样硬化(atherosclerosis,AS)是一种病因复杂的慢性疾病,其以脂质代谢紊乱、血管内皮细胞受损、炎性细胞浸润、斑块破裂和血栓形成为基本特征,为心脑血管疾病重要的病理基础。然而对其病因、发病机制和防治的研究有赖于动物模型。有用兔、小型猪、鼠、猴等动物建立动脉粥样硬化病理模型的报道[1-4]。本实验利用大剂量维生素D3腹腔注射与高脂饲料喂养相结合的方法,建立了操作简便、重复性好的大鼠AS模型,为AS发病机制阐明和心脑血管疾病的预防创造条件。
1 材料与方法
1.1 实验动物:实验SD大鼠由南通大学实验动物中心提供,许可证号为:普通级SCXK(苏)2008-0010,于恒温(24±1) ℃及湿度为(42 ±5)%的条件下,每笼1只,共80笼,24 h自由摄水,两组动物实验在6周龄的SD大鼠上进行,实验前采血测定动物的血脂及血钙水平。
1.2 实验试剂:维生素D3注射液(上海通用药业股份有限公司)、胆固醇干粉(普博欣生物科技有限公司)、胆酸钠(北京化学试剂公司)、猪油和白糖(江苏省协同生物医药有限责任公司)、丙基硫氧嘧啶(北京红惠生物制药股份有限公司)。
1.3 建立动物模型:70只6周龄SD雄性大鼠适应性喂养1周后,随机分为2组(正常组30只和模型组40只):正常组给予普通饲料;模型组的大鼠通过腹腔注射维生素D3注射液(60万U/kg),每隔1天1次,共3次同时给予高脂饲料喂养(4%胆固醇、0.5%胆酸钠、10%猪大油、5%白糖、0.2%丙基硫氧嘧啶,80.3%的基础饲料)。并定期喂以瓜子和杂食,改善其肠胃功能,增强抵抗力。喂食每次10 g,每天2次,自由饮水。
1.4 生化指标测定:适应性喂养1周后,于不同时间段用大鼠尾静脉取血法采血1 mL,采用全自动生化分析仪(日立7600)测定血清总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、血钙(Ca2+)水平。
1.5 病理组织学检查:于高脂喂养后第9周分别在正常组及模型组随机抽取5只大鼠,用1%戊巴比妥钠对大鼠进行麻醉,取完整主动脉(从主动脉根部至髂总动脉分叉处),用10%甲醛固定主动脉,对其进行石蜡包埋连续切片,HE染色,光镜下观察主动脉内膜变化。
2 结 果
2.1 不同阶段大鼠血脂、血钙水平变化:大鼠高脂喂养前1 d、21 d后、42 d后各采一次血,采血前禁食12 h。63 d后处死动物,处死前禁食12 h,颈动脉取血放于离心管中,取血前向离心管中加入枸橼酸钠抗凝,血液经3000 r/min离心10 min,用于生化测定。所测血脂情况见表1。模型组动物血脂(TC、TG、HDL、LDL)及血钙(Ca2+)水平明显升高(P<0.05)。
表1 不同时间段各组血脂及血钙的比较()
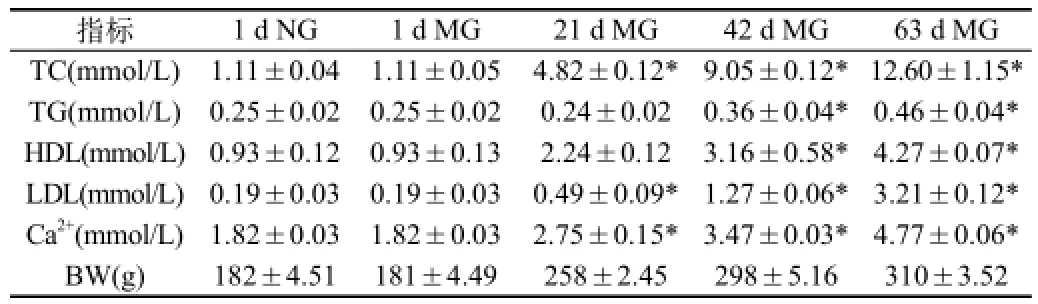
表1 不同时间段各组血脂及血钙的比较()
注:*各时间段模型组与一天模型组比较,P<0.05(NG:正常组;MG:模型组)
指标 1 d NG 1 d MG 21 d MG 42 d MG 63 d MG TC(mmol/L) 1.11±0.04 1.11±0.05 4.82±0.12* 9.05±0.12*12.60±1.15* TG(mmol/L) 0.25±0.02 0.25±0.02 0.24±0.02 0.36±0.04* 0.46±0.04* HDL(mmol/L)0.93±0.12 0.93±0.13 2.24±0.12 3.16±0.58* 4.27±0.07* LDL(mmol/L)0.19±0.03 0.19±0.03 0.49±0.09* 1.27±0.06* 3.21±0.12* Ca2+(mmol/L)1.82±0.03 1.82±0.03 2.75±0.15* 3.47±0.03* 4.77±0.06* BW(g) 182±4.51 181±4.49 258±2.45 298±5.16 310±3.52
2.2 主动脉切片HE染色:大鼠主动脉切片HE染色结果见图1,光学显微镜下模型组主动脉内膜下可见巨噬细胞及钙沉积,内弹力膜断裂,少量斑块沉积,而正常组主动脉内膜光滑,内弹力膜完整,中膜平滑肌细胞排列规整。
3 讨 论
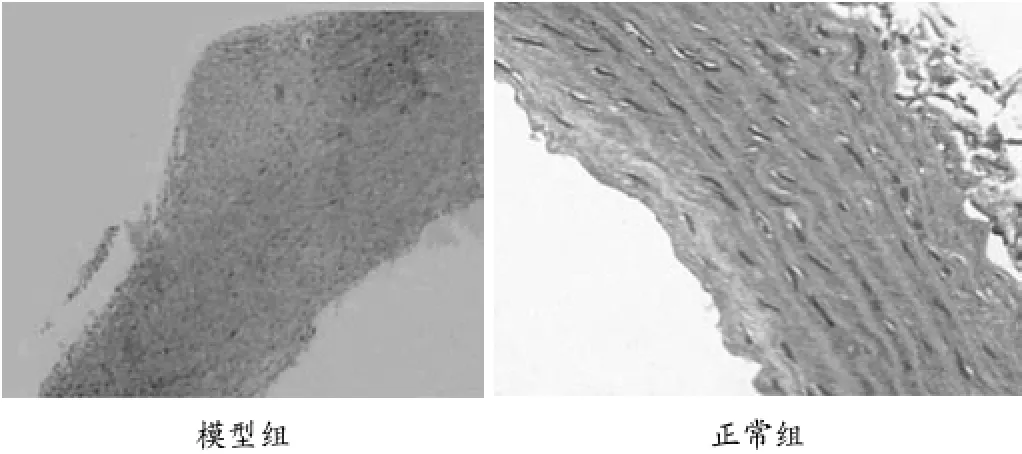
图1 大鼠主动脉HE染色(×400)
动脉粥样硬化与人类心脑血管疾病密切相关,对心脑血管疾病的病因、发病机制以预防的研究离不开动物模型的建立,国内外学者报道有用兔子建立动脉粥样硬化模型,用高脂喂养的方法,8~12周可在兔动脉内见脂质条纹,约45周可形成成熟动脉粥样硬化[5]。Abela GS[6]对新西兰白兔行球囊损伤主动脉加高脂饲养的方法,12周产生严重的动脉粥样硬,后经组胺诱发斑块破裂,成功建成不稳定斑块破裂模型。然而兔是食草动物,其饮食习惯与人类大不相同,其产生的斑块与人类的动脉粥样硬化斑块区别甚大。Schneider J.E等[2]也对猪冠状动脉用球囊损伤的方法成功建立动脉粥样硬化模型。但是猪体积大,用于动脉硬化模型的建造不便于操作,且成本高。大鼠尽管具有一定的抗AS特性,但它用于模型实验动物,饲养方便,成本低,生存能力强,病死率较低。同时,大鼠为杂食类动物,饮食习惯与人类相似,生理解剖亦与人类相似,故较多研究选用大鼠建立动脉硬化模型。
研究发现,AS最显著的特征是动脉壁钙化和动脉壁的脂质沉积。人类AS的沉积物中钙磷的含量可达71%,其含量与AS病变程度呈正相关[7-8]。维生素D3可促进机体对钙磷的吸收,大剂量的维生素D3可使钙离子在动脉内膜下沉积,使动脉发生钙化[9],所以许多研究以大剂量维生素D3,作为诱导剂建立动物模型。本试验遵循该致病机制的大体思路,将大剂量维生素D作为诱导剂对大鼠进行诱导。大量实验与临床资料证明高脂血症是AS形成的主要危险因素[10]。因此本实验采用高脂喂养与大剂量维生素D3腹腔注射结合的方法,在参考前人的基础上对高脂饲料配方及维生素D3剂量作了改变,9周后成功建立动脉粥样硬化模型。总之,用此方法建立动脉粥样硬化模型可操作性强,周期较短,为研究动脉粥样硬化奠定可靠基础。
[1]Abela GS,Picon PD,Fredl SE,et al.Triggering of plaque disruption and arterial thrombosis in an atherosclerotic rabbit model[J].Circulat ion,1995,91(3):776-784.
[2]Schneider JE,Berk BC,Gravanis MB,et al.Probucol decreases neointimal formation in a swine model of coronary artery balloon injury. A possible role for antioxidants in restenosis[J].Circulation, 1993,88(2):628-637.
[3]刘恒方,黄晓松,刘尊敬,等.颈动脉狭窄动物模型制作的研究进展[J].国际神经病学神经外科学杂志,2006,33(1):62-65.
[4]Steven RL,Donald J.Heistad supplementation of atherogenic diet With B vitamins does not prevent atheroselerosis or vascular dysfunction in monkeys[J].Circulation,2001,103(1):1006-1011.
[5]Bryan L.Optimal diets to prevent heart disease[J].JAMA,2003,289(12): 1509.
[6]Watt SM,Contreras MC.Stem cell medicine: umbilical cord blood and its stem cell potential[J].Semin Fetal Neonatal Med,2005,10(3):209-220.
[7]Schmid K,McSharry WO,Pameijer CH,et al.Chemical and physicochemical studies on the mineral deposits of the human atherosclerotic aorta[J].Atherosclerosis,1980,37(2): 199-210.
[8]Fleckenstein-Grun G,Frey M,Luley C,et al.Differentiation between calcium- and cholesterol-dominated types of arteriosclerotic lesions: antiarteriosclerotic aspects of calcium antagonists[J].J Cardiovasc Pharmacol,1991,18(Suppl 6): S1-9.
[9]Price PA,Faus SA,Williamson MK.Warfarin-induced artery calcification is accelerated by growth and vitamin D[J].Arterioscler Thromb Vasc Biol,2000,20(2): 317-327.
[10]Tomkin GH.Hyperglycaemia: the relation to dyslipidaemia and atherosclerosis[J].Ir J Med Sci,2002,171(3):161-164.
Establishment of a Rat Atherosclerosis Model
ZHANG Xian, CHEN Yang
(Wannan Medical College, Wuhu 241002, China)
ObjectiveTo establish a rat atherosclerosis(AS) model by combination of vitamin D3intraperitoneal injection and high-fat feeding.MethodsThe rat model was established by the following procedure: 6 week old male SD rats were fed with high-fat diet with a combination of intraperitoneal injection of vitamin D3at a dosage of 60 U/kg every other day. Continuous monitoring of the level of lipids, blood biochemical parameters and pathological changes in rats at different periods.Results①AS model groups TC, TG, HDL, LDL, Ca2+is significantly higher than the normal control group. ②HE stain, the following pathological changes can be seen in the artery of model group: numerous foam cells, atheronecrotic substances and calcification presentation, internal elastic membrane rupture and plaque deposition. Yet these changes can not be seen in normal group.ConclusionsThis method can induce symptoms of hyperlipidemia in rats, and gradually lead to formation of atherosclerotic plaque in the arteries, thus atherosclerosis model in rats can be successfully established.
Atherosclerosis; Model; Rat; Pathology
R36;R-33
B
1671-8194(2015)03-0004-02
