64排螺旋CT在大肠腺瘤分型及癌变中的诊断价值
2015-12-20潘冬梅PANDongmei
潘冬梅 PAN Dongmei
范国华 FAN Guohua
张 维 ZHANG Wei
李 洋 LI Yang
64排螺旋CT在大肠腺瘤分型及癌变中的诊断价值
潘冬梅 PAN Dongmei
范国华 FAN Guohua
张 维 ZHANG Wei
李 洋 LI Yang
作者单位
苏州大学附属第二医院影像科 江苏苏州215004
目的 分析不同病理类型的大肠腺瘤的CT表现,探讨64排螺旋CT在大肠腺瘤分型及癌变中的诊断价值。资料与方法 回顾性分析经手术病理证实的68例结直肠腺瘤患者的CT表现,包括病变的部位、大小、形态、与邻近结构的关系及增强扫描动脉期、静脉期、延迟期的强化程度,比较不同病理类型及分级的腺瘤增强扫描动脉期、静脉期、延迟期的CT差值(△CT值)。结果 68例中,绒毛状腺瘤16例,绒毛管状腺瘤42例,管状腺瘤10例。绒毛状腺瘤及绒毛管状腺瘤表现为宽基底、绒毛状,动脉期呈脑回状或树叶状强化,表面可见一层低密度黏液覆盖;管状腺瘤表现为窄基底、结节状,均匀强化。绒毛状腺瘤与管状腺瘤各期△CT值差异有统计学意义(t动脉期=2.56,P<0.05;t静脉期=3.22,P<0.05;t延迟期=2.48,P<0.05),绒毛状腺瘤与绒毛管状腺瘤、绒毛管状腺瘤与管状腺瘤各期△CT值差异无统计学意义(P>0.05)。癌变组病灶沿肠壁匍匐性生长、周围有肠系膜血管集群或淋巴结增大。无异型增生组与癌变组各期△CT值差异有统计学意义(t动脉期=2.49,P<0.05;t静脉期=2.69,P<0.05;t延迟期=2.75,P<0.05),无异型增生组与异型增生组、异型增生组与癌变组各期△CT值差异无统计学意义(P>0.05)。动脉期△CT值以50 HU为标准鉴别非癌变与癌变的敏感度、特异度分别为76.92%、70.91%。结论 不同病理类型的大肠腺瘤及其癌变的CT表现具有一定的特征性,病灶的大小、形态、增强△CT值及病灶邻近情况对术前明确诊断及治疗具有重要价值。
肠肿瘤;腺瘤;腺癌;体层摄影术,螺旋计算机;癌前状态;病理学,外科;诊断,鉴别
大肠腺瘤是肿瘤性息肉,属于癌前病变,多发生于直肠及乙状结肠,且多见于60岁以上老年人,男性发病率较高。不同病理类型的腺瘤癌变率及治疗方式不同,因此,术前明确腺瘤的病理类型、是否恶变对治疗方案的选择极其重要。术前CT检查有助于评价病变和确定手术方式、范围,但是目前关于大肠腺瘤CT表现与病理分型及分级之间的研究较少,本研究分析68例不同病理类型的大肠腺瘤及腺瘤癌变的CT征象,为临床诊断及治疗提供依据。
1 资料与方法
1.1 研究对象 收集苏州大学附属第二医院2009年1月—2014年8月行64排螺旋CT增强检查并经手术切除、病理证实的68例结直肠腺瘤患者,其中男42例,女26例;年龄28~80岁,中位年龄65岁;均为单发病灶。临床表现:便血15例,腹泻或黏液便10例,腹痛8例,大便习惯改变5例,因大肠癌就诊8例,其余22例因其他肿瘤或体检发现。
1.2 CT检查 采用GE LightSpeed 64排螺旋CT机。患者均行腹盆部CT检查,检查前8 h禁食,1.5 h前分次口服4%甘露醇水溶液1500 ml作为阴性对比剂充盈胃肠道。扫描参数:120 kV,自动毫安,层厚及层间距5 mm,螺距0.984∶1,球管转速0.5 s/圈。扫描时嘱患者屏气,平扫后立即进行增强扫描,采用Ulrich medical双筒高压注射器经肘静脉团注对比剂,剂量1.5 ml/kg(碘浓度为300 mg/ml),注射速度3~4 ml/s。采用Smart Prep RX技术获取动脉期图像,并分别于注射对比剂后65 s、120 s获取静脉期、延迟期图像。扫描结束后利用原始数据行0.625 mm薄层重建冠状位及矢状位图像,以多方位观察病灶及其与相邻结构的关系。
1.3 图像处理 分别测量病灶平扫及增强扫描静脉期、延迟期的CT值。测量方法:在冠状位重组图像上选取病灶的最大横截面,感兴趣区应尽可能覆盖病灶最大截面,病变较小者放大后进行测量,避开血管影及肿块的边缘,窗宽、窗位分别为200 HU、40 HU。各期CT值由2名影像科主治医师分别测量3次,取平均值。
1.4 影像诊断 CT形态的判断在横断位结合冠状位和矢状位重组图像上联合判读。病灶形态:参照Ishikawa等[1]的分型:①结节状:瘤体较小,直径<3 cm,基底可窄可宽,表面较光整;②菜花状:瘤体多较大,直径>3 cm,基底较宽,表面浅分叶;③绒毛状:瘤体呈多发突起;④匍匐型:表现为沿肠壁长轴走行的不规则管壁增厚,病变表面呈叶状突起,并有融合。
1.5 病理分析 所有标本经3.7%甲醛固定,常规脱水、石蜡包埋及HE染色。
1.6 肿瘤分类及分级标准 结直肠腺瘤在组织学上可分为[2-3]:绒毛状腺瘤(绒毛结构>80%)、管状腺瘤(管状结构>80%),绒毛管状腺瘤(管状和绒毛结构均<80%)和锯齿状腺瘤,本研究中锯齿状腺瘤数量太少,故未纳入研究。异型增生包括轻、中、重度异型增生;癌变指病理组织学见腺瘤内出现癌组织并穿过黏膜肌,达黏膜下层或浸润肌层、浆膜层。
1.7 统计学方法 采用SPSS 20.0软件,采用单因素方差分析对3种不同病理类型及不同级别的大肠腺瘤各期强化△CT值进行比较,两两比较采用LSD法,P<0.05表示差异有统计学意义。
2 结果
2.1 病理结果 68例大肠腺瘤中,绒毛状腺瘤16例,绒毛管状腺瘤42例,管状腺瘤10例;其中癌变13例,合并异型增生27例,无异型增生28例。见表1。

表1 68例大肠腺瘤的病理类型与分级情况[n(%)]
2.2 CT表现 本组68例均表现为凸入肠腔内的软组织密度结节或肿块。病灶部位:大肠腺瘤发生在直肠28例(41.18%),乙状结肠16例(23.53%),横结肠14例(20.59%),升降结肠和(或)盲肠10例(14.71%),CT显示的病灶部位均与手术切除的部位一致。病灶大小:长径最大7 cm,最小0.5 cm;平均直径:绒毛状腺瘤(3.06±1.67)cm,绒毛管状腺瘤(2.70±1.37)cm,管状腺瘤(1.80±1.07)cm。CT形态与病理类型见表2及图1~4。

表2 68例大肠腺瘤的CT形态与病理类型[n(%)]
2.3 不同病理类型的大肠腺瘤的强化特点及CT值比较 本组68例病灶均不同程度强化。绒毛状腺瘤及绒毛管状腺瘤动脉期病灶中心可见强化血管,病灶呈脑回状或树叶状强化(图3),表面可见一层低密度黏液覆盖;管状腺瘤呈均匀强化,未见明显增粗血管(图1)。管状腺瘤、绒毛管状腺瘤、绒毛状腺瘤在动脉期、静脉期及延迟期增强扫描的△CT值依次增加,绒毛状腺瘤与管状腺瘤各期△CT值比较,差异有统计学意义(t动脉期=2.56,P<0.05;t静脉期=3.22,P<0.05;t延迟期=2.48,P<0.05),绒毛状腺瘤与绒毛管状腺瘤、绒毛管状腺瘤与管状腺瘤各期△CT值比较,差异均无统计学(P>0.05),见表3。无异型增生组、异型增生组及癌变组在动脉期、静脉期及延迟期增强扫描的△CT值依次增加。无异型增生组与癌变组各期△CT值比较,差异有统计学意义(t动脉期=2.49,P<0.05;t静脉期=2.69,P<0.05;t延迟期=2.75,P<0.05),无异型增生组与异型增生组、异型增生组与癌变组各期△CT值比较,差异均无统计学意义(P>0.05),见表4。动脉期△CT值以50 HU为标准鉴别非癌变与癌变的敏感度、特异度分别为76.92%、70.91%。

表3 不同病理类型的大肠腺瘤各期强化△CT值比较(HU)
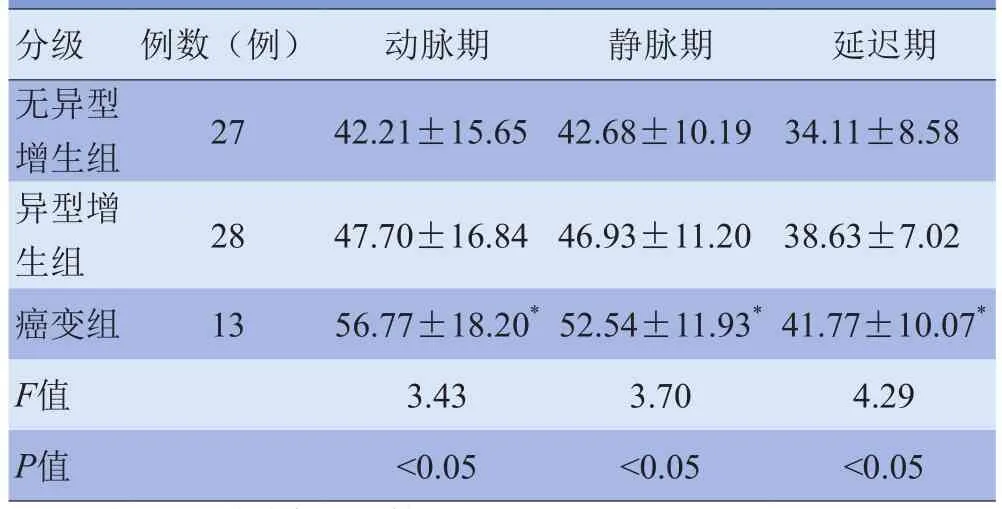
表4 不同分级的大肠腺瘤各期增强扫描的△CT值比较(HU)
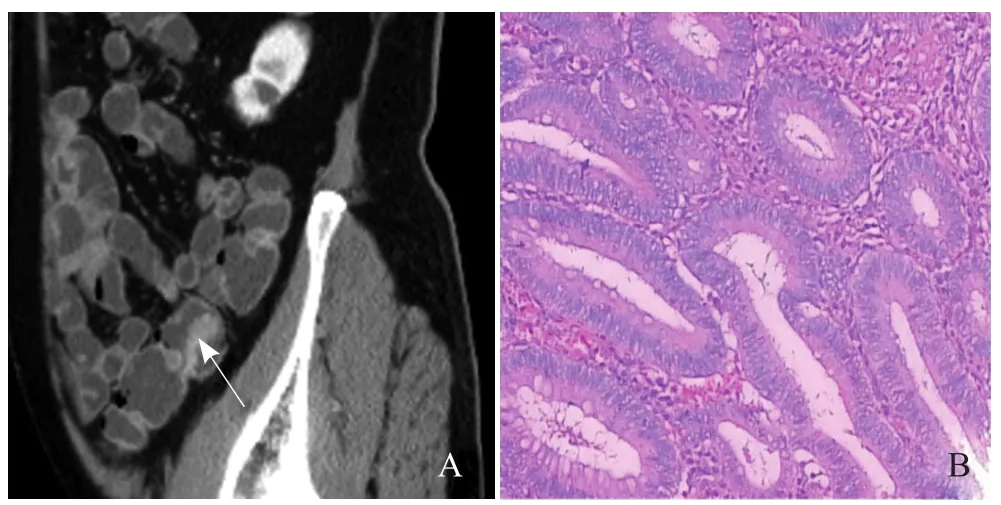
图1 男,70岁,降结肠管状腺瘤。CT增强扫描静脉期矢状位示降结肠腔内结节状软组织灶,与肠壁窄基底相连,均匀强化(箭,A);病理镜下可见小区不典型增生(HE,×40,B)

图2 男,43岁,直肠绒毛管状腺瘤。CT增强扫描动脉期示直肠腔内菜花状软组织灶(箭),与肠壁宽基底相连,病灶中央见增粗强化血管(箭头,A);增强扫描静脉期矢状位示肿块表面呈分叶状,均匀强化(箭,B);病理镜下可见腺体具有绒毛及管状结构(HE,×40,C)

图3 女,65岁,盲肠绒毛状腺瘤。CT平扫示盲肠绒毛状软组织灶(箭,A);增强扫描动脉期呈脑回样强化(箭),表面见一层低密度影(箭头),为腺瘤的黏液成分(B);冠状位示病灶呈树叶状,与肠壁宽基底相连(箭,C);病理镜下可见腺体轻中度异型增生(HE,×40,D)
2.4 大肠腺瘤癌变的CT表现 68例大肠腺瘤癌变情况见表1。13例癌变病灶中,3例表现为肠壁弥漫性增厚,匍匐性生长(图4),表面呈绒毛状突起,部分突起有融合,肠壁浆膜面模糊,周围多发淋巴结;5例表现为绒毛状突起,环绕肠壁1/2以上,最大径均>3 cm,肠系膜血管发出许多分支到病变的周围及内部;3例表现为菜花状、浅分叶,最大径均>3 cm;2例表现为结节状,其中1例有蒂与肠壁相连(图5)。
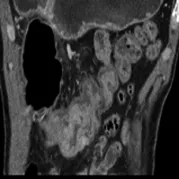
图4 男,54岁,结肠绒毛状腺瘤癌变、侵及间质。结肠肝曲病灶匍匐性生长(箭),表面见多发突起,部分突起融合(箭头),浆膜面模糊
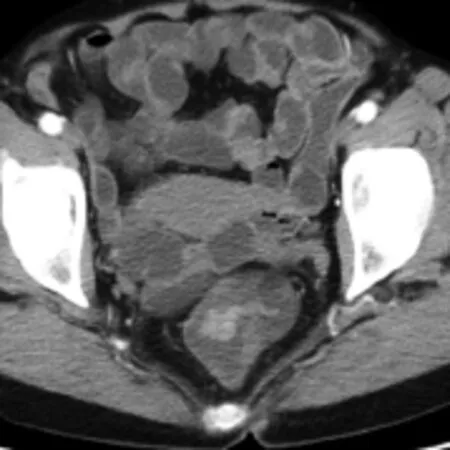
图5 女,64岁,直肠绒毛管状腺瘤,上皮重度异型增生、癌变,限于黏膜及黏膜下层。CT示直肠腔内软组织结节灶,有蒂与肠壁相连(箭),明显强化
3 讨论
3.1 大肠腺瘤的病理及临床 绒毛状腺瘤及绒毛管状腺瘤起源于大肠黏膜表面上皮,附在肠壁上,无蒂,表面呈绒毛和乳头状突起,常伴有黏液覆盖。管状腺瘤起源于肠黏膜隐窝处细胞,多窄基底与肠壁相连,临床多无明显症状。不同病理类型的腺瘤组织成分及生长方式不同,可呈现不同的CT表现,这成为CT鉴别诊断的病理基础。绒毛成分越多,癌变率越高[4],本组绒毛状腺瘤和绒毛管状腺瘤癌变率分别为31.25%、19.05%,均高于管状腺瘤,但是也有报道显示绒毛状腺瘤长至10~15 cm时仍未见恶变的情况[5]。
3.2 大肠腺瘤的CT表现与病理分型的关系
3.2.1 形状及大小 绒毛状腺瘤及绒毛管状腺瘤的绒毛成分较多,故CT表现为形态不规则、表面不光整的肿块,表面呈绒毛状、菜花状或乳头状突起,有不同程度的分叶。管状腺瘤含绒毛成分较少,通常CT显示肿块形态较规则、表面较光整,分叶不明显,呈结节状。绒毛状腺瘤及绒毛管状腺瘤通常较大,本组平均直径均>2.5 cm,而管状腺瘤直径均<2 cm。
3.2.2 病灶基底 绒毛状腺瘤及绒毛管状腺瘤呈附壁生长方式,CT显示病灶多以宽基底与肠壁相连,部分与肠壁分界不清,周围肠壁有时增厚。管状腺瘤CT常显示为窄基底与肠壁相连,与肠壁分界清楚。患者检查前分次口服足量的甘露醇水溶液阴性对比剂使肠道充分扩张,有助于病灶基底及肠壁增厚的显示,此外,增强扫描结合多平面重组图像多方位观察,有助于精确显示病灶基底类型及其与肠壁的关系,以及肠壁增厚程度的判断。
3.2.3 强化特点 本组大肠腺瘤增强扫描后明显强化,管状腺瘤、绒毛管状腺瘤、绒毛状腺瘤各期强化△CT值依次增加,绒毛状腺瘤与管状腺瘤各期△CT值差异有统计学意义(P<0.05),可能与绒毛状腺瘤的绒毛成分较多、增加了其表面积、其相应供血血管增加有关。其中绒毛状腺瘤及绒毛管状腺瘤表面可见无强化的低密度影,代表绒毛间的黏液。绒毛状腺瘤常呈脑回状、树叶状强化,与文献报道一致[6],动脉期病灶中央可见线样强化的血管影[7-8],提示肿瘤血供丰富,而管状腺瘤动脉期均匀强化,病灶中央一般看不到增粗的强化血管。
3.3 大肠腺瘤癌变的CT表现 大肠腺瘤是否癌变决定手术方式的选择,以下CT征象有助于判断大肠腺瘤是否癌变:①腺瘤大小:既往文献报道[9],直径>2 cm的腺瘤癌变率为40%~50%。本组13例癌变中,11例最大径均>3 cm,2例最大径<2 cm。故当腺瘤最大径>3 cm时,癌变率极高(约84.62%)。②腺瘤形状:匍匐型的腺瘤更容易癌变,且伴有黏膜下浸润、淋巴转移及血管侵犯的情况。本组3例匍匐型的腺瘤均发生癌变且侵犯肌层,对于此类型的腺瘤建议行节段性结肠切除加局域淋巴结清扫术[1]。此外,当病灶绒毛状突起较多、较长,突起之间有融合,应警惕恶变可能。③强化特点:本组无异型增生组、异型增生组、癌变组各期强化△CT值依次增加,与文献报道一致[10-11]。本研究癌变组与无异型增生组各期△CT值差异有统计学意义,表明腺瘤癌变时相应的血供明显增加,肿瘤明显强化,主要与对比剂在瘤内微血管的充盈及不成熟的管壁结构有关。Sosna等[12]认为以△CT值为50 HU为参考值,诊断癌变的敏感度和特异度分别为77%、33%,本研究动脉期△CT值以50 HU为标准鉴别非癌变与癌变的敏感度、特异度分别为76.92%、70.91%,特异度明显高于Sosna等[12]的研究报道,可能与CT检查方法和病理类型差异有关。④周围情况:当病灶周围出现不寻常增多、增粗的肠系膜血管分支集群,类似“血管集束征”时,提示腺瘤癌变可能。本组资料5例病灶出现此征,术后病理证实为腺瘤癌变。当腺瘤周围出现淋巴结,尤其是增大淋巴结时应警惕恶变可能。
3.4 本研究的局限性 不同病理类型大肠腺瘤的CT表现及其与病理对照研究的相关文献报道较少,可供参考的文献资料有限;本研究中部分病理类型的病例数较少,有待增加样本量进行深入研究。
总之,CT具有安全、快速、空间分辨率高、不受肠管狭窄程度的限制等优点,虽然CT仿真内镜成像技术对发现结肠隆起性病变具有重要的临床应用价值[13],但特异度和准确性有待进一步提高。本研究让患者分次口服适量的甘露醇水溶液以较好地充盈肠道,并通过冠状位及矢状位重建,可以清晰地显示病变的形态、大小、强化特点以及与邻近结构的关系,在一定程度上能预测大肠腺瘤的病理类型及其是否癌变,有助于评价病变和确定手术方式、范围,尤其是对无法耐受结肠镜检查的患者。
[1] Ishikawa M, Mibu R, Nakamura K, et al. Correlation between macroscopic morphologic features and malignant potential of colorectal sessile adenomas. Dis Colon Rectum, 1996, 39(11): 1275-1281.
[2] 郑杰. 结直肠息肉和结直肠癌. 中华病理学杂志, 2005, 34(1): 4-5.
[3] Ishii T, Notohara K, Umapathy A, et al. Tubular adenomas with minor villous changes show molecular features characteristic of tubulovillous adenomas. Am J Surg Pathol, 2011, 35(2): 212-220.
[4] 胡其泰, 胡凤英, 田旭阳, 等. 结直肠不同异型增生腺瘤与癌的关系. 临床与实验病理学杂志, 2011, 27(7): 702-706.
[5] Cubuk R, Tasali N, Arslan G, et al. A giant villous adenoma: case mimicking rectosigmoid malignancy; radiological survey to diagnosis. Prague Med Rep, 2010, 111(1): 76-81.
[6] 吴正阳, 赵俊功, 赵培荣, 等. 结肠绒毛状肿瘤的CT表现.实用放射学杂志, 2011, 27(10): 1512-1514.
[7] Chung JJ, Kim MJ, Lee JT, et al. Large villous adenoma in rectum mimicking cerebral hemispheres. Am J Roentgenol, 2000, 175(5): 1465-1466.
[8] 刘卫勇, 隋秀芳. 直肠管状-绒毛状腺瘤超声表现一例. 中华医学超声杂志(电子版), 2010, 7(12): 2210-2212.
[9] Summers RM. Polyp size measurement at CT colonography: what do we know and what do we need to know? Radiology, 2010, 255(3): 707-720.
[10] Oto A, Gelebek V, Oguz BS, et al. CT attenuation of colorectal polypoid lesions: evaluation of contrast enhancement in CT colonography. Eur Radiol, 2003, 13(7): 1657-1663.
[11] Summers RM, Huang A, Yao J, et al. Assessment of polyp and mass histopathology by intravenous contrast-enhanced CT colonography. Acad Radiol, 2006, 13(12): 1490-1495.
[12] Sosna J, Morrin MM, Kruskal JB, et al. Colorectal neoplasms: role of intravenous contrast-enhanced CT colonography. Radiology, 2003, 228(1): 152-156.
[13] 王学淳, 解祥军, 徐海滨, 等. 64层CT仿真内镜在结肠隆起性病变及憩室诊断中的临床意义. 中国医学影像学杂志, 2010, 18(5): 454-456.
(本文编辑 冯 婕)
64-slice Spiral CT in Grading of Colorectal Adenoma and Diagnosis of Adenocarcinoma
Purpose To evaluate 64-slice spiral CT in grading of colorectal adenoma and in the diagnosis of adenocarcinoma. Materials and Methods Sixty-eight cases of pathology confirmed colorectal adenoma were retrospectively reviewed to analyze CT performance including the location, size, shape and their relationship with adjacent structures and degree of enhancement in arterial, venous and delayed phase. The difference of CT attenuation value before and after enhancement (△CT value) in arterial, venous and delay phase of different pathological types and different levels of adenomas were compared. Results Among 68 lesions, 16 were villous adenomas, 42 were tubulovillous adenomas and 10 were tubular adenomas. Villous adenomas and tubulovillous adenomas were characterized by wide base, villous-like with gyral or frond pattern enhancement in arterial phase. There was a layer of low density mucus covering the surface. Tubular adenomas were featured as narrow base, nodular in shape with homogeneous enhancement. △CT values in each phase between villous adenomas and tubular adenomas showed statistically significant difference (arterial phase t=2.56, P<0.05; venous phase t=3.22, P<0.05; delayed phase t=2.48, P<0.05), however no significant difference was shown between villous and tubule villous adenomas or between tubulovillous and tubular adenomas. Adenocarcinomas showed creeping-type growth along the intestinal wall with a cluster of vessels adjacent to the tumor or enlarged lymph nodes. △CT values in each phase between non-dysplasia group and carcinoma group showed statistically significant difference (arterial phase t=2.49, P<0.05; venous phase t=2.69, P<0.05; delayed phase t=2.75, P<0.05), however no significant difference was shown between non-dysplasia group and dysplasia group or between dysplasia group and carcinoma group. Using 50 HU of △CT value in artery phase as standard, the sensitivity and specificity for diagnosis of adenocarcinomas were 76.92% and 70.91%, respectively. Conclusion CT findings of different pathological types of colorectal adenomas and adenocarcinomas are characteristic and useful in preoperative diagnosis and treatment planning.
Intestinal neoplasms; Adenoma; Adenocarcinoma; Tomography, spiral computed; Precancerous conditions; Pathology, surgical; Diagnosis, differential
10.3969/j.issn.1005-5185.2015.05.011
范国华
Department of Radiology, the Second Affiliated Hospital of Soochow University, Suzhou 215004, China
Address Correspondence to: FAN Guohua
E-mail: fangh22@sina.com
R735.3+4;R730.42
2014-12-26
修回日期:2015-04-23
中国医学影像学杂志
2015年 第23卷 第5期:364-368
Chinese Journal of Medical Imaging
2015 Volume 23(5): 364-368
