超声血流向量成像分析慢性心力衰竭左心室流体力学变化
2015-12-20GAOYI
高 一 GAO YI
陈 明1 CHEN Ming
张珊珊2 ZHANG Shanshan
董 云1 DONG Yun
陈伟冬3 CHEN Weidong
郑东燕1 ZHENG Dongyan
超声血流向量成像分析慢性心力衰竭左心室流体力学变化
高 一1GAO YI
陈 明1CHEN Ming
张珊珊2ZHANG Shanshan
董 云1DONG Yun
陈伟冬3CHEN Weidong
郑东燕1ZHENG Dongyan
作者单位
1. 同济大学附属东方医院心血管超声科上海 200120
2. 唐山市玉田县医院彩超室 河北唐山064100
3. 大庆龙南医院物理诊断B超室 黑龙江大庆 163453
目的 探讨慢性心力衰竭(CHF)患者左心室内血流自收缩射血向舒张充盈血流逆转的规律。资料与方法 选取25例CHF患者作为CHF组,并选取28例健康人作为对照组。测定射血-充盈血流逆转间期(FRI)、校正射血-充盈血流逆转间期(CFRI)、射血-充盈血流逆转流率(FRR)、左心室射血期峰值流率(FRPE),比较两组左心室流体力学参数的差异。结果 与对照组相比,CHF患者左心室涡流FRI延长[(71±13)ms对(113±30)ms,P<0.05)],FRR减低[(46.85±21.35)cm2/s对(27.90±16.77)cm2/s,P<0.05)],FRPE减低[(74.54±9.10)cm2/s对(41.12±17.25)cm2/s,P<0.05)]。FRI、CFRI与Tei指数呈正相关(r=0.812、0.849,P<0.01),FRI与左心室射血分数(LVEF)、短轴缩短率(FS)、每搏量(SV)、心输出量(CO)、心指数(CI)呈负相关(r=-0.646~-0.515,P<0.05、P<0.01);CFRI与LVEF、FS、SV、CO、CI呈负相关(r=-0.685~-0.456,P<0.05、P<0.01);FRR与Tei指数呈负相关(r=-0.604,P<0.05),与LVEF、FS、SV、CO、CI呈正相关(r=0.503~0.812,P<0.05、P<0.01);FRPE与Tei指数呈负相关(r=-0.734,P<0.01),与LVEF、FS、SV、CO、CI呈正相关(r=0.557~0.776,P<0.05、P<0.01)。结论 超声血流向量成像能够直观地显示并定量分析CHF患者左心室的流体力学变化,左心室内血流方向逆转效率可以作为判断CHF治疗效果的指标之一。
心力衰竭;超声心动描记术,多普勒,彩色;血流向量成像;血流动力学;心室功能,左
慢性心力衰竭(chronic heart failure,CHF)是最常见的疾病之一,其主要是由于心室收缩和(或)舒张功能出现障碍,致使心输出量减少,不能满足人体代谢的需要[1]。尽管目前对于CHF的临床诊断已有较为详细的认识,但对CHF患者心腔内血流的流体力学变化认识不多,尚需要用新型的影像学技术探讨CHF患者心腔内血流的流体力学变化规律。近年研究采用计算机模拟技术、粒子图像测速技术、MRI及超声血流向量成像(vector flow mapping,VFM)技术观察和评价CHF患者心腔内血液流场的特征[2-3],VFM技术能够对心脏的流体力学变化进行可视化定量评价[4-5]。本研究采用VFM技术探讨CHF患者左心室内血流自收缩射血向舒张充盈血流逆转的规律,为心脏流体动力学变化可视化定量分析提供参考。
1 资料与方法
1.1 研究对象 选取2011年3—9月于同济大学附属东方医院就诊的CHF患者,均符合2014年《心力衰竭指南》[4]的诊断标准。纳入标准:根据纽约心脏协会分级标准[6],心功能为II~IV级,左心室射血分数(left ventricular ejection fraction,LVEF)<50%。排除标准:严重瓣膜病、心律失常、急性心力衰竭、先天性心脏病等导致的左心收缩功能减低及图像显示不佳者。最终纳入25例CHF患者,年龄49~80岁;陈旧性心肌梗死14例,扩张型心肌病5例,高血压心脏病4例,尿毒症2例。
选取年龄、性别相匹配的28例健康志愿者作为对照组,年龄56~79岁。所有对照组受试者均经询问病史、体格检查、心电图、实验室检查及超声心动图检查排除心脏疾病。所有患者均签署知情同意书。
CHF组心率、收缩压、舒张压明显高于对照组,差异有统计学意义(P<0.05、P<0.01),两组受试者年龄、性别、体表面积差异无统计学意义(P>0.05)。两组基本资料见表1。

表1 对照组与CHF组基本资料比较
1.2 仪器与方法 所有受试者先行常规二维超声心动图检查,再于心尖左心室三腔观采集动态彩色多普勒血流图,图像导出后由VFM软件DAS-RS1工作站进行脱机分析。
1.2.1 常规超声心动图检查及数据测量 测量左心室舒张末期内径(left ventricular end-diastolic diameter,LVDd)、左心室收缩末期内径(left ventricular endsystolic diameter,LVDs)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end-systolic volume,LVESV),并计算每搏量(stroke volume,SV)、LVEF、短轴缩短率(fractional shortening,FS)、心输出量(cardiac output,CO)和心指数(cardiac index,CI)、心率(heart rate,HR)、体表面积(body surface area,BSA)。根据公式(1)~(5)计算SV、LVEF、FS、CO、CI。

1.2.2 VFM软件分析与射血-充盈血流逆转间期参数测量在涡流模式下根据心电图所显示的心动周期不同时相,分别观察等容收缩期、快速射血期、缓慢射血期、等容舒张期、舒张早期、舒张中期和舒张晚期左心室腔内涡流变化过程。通过VFM涡流图及对应的心电图,在时间-流率曲线上测定射血-充盈血流逆转间期(flow reversal interval,FRI)、校正射血-充盈血流逆转间期(corrected flow reversal interval,CFRI)、射血-充盈血流逆转流率(flow reversal rate,FRR)、左心室射血期峰值流率(flow rate in peak ejection,FRPE)。
1.3 统计学方法 采用SPSS 17.0软件,常规超声测量参数及流体力学参数比较采用t检验,VFM射血-充盈血流逆转期参数与超声心功能指标的相关性采用Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 对照组与CHF组常规超声测量参数比较 与对照组相比,CHF组LVDd、LVDs、LVEDV、LVESV明显增大,SV、CO、CI、LVEF、FS明显降低,等容收缩时间(isovolumetric contraction time,ICT)、等容舒张时间(isovolumic relaxation time,IRT)显著延长,射血时间(ejection time,ET)显著缩短,Tei指数明显增大,组间差异均有统计学意义(P<0.05、P<0.01)。两组常规超声测量参数比较见表2。
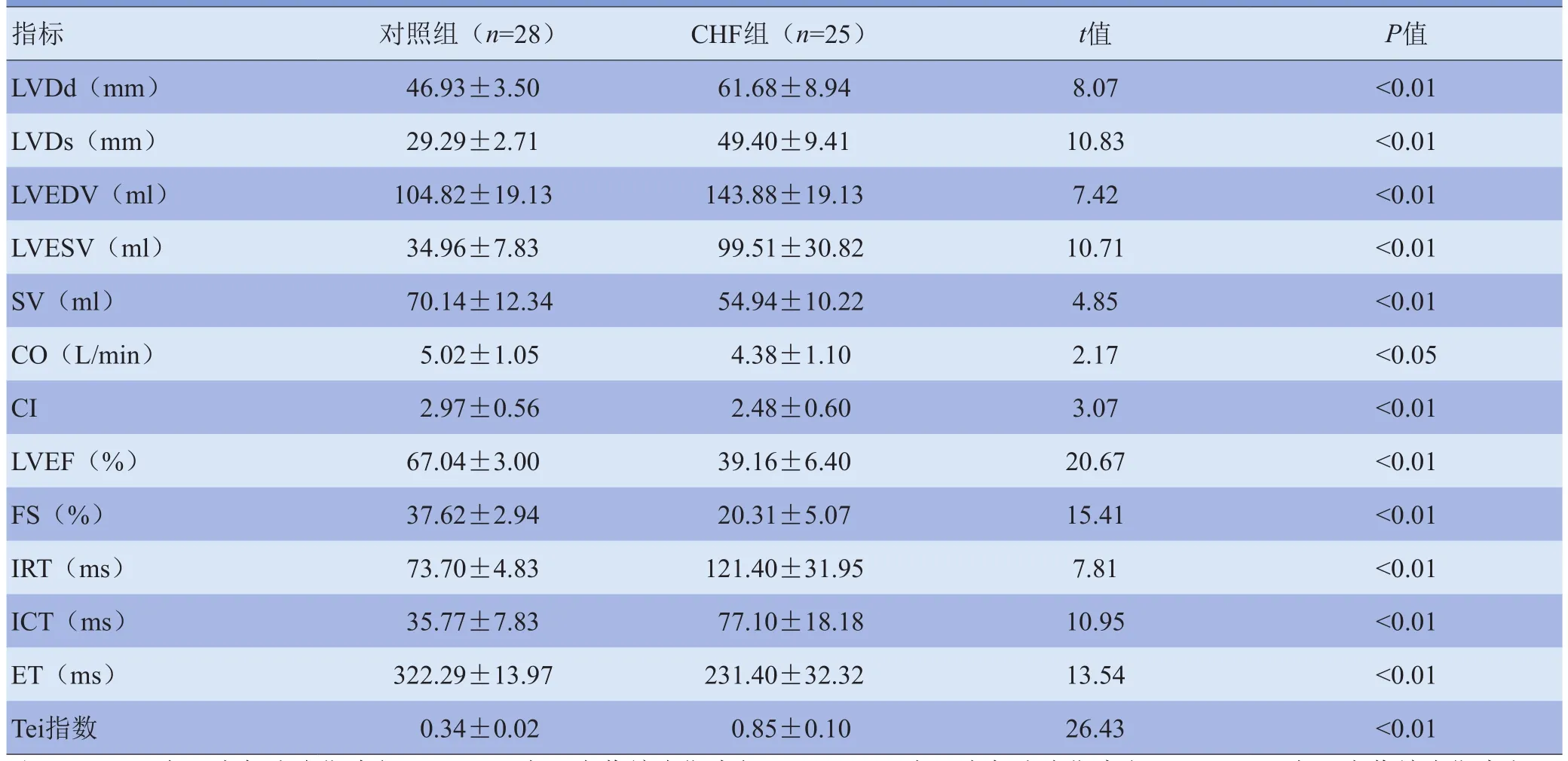
表2 对照组与CHF组常规超声主要测量参数比较
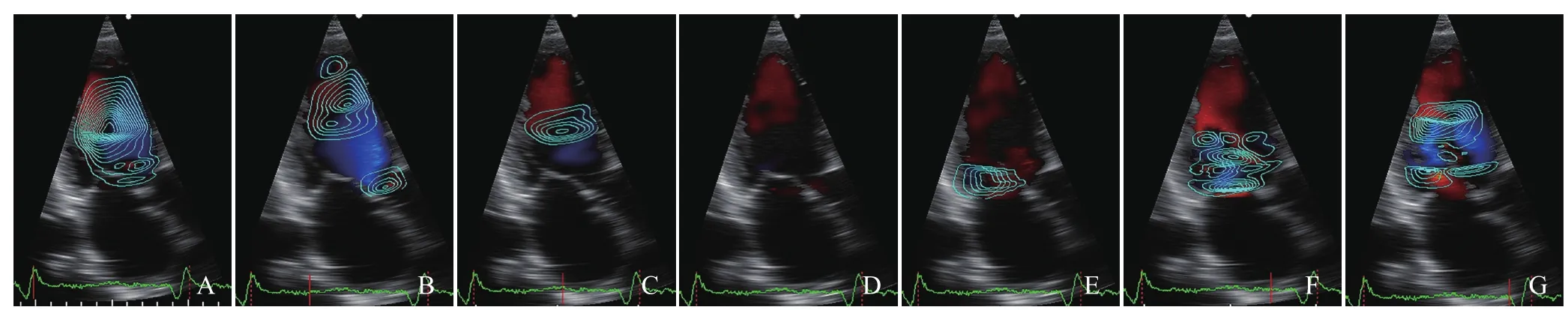
图1 男,62岁,左心室一个心动周期不同时相涡流图。A~G分别为左心室等容收缩期、快速射血期、缓慢射血期、等容舒张期、舒张早期、舒张中期及舒张晚期涡流图像
2.2 左心室涡流在心动周期不同时相的形态特点 CHF患者涡流图像在心动周期各时相的变化受病变程度影响有一定的差异,其大体规律与对照组相比有以下变化:①等容收缩期:涡流图像大多充满整个左心室腔,可为数个从二尖瓣下至左心室腔相连套叠的涡流环,形态不规则,疏密不均匀,1例患者心尖段出现局部小涡流;而对照组等容收缩期涡流大多位于左心室中上部,靠近二尖瓣瓣口,形态较规则,疏密较均匀。②快速射血期:CHF组涡流图像自主动脉瓣口沿左心室流出道至心尖均可见;而对照组中有20例未见明显涡流,2例位于主动脉瓣下靠近流入道一侧可见涡流图像。③缓慢射血期:CHF组主动脉瓣口涡流消失,左心室流出道和心尖部仍可见涡流;对照组22例未见涡流,仅1例主动脉瓣下或左心室流出道近心室壁侧见少量极小涡流。④等容舒张期:CHF组与对照组该时相均未见明显涡流。⑤舒张早期:CHF与对照组均在二尖瓣口产生小涡流图像,但CHF组图像位置及形态显示不稳定。⑥舒张中期:两组于左心室腔可见较大的涡流图像,CHF组涡流图像形态不规则,疏密不均;而对照组疏密较均匀,形态规则,涡流中心位于左心室腔中上部中央。⑦舒张晚期:CHF组为从舒张中期延续至此的较大涡流;而对照组仅二尖瓣下出现小涡流。见图1、2。
2.3 对照组及CHF组流体力学参数比较 与对照组比较,CHF组FRI、CFRI明显延长,FRR、FRPE明显减低,差异有统计学意义(P<0.05)。两组流体力学参数比较见表3。
2.4 VFM射血-充盈血流逆转期参数与超声心功能指标的相关性 将射血-充盈血流逆转期的VFM测量参数FRI、CFRI、FRR、FRPE与LVEDV、LVESV、SV、FS、CO、CI、LVEF、Tei指数进行相关性分析,结果显示FRI、CFRI与Tei指数呈正相关,FRI与LVEF、FS、SV、CO、CI呈负相关;CFRI与LVEF、FS、SV、CO、CI呈负相关,FRR与Tei指数呈负相关,FRR与EF、FS、SV、CO、CI呈正相关,FRPE与Tei指数呈负相关,FRPE与LVEF、FS、SV、CO、CI呈正相关,FRI、CFRI、FRR、FRPE与LVEDV、LVESV无明显相关性。见表4。
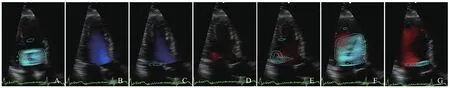
图2 男,62岁,CHF,左心室一个心动周期不同时相涡流图。A~G分别为左心室等容收缩期、快速射血期、缓慢射血期、等容舒张期、舒张早期、舒张中期及舒张晚期涡流图像
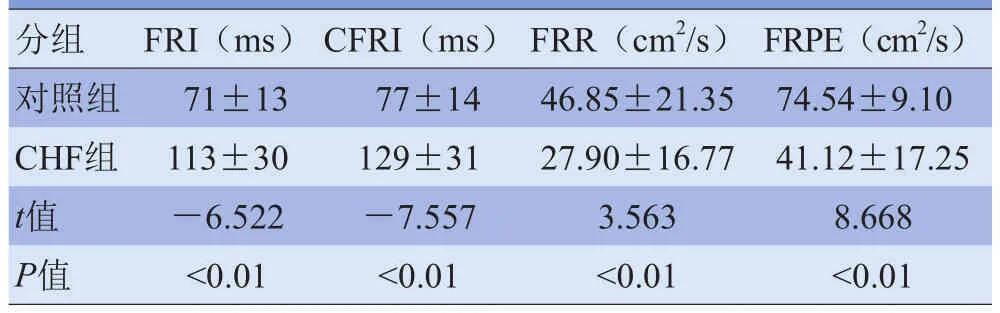
表3 对照组与CHF组流体力学参数比较
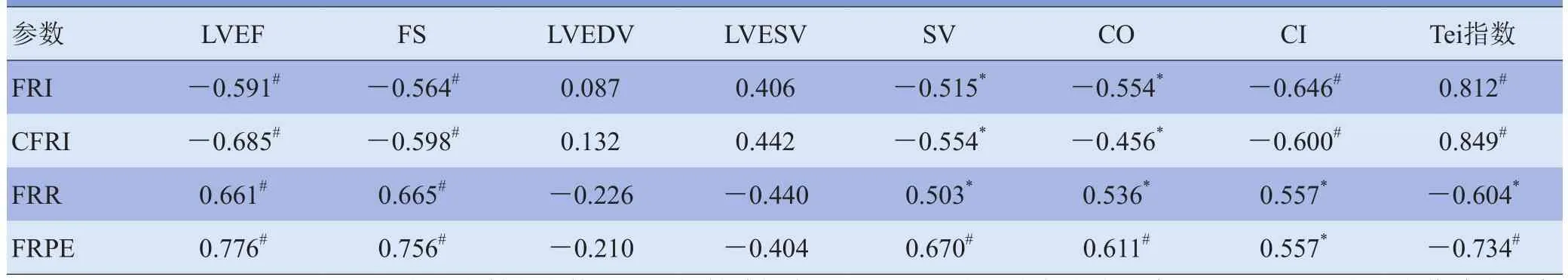
表4 VFM测量参数FRI、CFRI、FRR、FRPE与超声心功能指标的相关性(n=53,r值)
3 讨论
CHF是一种进行性的病变,即使没有新的心肌损害,临床亦处于稳定阶段,仍可自身不断发展[7-8]。目前临床上使用超声心动图评估心力衰竭,但是常规超声心动图主要用于检测心力衰竭时左心室的重构,尚不能检测心力衰竭引起的流体力学变化[9]。本研究应用新型超声血流成像方法VFM技术对CHF患者的流体力学变化进行观察。
本研究结果发现,CHF患者在左心室排空时相内,左心室向主动脉射血峰值流率减低,CHF患者FRPE明显低于正常人;左心室射血终止后至左心室充盈的血流逆转间期延长,二尖瓣开放时仍未见明显涡流存在,直至二尖瓣叶开放幅度进一步加大,才见涡流出现,FRI延长,FRR减低,CHF患者FRI、CFRI较正常人明显延长,而FRR较正常人明显减低,以上结果说明CHF患者心脏的流体力学较正常人发生了很大的变化。FRI延长,FRR减低,使得左心室有效充盈时间相对缩短,充盈效率较低,由于左心室充盈良好是心室高效射血的必备条件,故左心室有效充盈时间缩短将会影响心脏的整体功能。
Li等[10]通过比较左心室腔内收缩期血流结构的变化特点,发现CHF患者收缩早期涡流持续时间增加,左心室流出道至心尖部的速度阶差降低。Chang等[11]研究表明,心脏任何形态和功能的改变均可致左心室腔内血液流体动力学出现较大的变化。VFM技术可以用于定量评估主动脉瓣反流[12],还可以观察急性心肌缺血所致心力衰竭的舒张早期心室内流场变化[13]。动物实验证实,VFM技术能够区分左心室壁各位点起搏与右心室心尖起搏导致的左心室腔内流场异常状态[14]。本研究结果显示,FRI、CFRI、FRR、FRPE与Tei指数、LVEF、FS、SV、CO、CI相关性良好,证实了本超声方法的可靠性。
VFM技术通过单平面血流频移信息三维速度血流成像技术观察心腔内血流流场的动态变化[15]。在心力衰竭发生、发展过程中,由于心室发生重构,心肌运动功能出现异常,在心室腔内的血液运动中,血流动力学受到不同程度的影响,VFM技术以其独特的断层显像功能而具有评价心力衰竭患者心肌运动异常情况下心室腔内血流动力的潜能。然而,VFM技术尚存在一定的局限性,由于该技术通过将彩色多普勒超声图像导入软件中进行评测,选取的是二维切面模拟三维血流动力学,对结果测量有一定的影响。此外,本研究为单中心、小样本研究,且存在一定的主观因素。通过技术的不断完善,VFM有望成为CHF患者诊断、治疗及预后评价的重要指标。
总之,VFM技术能够直观地显示并定量分析CHF患者左心室的流体力学变化,为CHF患者诊断、治疗及预后评价提供了新的参考指标。左心室内血流方向逆转效率可以作为判断心力衰竭治疗效果的指标之一。
[1] 吴学思, 胡大一. 重视对慢性心力衰竭的药物规范治疗. 中华心血管病杂志, 2011, 39(1): 24-25.
[2] 冯敏, 黄晓阳, 苏茂龙, 等. 基于双弹性腔的左心循环系统的建模与仿真. 厦门大学学报(自然科学版), 2012, 51(4): 676-681.
[3] 褚银平, 程金莲, 刘爱军, 等. 脉动流下机械心脏瓣膜瓣阀开启状态的评价. 中国组织工程研究, 2012, 16(40): 7480-7485.
[4] 黄峻. 《2014年中国心力衰竭指南》基本特点和内容要点.中国循环杂志, 2014, 34(z2): 102-105.
[5] 朱美华, 邓又斌, 刘红云, 等. 应用血流向量成像观察扩张型心肌病左心室内涡流特征. 中华超声影像学杂志, 2010, 19(10): 829-832.
[6] 黄峻. 评点欧洲心脏病学学会2012急性和慢性心力衰竭指南. 中华心血管病杂志, 2013, 41(4): 343-345.
[7] 黄峻. 慢性心力衰竭诊断和治疗2012: 现状和进步. 心血管病学进展, 2012, 33(1): 1-5.
[8] Remme WJ, Swedberg K. Guidelines for the diagnosis and treatment of chronic heart failure. Eur Heart J, 2001, 22(17): 1527-1560.
[9] 王银荣, 颜社平, 庄磊, 等. 二维斑点追踪超声心动图评价心力衰竭患者左心房功能. 中国医学影像技术, 2012, 28(10): 1819-1823.
[10] Li C, Zhang J, Li X, et al. Quantification of chronic aortic regurgitation by vector flow mapping: a novel echocardiographic method. Eur J Echocardiogr, 2010, 11(2): 119-124.
[11] Chang H, Wang Y, Wu W, et al. Hydrodynamics-based delivery of an interleukin-1 receptor II fusion gene ameliorates rat autoimmune myocarditis by inhibiting IL-1 and Th17 cell polarization. Int J Mol Med, 2013, 31(4): 833-840.
[12] Ronco C, Kim JC, Garzotto F, et al. Hydrodynamic analysis of the miniaturized hemofilter for a wearable ultrafiltration device. Blood Purif, 2013, 35(1/3): 127-132.
[13] Salazar SA, Borrero JL, Harris DM. On systolic murmurs and cardiovascular physiological maneuvers. Adv Physiol Educ, 2012, 36(4): 251-256.
[14] Kong JC, Cheng KM, Cheung YL, et al. Transarterial embolisation with Guglielmi detachable coils in an infant with a vein of Galen aneurysmal malformation. Hong Kong Med J, 2012, 18(5): 435-438.
[15] 刘蕊, 纳丽莎, 刘丽文, 等. 血流向量成像技术量化观察急性下壁心肌梗死患者舒张期左心室涡流特征. 中国医学影像学杂志, 2012, 20(9): 680-683.
(本文编辑 张春辉)
Changes of Hydromechanics Using Vector Flow Mapping in Patients with Chronic Heart Failure
Purpose To explore the left ventricle flow propagation process in patients with chronic heart failure (CHF) using velocity flow mapping. Materials and Methods Patients with CHF (n=25) were selected as CHF group. Healthy subjects (n=28) were chosen as the control group. Flow reversal interval (FRI), flow reversal rate (FRR), corrected flow reversal rate (CFRI) and flow rate in peak ejection (FRPE) were measured. Parameters related to the vortex in CHF group were compared with that in the control group. Results Compared with the control group, FRI was longer [(71±13) ms vs. (113±30) ms, P<0.05], FRR and FRPE were lower [(46.85±21.35) cm2/s vs. (27.90±16.77) cm2/s; (74.54±9.10) cm2/s vs. (41.12±17.25) cm2/s, P<0.05] in CHF group. FRI and CFRI were positively correlated with the Tei index (r=0.812 and 0.849, P<0.01). FRI was negatively correlated with LVEF, FS, SV, CO, CI (r=-0.646--0.515, P<0.05 or P<0.01). CFRI was negatively correlated with LVEF, FS, SV, CO and CI (r=-0.685--0.456, P<0.05 or P<0.01); FRR was negatively correlated with Tei index (r=-0.604, P<0.05), and was positively correlated with LVEF, FS, SV, CO and CI (r=0.503-0.812, P<0.05 or P<0.01); FRPE was negatively correlated with Tei index (r=-0.734, P<0.01), and were positively correlated with LVEF, FS, SV, CO and CI (r=0.557-0.776, P<0.05 or P<0.01). Conclusion Velocity flow mapping can demonstratecardiac hydromechanics in patients with chronic heart failure. The heart blood flow direction reversal efficiency may be a new method for diagnosis and treatment evaluation.
Heart failure; Echocardiography, Doppler, color; Vector flow mapping; Hemodynamics; Ventricular function, left
10.3969/j.issn.1005-5185.2015.05.002
陈 明
Department of Cardiovascular Ultrasound, East Hospital Affiliated to Tongji University, Shanghai 200120, China
Address Correspondence to: CHEN Ming
E-mail: mingchen1283@vip.163.com
浦东新区科技发展基金创新项目(PKJ2010-Y16)。
R541.6+1;R445.1
2014-11-01
修回日期:2015-03-18
中国医学影像学杂志
2015年 第23卷 第5期:324-328
Chinese Journal of Medical Imaging
2015 Volume 23(5): 324-328
