抗冻融大豆蛋白的制备
2015-12-19孙洪蕊王喜波张英华姜国川江连洲
孙洪蕊 王喜波 张英华 姜国川 江连洲
(东北农业大学食品学院1,哈尔滨 150030)(吉林农业大学食品科学与工程学院2,长春 130118)
抗冻融大豆蛋白的制备
孙洪蕊1王喜波1张英华1姜国川2江连洲1
(东北农业大学食品学院1,哈尔滨 150030)(吉林农业大学食品科学与工程学院2,长春 130118)
采用湿法美拉德反应对大豆蛋白进行糖基化改性,研究了糖基化接枝产物的冻融稳定性。结果表明,湿法糖基化大豆蛋白能有效提高接枝产物的冻融稳定性,在SPI(大豆分离蛋白)浓度40 mg/mL、蛋白与糖质量比1∶3、反应时间4 h、pH 8.0、反应温度95℃条件下的接枝物冻融前后的EAI(乳化活性)分别是未改性蛋白的1.69倍和1.76倍,ESI(乳化稳定性)是未改性蛋白的1.37倍和1.27倍。傅里叶红外光谱分析表明,SPI-D接枝物在1 000 cm-1附近有较强的吸收,在3 700~3 200 cm-1处有一个更宽的振动伸缩吸收,葡聚糖以共价键的形式接入到SPI上。SPI-D接枝物在激发波长为347 nm,发射波长在435 nm处有最大的荧光强度,符合美拉德反应产物的荧光特性,进一步证明SPI与葡聚糖发生了美拉德反应。
大豆分离蛋白 乳化性 冻融 美拉德反应
大豆蛋白是一种全价蛋白质,是为数不多的可以与动物蛋白媲美的植物蛋白,可做为功能性食品配料,提高产品营养价值和加工特性,并促进人体健康[1-2]。蛋白质具有两亲性质,可以吸附在油水界面,在油滴之间提供静电斥力和空间位阻,稳定乳液,所以经常被用做乳化剂[3-5],但是,蛋白质乳液体系容易受外界条件如 pH、离子强度、温度的影响[6-7]而不稳定。有研究表明,蛋白质乳液在冷冻-融化后,由于冰晶的生成导致一系列的物理化学变化的发生,尖锐的冰晶会破坏油水界面膜,使乳液变得很不稳定,产生絮凝、聚结和乳析等失稳现象,甚至使油相和水相完全分离[8]。我国目前还没有专用于冷冻食品中的大豆蛋白,而常态下的大豆蛋白在冷冻条件下无法维持蛋白原有的功能性质,从而影响了冷冻食品的品质。美拉德反应是一种安全有效的蛋白质改性方法,该反应通过蛋白质的ε-氨基和多糖还原末端的羰基发生,无需添加任何化学物质[9]。研究[10-13]证实蛋白质和多糖通过美拉德反应得到的共价接枝物的乳化性显著提高,共价复合物在油水界面可以形成更厚的界面膜,形成了更加稳定的网络,抵抗了乳液在冷冻过程中冰晶对其网络的破坏,提高了乳液对低温的稳定性。乳化性[14]是蛋白质可应用于功能性食品配料中的一项重要功能性质。本试验通过湿法糖基化技术提高大豆分离蛋白冻融前后的乳化特性,制备出适用于冷冻食品体系的高冻融乳化稳定性的大豆蛋白,为实现产业化开发提供技术依据。
1 材料与方法
1.1 材料
大豆分离蛋白:自制;葡聚糖(分子量40 000):国药集团化学试剂有限公司;九三非转基因大豆油:市售;十二烷基磺酸钠(SDS):化学纯;邻苯二甲醛:Sigma公司。
1.2 主要仪器
Nicolet 6 700 FT-IR傅里叶变换红外光谱仪:美国Thermo Fisher Scientific公司;F-4500荧光分光光度计:日本日立公司。
1.3 试验方法
1.3.1 糖基化蛋白的制备工艺
将一定浓度的大豆分离蛋白与葡聚糖在缓冲溶液中充分溶解,待大分子充分水化后,将溶液置于一定温度的水浴锅中反应,然后冰浴停止反应。将反应后的溶液在10 000 r/min条件下离心15 min,上清液冷冻干燥即为糖基化蛋白。
1.3.2 乳化活性和乳化稳定性测定[15]
将蛋白溶解在pH 7.0的磷酸盐缓冲溶液中,取蛋白溶液9 mL与3 mL大豆油充分混合,10 000 r/min均质1 min。均质后形成乳浊液,0 min和10 min时分别在乳液底部取50μL与5 mL 0.1%的SDS充分混合,然后在500 nm处测吸光值。ESI用式(1)表示。

式中:A0为0 min时测得的吸光值,即为乳化活性(EAI);A10为10 min时测得的吸光值;ESI为乳化稳定性。试验以0.1%的SDS溶液做空白。
1.3.3 冻融循环
根据 O'Regan等[16-17]的试验方法,并略作改进。将蛋白溶液置于-18℃的条件下冷冻保存24 h,然后于40℃的水浴锅中解冻1.5 h。
1.3.4 接枝度(DG)的测定
参考 Sorgentini D A[18]的方法。OPA试剂:称取80 mg OPA溶于2 mL甲醇中,分别加入5 mL 20%SDS,50 mL 0.1 mol/L硼砂,200μLβ-巯基乙醇,用去离子水定容至100 mL,OPA试剂现配现用。测定时,取4 mL OPA试剂与200μL样品混合,于35℃反应2 min,340 nm测吸光度,产物的接枝度为反应体系中反应前后游离氨基含量的变化率。
1.3.5 褐变指数的测定
参照文献[19],稍作改动。将糖基化蛋白样品制备成2 mg/mL的样品溶液,以去离子水做空白,测定其在420 nm下的吸光值A420nm,表示褐变程度。
1.3.6 SPI-D接枝物的傅里叶红外光谱分析
取一定量的SPI和SPI-D接枝物,加入一定量的KBr,研磨成粉末,压成薄片,然后用傅里叶变换红外光谱仪作全波段(4 000~400 cm-1)扫描。
1.3.7 SPI-D接枝物的荧光光谱分析
将SPI、SPI-D混合物和 SPI-D接枝物溶解在硼酸缓冲溶液中(0.2 mol/L,pH 8.5),蛋白浓度为1 mg/mL,使用荧光分光光度计在激发波长为347 nm处进行发射波长的扫描。
1.4 数据分析
数据统计分析采用Microsoft Excel 2010,所有试验重复3次。
2 结果与讨论
2.1 反应时间对糖基化蛋白冻融前后乳化性的影响
在SPI与葡聚糖质量比1∶3,pH 7,蛋白质量浓度50 mg/mL,反应温度95℃条件下,研究不同反应时间对接枝产物冻融特性的影响,结果如图1、图2所示。
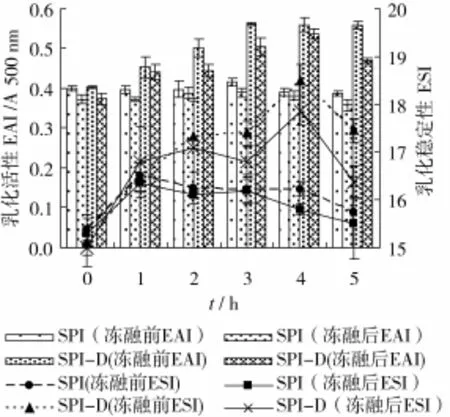
图1 反应时间对糖基化蛋白冻融前后乳化性的影响

图2 反应时间对SPI-葡聚糖接枝反应的影响
从图1中可以看出随着加热时间的增长,接枝产物冻融前后的乳化活性和乳化稳定性先升高后下降,反应时间4 h时,接枝产物的冻融稳定性最高,原因可能是随着加热时间的增长,蛋白质结构部分展开,糖链逐渐引入大豆分离蛋白中,增加了蛋白质的表面活性,糖链在蛋白吸附膜周围形成立体网络,增加了膜的厚度,增强了复合物对外界环境的抵抗能力[20],使接枝物冻融前后的乳化活性和乳化稳定性提高。而加热时间过长,导致蛋白质中引入过多的亲水集团,使接枝物过度亲水而失去界面活性,使复合物的乳化活性和乳化稳定性降低[21]。从图2中可以看出,随着加热时间的增长,聚合物的颜色加深,影响产品的应用。SPI和葡聚糖混合物的乳化性与未经改性的蛋白质基本保持不变,所以单纯的加入葡聚糖对蛋白质冻融前后的乳化性没有影响,这与郭兴凤等[22]得到的结果相同。
2.2 SPI质量浓度对糖基化蛋白冻融前后乳化性的影响
在SPI与葡聚糖质量比1∶3,pH 7,反应温度95℃,反应时间4 h条件下,研究不同SPI质量浓度对接枝产物冻融特性的影响,结果如图3、图4所示。
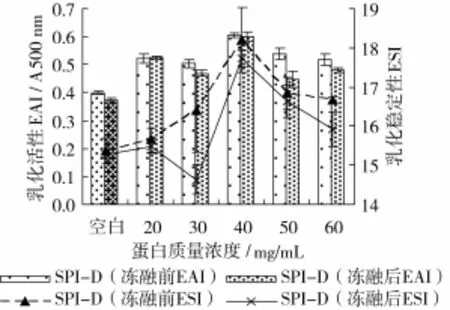
图3 SPI质量浓度对糖基化蛋白冻融前后乳化性的影响

图4 SPI质量浓度对褐变指数的影响
从图3中可以看出,随着蛋白质量浓度的增加,复合物冻融前后的乳化活性和乳化稳定性均先升高后降低。在一定的温度、pH值、蛋白与糖配比、反应时间的条件下,蛋白质浓度的增加,会增加其与糖的碰撞机会,进而促进接枝反应的进行,使复合物冻融前后的乳化性提高。但是蛋白质量浓度越高,空间位阻越大,不利于接枝反应的进行。从图4中可以看出,蛋白质量浓度为40 mg/mL时,产物的褐变指数较低,颜色较浅。因此选取SPI最适质量浓度为40 mg/mL。
2.3 SPI与葡聚糖的质量比对糖基化蛋白冻融前后乳化性的影响
在 SPI质量浓度 40 mg/mL,pH 7,反应温度95℃,反应时间4 h条件下,研究不同SPI与葡聚糖质量比对接枝产物冻融特性的影响,结果如图5、图6所示。

图5 SPI与葡聚糖的质量比对糖基化蛋白冻融前后乳化性的影响

图6 SPI与葡聚糖的质量比对褐变指数的影响
蛋白质和葡聚糖的接枝反应是特定基团的交联反应,适当的比例既可以加速反应的进行,又能减少副反应的发生。如图5所示,复合物冻融前后的乳化活性和乳化稳定性在一定范围内随着葡聚糖含量的增加而升高,糖浓度的增加,提高了大豆分离蛋白与葡聚糖的碰撞几率,促进了接枝反应的发生,所以提高了复合物冻融前后的乳化稳定性。同时反应引入了糖链,使接枝产物的极性增加,溶解性提高,分子柔性增大,所以复合物的乳化活性升高。但是糖添加量过多,使溶液黏度增大,分子的流动性差,不利于接枝反应的进行。过量的糖链引入大豆分离蛋白会使蛋白质过于亲水,失去界面活性,不利于油水平衡,导致复合物冻融前后的乳化特性降低。从图6中可以看出,过多的糖会导致接枝产物褐变指数显著提高,影响产品应用品质,因此,选SPI与葡聚糖的最适质量比为1∶3。
2.4 pH值对糖基化蛋白冻融前后乳化性的影响
在SPI与葡聚糖的质量比1∶3,反应温度95℃,SPI质量浓度为40 mg/mL,反应时间4 h条件下,研究不同pH值对接枝产物冻融特性的影响,结果如图7、图8所示。
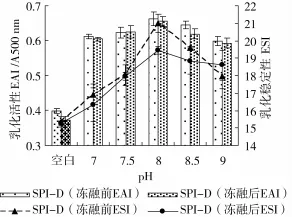
图7 pH对糖基化蛋白冻融前后乳化性的影响

图8 pH对褐变指数的影响
美拉德反应的本质是碱催化反应,碱性条件有利于接枝反应的进行,随着pH的增加(图7),接枝产物冻融前后的乳化性均先增加后减小。碱性条件下,-COO+含量增加,提高了微粒之间的静电斥力,使双电层厚度增加,溶液中界面膜的厚度也增加,接枝产物对极端环境有了更强的抵抗力,冻融后仍保持较好的乳化特性。但是,pH过高,可能会发生“胱赖反应”,影响接枝反应的进行[23],故选择pH 8为宜。
2.5 反应温度对糖基化蛋白乳化性的影响
在SPI与葡聚糖的质量比1∶3,pH 8,SPI质量浓度40 mg/mL,反应时间4 h条件下,研究不同反应温度对接枝产物冻融特性的影响,结果如图9、图10所示。
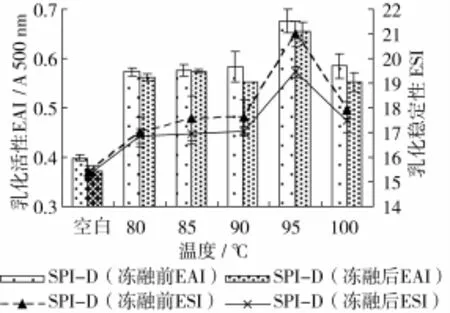
图9 反应温度对糖基化蛋白冻融前后乳化性的影响

图10 反应温度对糖基化蛋白褐变指数的影响
接枝产物冻融前后的乳化活性和乳化稳定性随着温度的升高而增加(图9),温度为95℃时达到最大值。研究显示温度低于90℃时美拉德反应速度很慢,而温度高于90℃时反应速率显著提高[24]。一定的反应温度,会使SPI致密的球状结构变疏松,释放出更多的接触位点与葡聚糖发生反应,但是温度过高会使蛋白过度变性,失去界面活性,进而导致复合物乳化性的降低。从图10中可以看出,温度越高,褐变指数越大,复合物的颜色越深,不利于其在食品中应用,陆钫[25]等也得出相似的趋势,本试验选择反应温度95℃。
2.6 验证试验
在上述试验条件下(SPI浓度40 mg/mL、蛋白与糖质量比1∶3、反应时间4 h、pH 8.0、反应温度95℃),进行验证性试验,结果如表1所示。
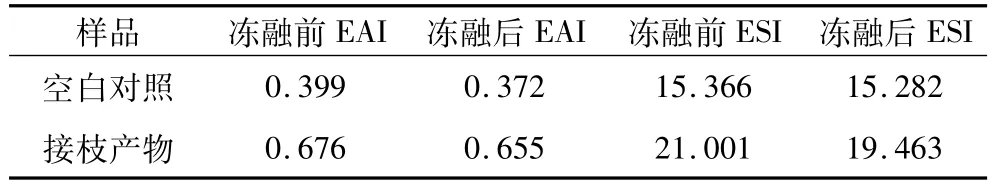
表1 接枝产物的冻融特性
湿法糖基化技术可有效提高接枝产物的冻融特性,由表1可见,接枝产物的EAI在冻融前后分别比空白样品提高了1.69倍和1.76倍,ESI在冻融前后分别比空白样品提高了1.37倍和1.27倍,表明湿法糖基化技术提高大豆蛋白冻融特性具有现实可行性。
2.7 傅里叶红外光谱分析
SPI和葡聚糖发生糖基化反应的特征为羟基的引入,在红外光谱上体现为在3 700~3 200 cm-1附近相较于SPI有较宽的吸收峰和在1 260~1 000 cm-1附近有更强的吸收[26]。
SPI和SPI-D接枝物的红外光谱图如图11所示。SPI-D接枝物在1 000 cm-1附近有较强的吸收,在3 700~3 200 cm-1处有一个更宽的振动伸缩吸收,由此可以证明SPI以共价结合的方式引入葡聚糖,SPI和葡聚糖发生了美拉德反应。

图11 大豆分离蛋白(SPI)和大豆分离蛋白-葡聚糖接枝物(SPI-D)的红外光谱图
2.8 荧光光谱分析
研究表明[27-28],荧光物质是美拉德反应的中间产物,所以测定反应体系的荧光性可用于鉴定美拉德反应的发生。荧光物质的典型荧光光谱的特征为激发波长340~370 nm,发射波长在420~440 nm。
SPI-D接枝物的荧光光谱图如图12所示,SPI-D接枝物在激发波长为347 nm,发射波长在435 nm处有最大的荧光强度,而SPI在发射波长为450 nm处荧光强度最大,符合美拉德反应产物的荧光特性,说明SPI和葡聚糖发生了美拉德反应。

图12 大豆分离蛋白(SPI)和大豆分离蛋白-葡聚糖接枝物(SPI-D)的荧光光谱图
3 结论
湿法糖基化技术能够有效提高接枝产物的冻融特性,接枝产物经冻融处理前后的EAI分别是未改性样品的1.69倍和1.76倍,ESI是未改性样品的1.37倍和1.27倍。因此,湿法糖基化技术用于制备高冻融稳定性大豆蛋白具有现实可行性。
傅里叶红外光谱和荧光光谱分析证明SPI和葡聚糖发生了美拉德反应,产物冻融前后乳化性能的提高是由于糖基化反应的发生。
[1]Comas D I,Wagner JR,Tomas M C.Creaming stability of oil in water(O/W)emulsions:influence of pH on soybean protein-lecithin interaction[J].Food Hydrocolloids,2006,20(7):990-996
[2]王喜波,迟玉杰.大豆蛋白超声磷酸化加工工艺的Box-Behnken模型优化[J].农业机械学报,2011,42(11):130-134
[3]Puppo M C,Beaumal V,Chapleau N,et al.Physicochemical and rheological properties of soybean protein emulsions processed with a combined temperature/high-pressure treatment[J].Food Hydrocolloids,2008,22(6):1079-1089
[4]Dickinson E.Adsorbed protein layers at fluid interfaces:interactions,structure and surface rheology[J].Colloids and Surfaces B:Biointerfaces,1999,15(2):161-176
[5]Diftis N G,Biliaderis C G,Kiosseoglou V D.Rheological properties and stability of model salad dressing emulsions prepared with a dry-heated soybean protein isolate-dextran mixture[J].Food Hydrocolloids,2005,19(6):1025-1031
[6]Dickinson E.Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J].Soft Matter,2008(4):932-942
[7]Pongsawatmanit R,Harnsilawat T,McClements D J.Influence of alginate,pH and ultrasound treatment on palm oil-inwater emulsions stabilized byβ-lactoglobulin[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2006,287(1-3):59-67
[8]Ghosh S,Coupland J N.Factors affecting the freeze-thaw stability of emulsions[J].Food Hydrocolloids,2008,22(1):105-111
[9]Shepherd R,Robertson A,Ofman D.Dairy glycoconjugate emulsifiers:Casein-maltodextrins[J].Food Hydrocolloids,2000,14(4):281-286
[10]Oliver CM,Melton L D,Stanley R A.Creating proteins with novel functionality via the Maillard reaction:A review[J].Critical Reviews in Food Science and Nutrition,2006,46(4):337-350
[11]Wooster T J,Augustin M A.β-lactoglobulin-dextran maillard conjugates:their effect on interfacial thickness and emulsion stability[J].Journal of Colloid and Interface Science,2006,303(2):564-572
[12]Dickinson E.Hydrocolloids as emulsifiers and emulsion stabilizers[J].Food Hydrocolloids,2009,23(6):1473-1482
[13]Tian S,Chen J,Small D M.Enhancement of solubility and emulsifying properties of soy protein isolates by glucose conjugation[J].Journal of Food Processing and Preservation,2011,35(1):80-95
[14]Wang Xibo,Zhang Yinghua,Jiang Lianzhou.Improvement of Emulsifying Properties of Soybean Protein Isolate through Glycosylation Modification[J].Advanced Materials Re-search,2013,781-784:1495-1499
[15]Pearce K N,Kinsella JE.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723
[16]O’Regan J,Mulvihill D M.Heat stability and freeze-thaw stability of oil-in-water emulsions stabilized by sodium caseinate-maltodextrin conjugates[J].Food Chemistry,2010,119(1):182-190
[17]Mun S,Cho Y,Decker E A,et al.Utilization of polysaccharide coatings to improve freeze-thaw and freeze-dry stability of protein-coated lipid droplets[J].Journal of Food Engineering,2008,86(4):508-518
[18]Sorgentini D A,Wagner J R.Comparative study of structural characteristics and thermal behavior of whey and isolate soybean proteins[J].Journal of Food Biochemistry,1999,23(5):489-507
[19]Ajandouz E H,Tchiakpe L S,Benajiba A,et al.Effects of pH on caramelization and Maillard reaction kinetics in fructoselysine model systems[J].Journal of Food Science,2001,66(7):926-931
[20]Dickinson E,Galazka V B.Emulsion stabilisation by ionic and covalent complexes ofβ-lactoglobulin with polysaccharides[J].Food Hydrocolloids,1991,5(3):281-296
[21]曲刚.通过糖基化反应改善花生分离蛋白和大豆分离蛋白乳化性[D].无锡:江南大学,2008
[22]郭兴凤,王延青,胡婷婷,等.大豆蛋白-壳聚糖共价复合物制备研究[J].粮食与油脂,2010(8):8-11
[23]管军军.微波合成大豆蛋白-糖接枝物机理、结构及功能性[D].无锡:江南大学,2005
[24]Brands C,Van Boekel M.Kinetic modelling of reactions in heated monosaccharide-casein systems[J].Journal of Agricultural and Food Chemistry,2002,50(23):6725-6739
[25]陆钫.美拉德反应改进大米蛋白功能性质的研究[D].无锡:江南大学,2008
[26]Oliver C M,Kher A,McNaughton D,et al.Use of FTIR and mass spectrometry for characterization of glycated caseins[J].Journal of Dairy Research,2009,76(1):105-110
[27]Benjakul S,Lertittikul W,Bauer F.Antioxidant activity of maillard reaction products from a porcine plasma protein-sugar model system[J].Food Chemistry,2005,93(2):189-196
[28]Liu Yan,Zhao Guanli,Zhao Mouming,et al.Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J].Food Chemistry,2012,131(3):901-906.
Preparation of Soy Protein with High Freeze-Thaw Stabilization
Sun Hongrui1Wang Xibo1Zhang Yinghua1Jiang Guochuan2Jiang Lianzhou1
(College of Food Science,Northeast Agricultural University1,Haerbin 150030)(College of Food Science and Engineering,Jilin Agricultural University2,Changchun 130118)
Soy protein isolate-dextran graft reaction products have been prepared by Maillard reaction on the wet-heating condition,and the freeze-thaw stabilization of conjugates has been studied in the paper.The results indicated that the high freeze-thaw stabilization of soy protein isolate can be improved through Maillard reaction.The optimum conditions are as follows:soy protein isolate concentration 40 mg/mL,the weight ratio of soy protein isolate and dextran 1∶3,reaction time 4 h,pH 8.0,and reaction temperature 95℃.Compared with the previously unmodified soy protein isolate,the emulsifying activity index(EAI)of before and after freezing and thawing were increased by 1.69 and 1.76 times respectively,and the emulsion stability index(ESI)were increased by 1.37 and 1.27 times respectively.Fourier transform infrared spectroscopy(FT-IR)analysis showed that compared to soy protein,soy protein isolate-dextran conjugates in 3 700~3 200 cm-1stretching vibration presented a wider absorption.SPI-D also showed a strong absorption at 1 000 cm-1and soy protein isolate was grafted with dextran molecules by covalent bonds.The conjugates had the strongest florescence intensity on condition of emission of 347 nm,the excitation of 435 nm and it was conformed to the fluorescence characteristics of Maillard reaction products.All data showed that the complex of the soy protein and dextran had been produced by the reaction.
soy protein isolate,emulsifying properties,freeze-thaw,Maillard reaction
TS201.2
A
1003-0174(2015)04-0050-06
863计划(2013AA102208),国家大豆产业技术体系项目(CARS-04-PS25),黑龙江省教育厅科研项目(12531050),黑龙江省应用技术研究与开发计划项目(WB13C10201)
2013-12-10
孙洪蕊,女,1989年出生,硕士,食品科学
王喜波,男,1975年出生,副教授,粮食油脂及植物蛋白工程
