5种杂豆体外抗氧化性研究
2015-12-19杜双奎王晗欣乔丽华
赵 艳 杜双奎 王晗欣 乔丽华
(西北农林科技大学食品科学与工程学院,杨凌 712100)
5种杂豆体外抗氧化性研究
赵 艳 杜双奎 王晗欣 乔丽华
(西北农林科技大学食品科学与工程学院,杨凌 712100)
对5个不同属的红小豆、小扁豆、红芸豆、蚕豆、鹰嘴豆等杂豆品种的体外抗氧化活性进行研究。结果表明,不同属的杂豆品种间抗氧化能力差异显著(P<0.05);杂豆中总酚、总黄酮、原花青素含量分别在1.24~15.07、0.68~17.55、1.08~11.61 mg/g之间,其中小扁豆属的品种总酚含量最高;杂豆对DPPH·和·OH均具有一定的清除作用,小扁豆的铁还原能力(FRAP)(1 033.38~1 475.07μmol/g)、DPPH·清除能力(93.62%~95.96%)和亚铁离子螯合能力(10.48 mg/g)相对较高;菜豆属的品种对·OH清除能力较强(88.55%~93.59%),豇豆属的杂豆品种对·OH清除率较弱(59.74%~66.33%);蚕豆的亚铁离子螯合能力较强(9.07~9.18 mg/g),深红芸豆的亚铁离子螯合能力最弱(1.89 mg/g)。
杂豆 抗氧化活性 总酚 FRAP
杂豆为豆科属草本植物,作为人类的健康食物来源,具有较高的营养价值。杂豆中富含蛋白质、氨基酸、黄酮、原花青素、酚类物质等,这些物质具有较高抗氧化活性,可作为很好的天然抗氧化食物来源[1-2]。豆类植物中含有丰富的多酚类物质、黄酮及花色苷类物质,具有较高的抗氧化性[3-5]。周威等[5]研究认为食用豆类中多酚和单宁的含量均与其抗氧化活性呈正相关关系。Marathe等[6]研究表明,表皮颜色较深的杂豆抗氧化性较强,且抗氧化性强弱与杂豆中所含酚类物质有关。目前,国内对表皮颜色较深粮豆如黑芸豆、黑米等抗氧化活性已有研究[7-8],但对小扁豆、鹰嘴豆、红芸豆和蚕豆等不同属不同种皮色杂豆的抗氧化活性差异研究较少。本试验以丙酮为溶剂,提取杂豆中的活性物质,研究其酚类物质含量、清除自由基的能力、铁还原能力等,旨在为杂豆的开发利用提供参考依据。
1 材料与方法
1.1 材料
豇豆属(Vigna)的红小豆种(建红4号、冀红9218),菜豆属(Phaseolus)的普通菜豆种(大红芸豆、深红芸豆、长红芸豆),小扁豆属(Lens)的小扁豆种(定西小扁豆、榆林扁豆)由西北农林科技大学农学院提供;蚕豆属(Vicia)的蚕豆种(蚕豆常规种1、蚕豆常规种2)和鹰嘴豆属(Cicer)的鹰嘴豆种(鹰嘴豆134号、鹰嘴豆135号)由新疆农科院提供。
1.2 试验试剂
没食子酸、芦丁、儿茶素、1,1-苯基-2-苦肼基自由基(DPPH·)、Fe3+-三吡啶三吖嗪(TPTZ)、菲洛嗪:Sigma公司。
1.3 仪器与设备
FW 100型高速万能粉碎机:天津泰斯特仪器有限公司;KDC-40低速离心机:科大创新股份有限公司中佳分公司。
1.4 试验方法
1.4.1 提取液的制备
准确称取2.0 g脱脂杂豆粉,用25 mL 70%丙酮(丙酮∶水∶乙酸 =70∶29.5∶0.5,v/v/v)在 25℃下震荡提取3 h,3 800 r/min离心 10 min,收集上清液。残留物再用70%丙酮提取3 h,离心,合并提取液,定容至50 mL,分析用。
1.4.2 总酚含量测定
总酚含量测定采用Folin-Ciocalteu测定法。取1.0 mL样品提取液,加入0.5 mL Folin-Ciocalteu试剂,之后加入2.5 mL 20%Na2CO3,摇匀并定容,室温静置2 h,测其在765 nm波长下的吸光度。以没食子酸浓度为横坐标,A765值为纵坐标绘制标准曲线,回归方程为y=0.105 7x+0.020 7(0~8.4μg/mL,R2=0.998 6)。总酚含量以每克提取物(干基)中所含相当于没食子酸的量表示。
1.4.3 总黄酮含量测定[12]
取1.0 mL样品提取液,加30%乙醇至5 mL,之后加入0.3 mL 5%NaNO2,静置5 min,再加入0.3 mL 10%Al(NO3)3,静置 6 min,加入 4 mL 4%NaOH,定容,摇匀并静置15min,在510 nm下测定吸光值,绘制吸光度与芦丁浓度的标准曲线,回归方程为y=11.373x-0.005 4(0~0.07 mg/mL,R2=0.999 5)。总黄酮含量以每克提取物(干基)中所含相当于芦丁的量表示。
1.4.4 原花青素含量测定
采用香草醛—盐酸法[9]。取1.0 mL样液,加入3.0 mL 4%的香草醛甲醇溶液和1.5 mL浓盐酸,混匀并静置15 min,在500 nm处测定吸光度。绘制吸光度与儿茶素浓度的标准曲线,回归方程为y=0.915 0x-0.016 0(0~1.0 mg/mL,R2=0.996 3)。原花青素含量以每克提取物(干基)中所含相当于儿茶素的量表示。
1.4.5 抗氧化试验
1.4.5.1 DPPH·清除率测定[19]
取1.0 mL样品提取液,加入2 mL 2×10-4mol/L DPPH·和4.0 mL无水乙醇,室温下避光静置30 min,以无水乙醇做空白,于517 nm下测定吸光度。根据下式计算样品液对DPPH·的清除率:清除率=[1-(A1-A2)/A0]×100%,式中 A0为用无水乙醇代替样品时的吸光度;A1为加样品与DPPH·时的吸光度;A2为用无水乙醇代替DPPH·时的吸光度。
1.4.5.2 ·OH清除率测定[11]
分别取不同浓度的样品液2.0 mL,依次加入6 mmol/L FeSO4溶液 1 mL,1mL 6 mmol/L水杨酸溶液和1 mL 6 mmol/L H2O2溶液,混匀,静置 30 min,测其在510 nm处的吸光度值。根据下式计算样品液对·OH的清除率:清除率 =[1-(A1-A2)/A0]×100%,式中A0为空白管的吸光度;A1为样品管的吸光度;A2为用蒸馏水代替H2O2时的吸光度。
1.4.5.3 铁还原能力(FRAP)测定[10]
取30μL样品提取液,加入900μL FRAP工作液,并定容至10 mL,混匀后,在37℃的水浴中反应30 min,于593 nm波长处测其吸光度。其中FRAP工作液由20 mmol/L的TPTZ溶液(用40 mmol/L的HCl溶液配制),20 mmol/L的 FeCl3·6H2O溶液,0.3 mol/L的乙酸钠缓冲液(pH 3.6)按 10∶1∶1体积比混合组成。按照上述方法,以FeSO4的标准溶液代替样品液绘制标准曲线。
1.4.5.4 亚铁离子螯合能力测定[6]
取样品提取液0.1 mL,依次加入0.6 mL蒸馏水,2 mmol/L的氯化亚铁溶液0.1 mL,最后加入5 mmol/L的菲洛嗪溶液0.2 mL,混匀并静置10 min,测其在562 nm波长处的吸光度。按照上述方法,以EDTA标准溶液代替样品液绘制标准曲线。
2 结果与分析
2.1 总酚含量
杂豆总酚含量测定结果见表1。不同属杂豆品种间总酚含量差异显著(P<0.05),小扁豆属、豇豆属品种的总酚含量高,鹰嘴豆属品种总酚含量最低,杂豆总酚含量在1.24~15.07 mg/g之间变化。杜双奎等[11]报道小扁豆的总酚含量为 46.0 mg/g,远高于本研究。Xu等[12]报道小扁豆和鹰嘴豆的总酚含量分别为4.86~9.60 mg/g和 0.98 mg/g,均低于本研究结果。Xu等[13]研究发现红小豆和红芸豆的总酚含量分别为12.5mg/g和6.85mg/g,低于本研究结果。蚕豆总酚含量低于Siah等[14]报道的结果(8.6~11.2 mg/g),但是高于 Baginsky等[15]的研究结果(1.10 mg/g)。与 Amarowicz等[16]研究结果相比,红小豆、扁豆、蚕豆总酚含量均高于本研究。这些结果的差异可能与杂豆来源、品种及不同试验方法有关。
2.2 总黄酮含量
由表1可以看出,不同属杂豆品种之间总黄酮含量有差异(P<0.05),总黄酮含量在0.68~17.55 mg/g之间变化,且菜豆属中的长红芸豆总黄酮含量最高,鹰嘴豆属中的鹰嘴豆135号含量最低。除鹰嘴豆属下的2个品种总黄酮含量没有显著差异外,其余属下的各品种间差异均显著。与Xu等[12]研究结果相比,小扁豆总黄酮含量(3.04~4.54 mg/g)低于本研究结果。鹰嘴豆总黄酮含量明显低于Sreerama等[17]的研究结果(4.80 mg/g)。红芸豆、小扁豆和红小豆的总黄酮含量明显高于大米、小麦、玉米、甜荞等谷物总黄酮含量[18]。
2.3 原花青素含量
由表1可以看出,杂豆原花青素含量在1.08~11.61 mg/g之间变化,杂豆原花青素含量由高到低依次为长红芸豆>建红4号>定西小扁豆>大红芸豆>榆林扁豆>蚕豆常规种1>冀红9218>蚕豆常规种2>深红芸豆>鹰嘴豆134号>鹰嘴豆135号。与 Xu等[12]研究结果相比,红小豆(5.16 mg/g)和红芸豆(2.87 mg/g)原花青素含量均低于本研究结果,而小扁豆原花青素含量(10.20 mg/g)高于本研究结果。本研究中蚕豆的原花青素含量高于Siah等[14]的研究结果(0.13~0.32 mg/g)。鹰嘴豆原花青素含量明显低于 Sreerama等[17]的研究结果(5.12 mg/g)。

表1 杂豆提取物总酚、总黄酮及原花青素含量
2.4 杂豆提取物对DPPH·的清除作用
杂豆提取物对DPPH·的清除能力如图1所示。由图1可以看出,原样品对 DPPH·的清除率在4.40%~95.96%之间,稀释5倍后对DPPH·的清除率为2.02%~89.37%。定西小扁豆对DPPH·的清除能力相对较强,原样品清除率达95.96%,稀释5倍后清除率达到89.37%;冀红9218清除率为94.39%,但稀释5倍后清除率降低了50%;深红芸豆清除率为94.13%,稀释5倍后约降低3倍;鹰嘴豆属的2个品种对DPPH·的清除作用最弱,仅有4.40% ~4.95%。Gujral等[19]研究发现,红芸豆对DPPH·清除率最高(38.1%),鹰嘴豆最低(12.3%),这与本研究结果相一致。任顺成等[20]分析了14种豆类对DPPH·的清除能力,其强弱依次为刀豆>黑小豆>花豇豆>赤豆>芸豆>饭豆>蚕豆>黑大豆>绿豆>豌豆>麻豇豆>大豆>绿大豆>鹰嘴豆,前3种豆类清除自由基的能力明显强于其他豆类,而鹰嘴豆清除自由基能力较弱。不同杂豆对DPPH·清除能力的差异可能与杂豆中酚类物质含量和组成等有关。
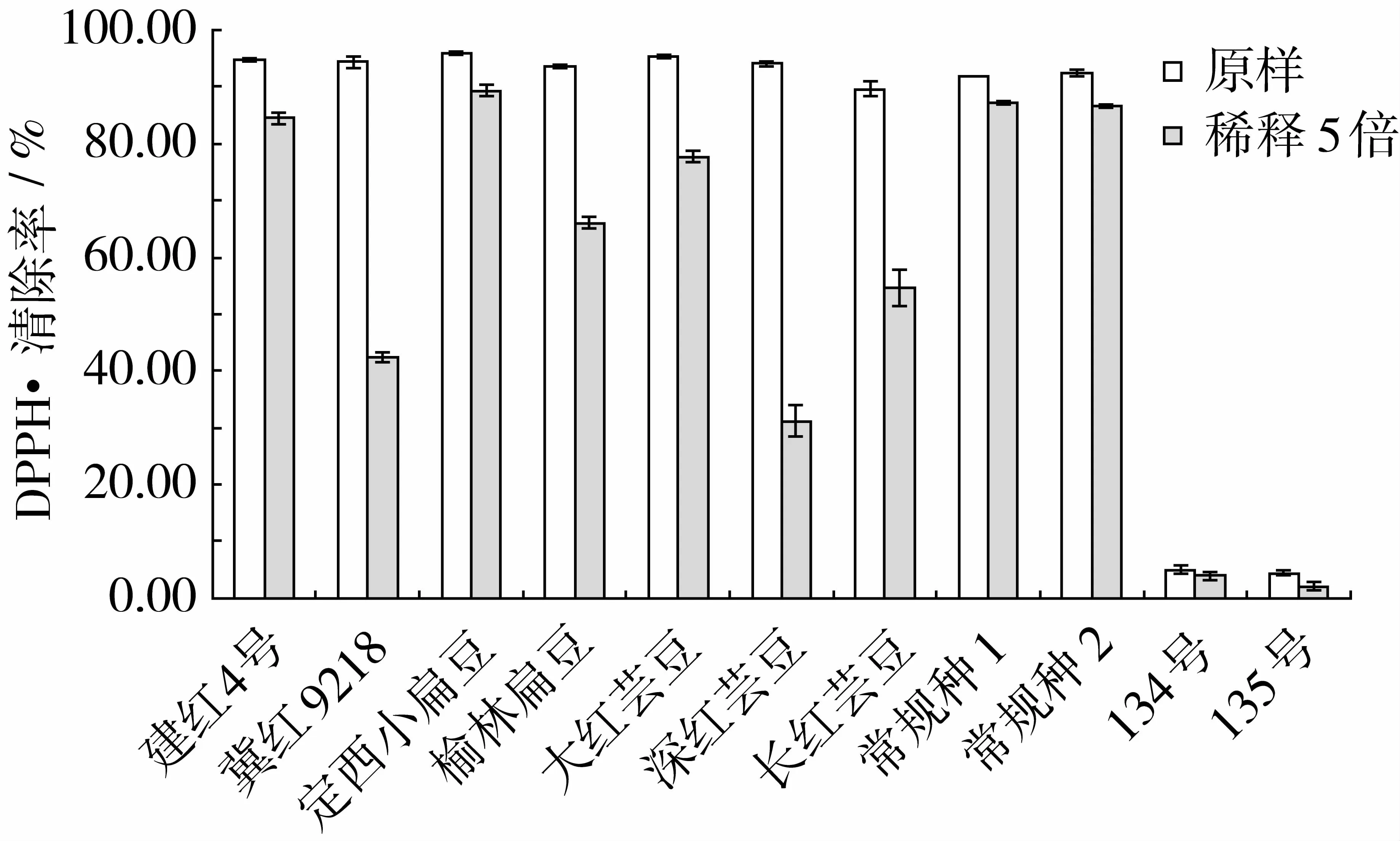
图1 杂豆提取物对DPPH·的清除作用
2.5 杂豆提取物对·OH的清除能力
杂豆提取物对·OH清除能力见图2。杂豆原提取物对·OH的清除能力在59.74%~93.59%之间,稀释5倍后的清除率为39.66%~49.00%。菜豆属的杂豆品种有较高的·OH清除能力,深红芸豆对·OH的清除率最高(93.59%);豇豆属的杂豆品种对·OH清除率较弱,建红4号对·OH清除率最低(59.74%)。与杜双奎等[11]研究结果相比,杂豆对·OH的清除能力(60.09%~66.15%)均低于本研究结果。与聂芊等[3]研究结果相比,红豆对·OH清除率(73%)均高于本研究结果,而芸豆对·OH清除率(47.5%)均低于本研究结果。杂豆提取物对·OH清除能力的差异可能是由于提取物与金属离子如Fe2+的螯合抑制了·OH的清除[21]。
2.6 杂豆提取物的铁还原能力(FRAP)
由表2可以看出,不同属杂豆品种间的铁还原能力在45.02~1 475.07μmol/g之间变化。小扁豆属的2个品种间差异显著,定西小扁豆的铁还原能力较强,FRAP值为1 475.07μmol/g;菜豆属的长红芸豆的铁还原能力较强,FRAP值为1 008.29μmol/g;鹰嘴豆属的2个品种铁还原能力相对最弱,FRAP值为45.03μmol/g和53.38μmol/g,2个品种间没有显著差异。Marathe等[6]研究表明鹰嘴豆和小扁豆的铁还原能力分别为 7.39μmol/g和 9.60μmol/g,均低于本研究结果。Nithiyanantham等[22]研究表明,鹰嘴豆丙酮提取物的铁还原能力为758 mmol/μg。Xu等[12]研究了几种杂豆的铁还原能力,其中小扁豆的铁还原能力最高(11.79 mmol FE/100 g)。
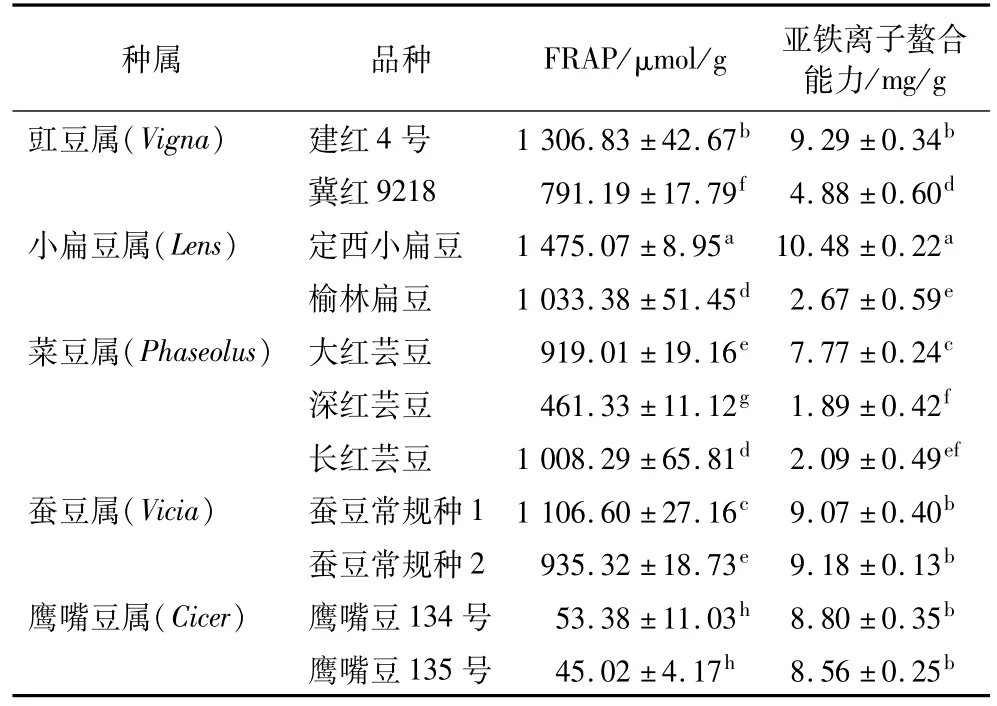
表2 杂豆提取物的铁还原能力(FRAP)及亚铁离子螯合能力
2.7 杂豆的亚铁离子螯合能力
由表2可以看出,杂豆提取物的亚铁离子螯合能力在1.89~10.48 mg/g之间,其强弱依次为定西小扁豆>建红4号>蚕豆常规种2>蚕豆常规种1>鹰嘴豆134号>鹰嘴豆135号>大红芸豆>冀红9218>榆林扁豆>长红芸豆>深红芸豆,其中小扁豆属品种间、菜豆属品种间的亚铁离子螯合能力差异显著(P<0.05)。Han等[23]的研究结果表明小扁豆的亚铁离子螯合能力(3.0~4.2 mgEDTA/g)高于鹰嘴豆(1.0 mgEDTA/g)。Marathe等[6]研究了几种杂豆的抗氧化性,结果表明小扁豆的亚铁离子螯合能力为0.6~1.0μmolEDTA/g,鹰嘴豆的亚铁离子螯合能力小于0.6μmolEDTA/g。杂豆亚铁离子螯合能力的不同可能与杂豆中的酚类物质以及其它活性物质有关[6]。
3 讨论
杂豆提取物中总酚、总黄酮、原花青素含量分别在1.24~15.07、0.68~17.55、1.08~11.61 mg/g之间,这些复杂的活性成分可能赋予提取物抗氧化活性,但其中究竟何种物质抗氧化活性最强、各成分之间的活性是否存在增效作用等目前尚不明确,因此对杂豆中抗氧化活性成分的分离纯化及其作用机理需要进一步研究和探讨。杂豆提取物具有较好的清除DPPH·、·OH能力和铁还原能力及亚铁离子螯合能力,并在一定范围内与抗氧化物质含量呈量效关系,杂豆提取物的抗氧化活性与杂豆品种、提取方法及具体的抗氧化测定方法有关。
4 结论
杂豆中总酚、总黄酮、原花青素含量分别在1.24~15.07、0.68~17.55、1.08~11.61 mg/g之间,其中小扁豆属的品种总酚含量相对较高,鹰嘴豆属的品种最低。不同杂豆品种间抗氧化能力强弱不同,杂豆提取物具有较好的清除DPPH·、·OH能力和铁还原能力及亚铁离子螯合能力。小扁豆DPPH·、铁还原能力及亚铁离子螯合能力均最强,鹰嘴豆最弱。菜豆属的深红芸豆品种对·OH清除能力最强,蚕豆属的品种亚铁离子螯合能力较强。
[1]Heimler D,Vignolini P,DiniM G,et al.Rapid tests to assess the antioxidant activity ofPhaseolus vulgaris L.dry beans[J].Journal of Agricultural and Food Chemistry,2005,53:3053-3056
[2]Madhujith T,Naczk M,Shahidi F.Antioxidant activity of common beans(Phaseolus vulgaris L.)[J].Journal of Food Lipids,2004,11:220-233
[3]聂芊,廖顺雯,刘涛.四种粮豆作物的花色苷抗氧化性能比较[J].食品科学,2007,9:46-48
[4]徐金瑞,张名位,刘兴华.黑大豆种皮花色苷体外抗氧化活性研究[J].营养学报,2007,29(1):54-57
[5]周威,王璐,范志红.小粒黑大豆和红小豆提取物的体外抗氧化活性研究[J].食品科技,2008,33(9):145-148
[6]Marathe SA,Rajalakshmi V,Jamdar SN,et al.Comparative study on antioxidant activity of different varieties of commonly consumed legumes in India[J].Food and Chemical Toxicology,2011,49,2005-2012
[7]李次力.黑芸豆中花色苷色素的微波提取及功能特性研究[J].食品科学,2008,29(9):299-302
[8]孙玲,张名位,池建伟,等.黑米的抗氧化性及其与黄酮和种皮色素的关系[J].营养学报,2000,22(3):246-249
[9]Alasalvar C,KaramM,Kosińska A,etal.Antioxidantactivity of hazelnut skin phenolics[J].Journal of Agricultural and Food Chemistry,2009,57:4645-4650
[10]Pulido R,Bravo L,Saura-Calixto F.Antioxidant activity of dietary polyphenols as determined by amodified ferric reducing/antioxidant power assay[J].Journal of Agricultural and Food Chemistry,2000,48,3396-3402
[11]杜双奎,于修烛,李志西.食用杂豆乙醇提取物的体外抗氧化活性研究[J].中国食品学报,2012,11:14-18.
[12]Xu B J,Yuan SH,Chang SK C.Comparative analyses of phenolic composition,antioxidant capacity,and color of cool season legumes and other selected food legumes[J].Journal of Food Science,2007,72,S167-S177
[13]Xu B J,Chang SK C.Comparative study on antiproliferation properties and cellular antioxidant activities of commonly consumed food legumes against nine human cancer cell lines[J].Food Chemistry,2012,134,1287-1296
[14]Siah S,Wood JA,Agboola S,et al.Effects of soaking,boiling and autoclaving on the phenolic contents and antioxidant activities of faba beans(Vicia fabaL.)differing in seed coat colors[J].Food Chemistry,2014,142,461-468
[15]Baginsky C,Peña-Neira,Cáceres A,Hernández T,etal.Phenolic compound composition in immature seeds of fava bean(Vicia fabaL.)varieties cultivated in Chile[J].Journal of Food Composition and Analysis,2013,31,1-6
[16]Amarowicz R,Ska A T,Ko-Pikielna N B,etal.Polyphenolics extracts from legume seeds:correlations between total antioxindant activity,total phenolics content,tannins contentand astringency[J].Journalof Food Lipids,2004,11:278-286
[17]Sreerama Y N,Sashikala V B,Pratape VM.Phenolic compounds in cowpea and horse grame flours in comparison to chickpea flour:evaluation of their antioxidant and enzyme inhibitory properties associated with hyperglycemia and hypertension[J].Food Chemistry,2012,133,156-162
[18]徐元元,国旭丹,贺丽霞,等.常见6种杂粮与2种主粮的抗氧化活性比较研究[J].食品科学,2012,33(7):20-25.
[19]Gujral H S,Sharma P,Gupta N,etal.Antioxidant properties of legumes and theirmorphological fractions as affected by cooking[J].Food Science and Biotechnology,2013,22(1):187-194
[20]任顺成,王鹏,马宇翔,等.常见食用豆类提取液抗氧化特性研究[J].大豆科学,2009,28(6):1081-1085
[21]Qi H M,Zhang Q B,Zhao T T,et al.Antioxidant activity of different sulfate content derivatives of polysaccharide extracted fromUlva pertusa(Chlorophyta)in vitro[J].International Journal of Biological Macromolecules,2005,37,195-199
[22]Nithiyanantham S,Selvakumar S,Siddhuraju P.Total phenolic content and antioxidant activity of two different solvent extracts from raw and processed legumes,Cicer arietinumL.andPisum sativumL[J].Journal of Food Composition and Analysis,2012,27,52-60
[23]Han H,Baik B-K.Antioxidant activity and phenolic content of lentils(Lens culinaris),chickpeas(Cicer arietinumL.),peas(Pisum sativumL.)and soybeans(Glycine max),and their quantitative changes during processing[J].International Journal of Food Science and Technology,2008,43,1971-1978.
In Vitro Antioxidant Activity of Five Food Legumes
Zhao Yan Du Shuangkui Wang Hanxin Qiao Lihua
(College of Food Science and Engineering,Northwest A&F University,Yangling 712100)
Thein vitroantioxidant activities of lentils,adzuki beans,red kidney beans,five beans and chickpeaswhich were from five different genuseswere investigated.The results showed that the phenolic content and antioxidant activity were significantly differed between legume extracts(P<0.05).The content of total phenolic,flavonoids and proanthocyanidins in the extracts from food legumes were in the range of 1.24~15.07,0.68~17.55 and 1.08~11.61 mg/g,respectively,with the total phenolic content in lentils having the highest value.All legume were able to scavenge DPPH· and·OH.Lentil exhibited relatively high DPPH· scavenging activity(93.62%~95.96%),metal chelating activity(10.48mg/g)and FRAP(1 033.38~1 475.07μmol/g).Phaseolushad higher·OH scavenging ability(88.55% ~93.59%)than other legume extracts,Vignahad lowest·OH scavenging ability(59.74% ~66.33%);the highestmetal chelating activity was found in fava beans(9.07~9.18 mg/g)and the lowestwas found in red kidney bean(1.89 mg/g).
legumes,antioxidant activities,phenolic content,FRAP
S529
A
1003-0174(2015)10-0006-05
陕西省农业科技攻关(2012K02-14),陕西省科技厅战略性新兴产业重大产品项目(2015KTCQ02-21)
2014-05-19
赵艳,女,1989年出生,硕士,食用豆类抗氧化性
杜双奎,男,1972年出生,副教授,杂粮资源开发与利用研究
