浅谈广东化学高考重要考点之离子浓度问题
2015-12-18陈晓燕,衷明华
浅谈广东化学高考重要考点之离子浓度问题
陈晓燕衷明华
(韩山师范学院化学系,广东 潮州 521041)
摘要:纵观近五年广东省化学高考试题,可以看出离子浓度问题一直深受广东高考的青睐,离子浓度这类问题的出题方式比较单一,一般以选择题来考查,分值在4~6分。其难度适中,涉及到水的电离、盐类的水解电离,以及三大守恒。只要掌握相关知识点和解题思想,拿下该题的分数基本不成问题。
关键词:离子浓度高考守恒
一、知识点梳理
离子浓度问题不外乎三个方面:电离、水解和守恒(电荷守恒、物料守恒及质子守恒)。对有关电解质溶液中离子浓度大小比较的题,在做题时首先搞清溶液状况,是单一溶液还是混合溶液,然后再根据情况分析。
1、单一溶质的溶液中离子浓度比较
①多元弱酸溶液中,由于多元弱酸是分步电离(注意,电离都是微弱的)的,第一步的电离远远大于第二步,第二步远远大于第三步。由此可判断多元弱酸溶液中离子浓度大小顺序。例H3PO4溶液中:
c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)
②多元弱酸的强碱正盐溶液中,要根据酸根离子的分步水解(注意,水解都是微弱的)来分析。第一步水解程度大于第二步水解程度,依次减弱.如Na2S溶液中:
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
③多元弱酸的酸式盐溶液中:由于存在弱酸的酸式酸根离子的电离,同时还存在弱酸的酸式酸根离子的水解,因此必须搞清电离程度和水解程度的相对大小,然后判断离子浓度大小顺序。常见的NaHCO3NaHS,Na2HPO4溶液中酸式酸根离子的水解程度大于电离程度,溶液中c(OH-)>c(H+)溶液显碱性,例NaHCO3中:
c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
反例:NaHSO3,NaH2PO4溶液中弱酸根离子电离程度大于水解程度,溶液显酸性c(H+)>c(OH-)。例在NaHSO3中:
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
规律:①第一步水解生成的粒子浓度在[OH-]和[H+]之间,第二步水解生成的粒子浓度最小。例:Na2S溶液中的各离子浓度大小的顺序:
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
②不同溶液中同种离子浓度的比较:既要考虑离子在溶液中的水解因素,又要考虑其它离子的影响,是抑制还是促进,然后再判断。
例:常温下物质的量浓度相等的a.(NH4)2CO3、b.(NH4)2SO4、c.(NH4)2Fe(SO4)2三种溶液中c(NH4+)的大小;NH4+在水溶液中发生水解显酸性,CO32-离子水解显碱性,两离子水解相互促进,Fe2+水解显酸性与NH4+水解相互抑制,因此三溶液中c(NH4+):c>b>a。
2、混合溶液中离子浓度的比较
①强酸与弱碱溶液混合后溶液中离子浓度大小比较,首先要考虑混合后溶液的状况及溶液的酸碱性。酸过量:溶液为强酸和强酸弱碱盐的混合溶液,溶液中c(H+)>c(OH-)呈酸性。
酸碱恰好完全反应:溶液为单一盐溶液,弱碱根离子水解,溶液呈酸性。
碱少量过量:溶液为弱碱和强酸弱碱盐的混合溶液,溶液中c(OH-)=c(H+)呈中性。
碱大量过量:溶液为大量弱碱和强酸弱碱盐的混合溶液,溶液中c(OH-)>c(H+)呈碱性.根据这几种情况可判断溶液中离子大小情况。
②强碱和弱酸溶液混合后,溶液中离子浓度的大小比较。
呈碱性包括两种情况;强碱和强碱弱酸盐的混合溶液及单一强碱弱酸盐溶液。
呈中性:强碱弱酸盐和少量弱酸的混合溶液。
呈酸性:强碱弱酸盐和大量弱酸的混合溶液。
3、理解掌握电解质溶液中的几种守恒关系
①电荷守恒:因为溶液必须保持电中性,所以溶液中所有阳离子的电荷总浓度等于所有阴离子的电荷总浓度。如0.1 mol/L Na2S溶液中:
c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
②物料守恒:物料守恒即元素守恒,变化前后某种元素的原子个数守恒。如 0.1 mol/L Na2S溶液中:
c(Na+)=2c(H2S)+2c(HS-)+2c(S2-)
③质子守恒:利用电荷守恒和物料守恒即可推出质子守恒。如0.1 mol/L Na2S溶液中:
2c(H2S)+c(HS-)+c(H+)=c(OH-)
二、例题分析
例1:(2012第23题6分)对于常温下pH为2的盐酸,叙述正确的是()。
A.c(H+)=c(Cl-)+c(OH-)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10-12mol·L-1
D.与等体积0.01 mol·L-1乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-)
答案:AC。
解析:A.根据电荷守恒可知A正确;B.氨水过量,混合后溶液应该显碱性,B错误;C:c(H+)水= c(OH-)水=KW/ c(H+)=1.0×10-12mol·L-1,C正确;D.反应后生成乙酸和氯化钠,水溶液为酸性,乙酸是弱酸,所以=c(CH3COO-)不可能等于c(Cl-),D错误。
例2:(2013第12题4分)50℃时,下列各溶液中,离子的物质的量浓度关系正确的是()。
A.pH=4的醋酸中:c(H+)=4.0mol·L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1
答案:C。
解析:50℃时,水的离子积常数大于1×10—14。pH=4的醋酸中,c(H+)=1×10—4mol/L,A错误;饱和小苏打溶液中,HCO3-会发生水解反应导致浓度减小,c(Na+)>c(HCO3-)B错误;饱和食盐水中,(Na+)+c(H+)=c(Cl-)+c(OH-),符合电荷守恒的关系,C正确;由于题干给的温度不是常温下,所以pH=12的纯碱溶液中c(OH-)无法计算,D错误。
例3:(2014第12题4分)常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是()。
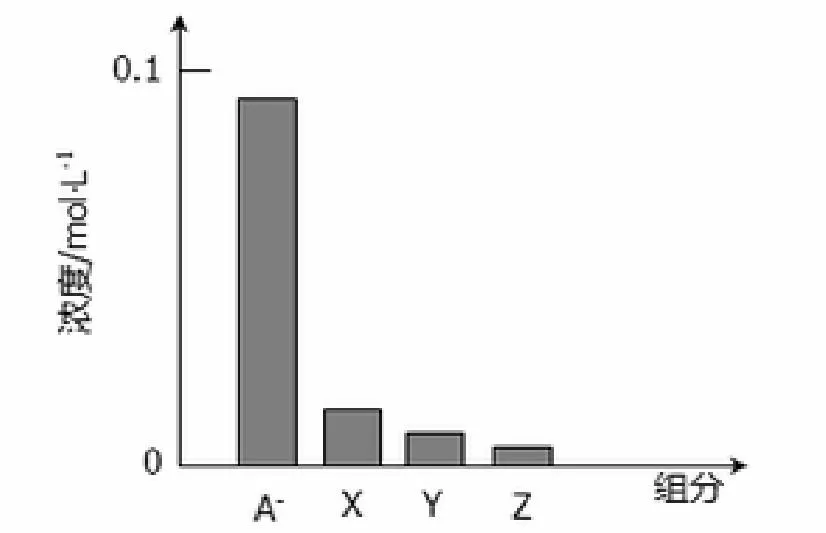
图 所得溶液中部分微粒组成及浓度
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
答案:D。
解析:A、A-浓度小于0.1mol/L,由此可知HA为弱酸,A错误;B、因为HA为弱酸,与等体积等浓度的NaOH混合后pH大于7,B错误;C、0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,得到NaA,离子浓度大小顺序为c(A-)>c(OH-)>c(HA)>c(H+),即X为OH-,Y表示HA,Z表示H+,C错误;D、Y表示HA,c(A-)+c(HA)=c(Na+),物料守恒,D正确。
三、总结
虽然离子浓度问题涉及到的知识点相对来说比较多,但是只要考生细心分析就会发现其实“万变不离其宗”,考生只要掌握该题的相关知识点,在平时做题时注意总结归纳,多反思,一定能够提高自己解答这类题的能力。
四、高考预测
离子浓度问题是高考的热点内容之一,也是教学中的重点和难点。从近几年高考命题的变化趋势来看,溶液中离子(或溶质粒子)浓度大小比较是主流试题,仍是今后高考的热点。预计2015年还会考到这类题,出题方式可能还会是选择题,考生在复习时应重点理解掌握该知识点,争取考试时做到融会贯通。
参考文献
[1]欧晓丽.离子浓度比较的简单方法[J].《数理化学习(高中版)》2014年11期.
