多酚氧化酶结构及褐变机理研究进展
2015-12-17刘芳赵金红朱明慧甘芝霖倪元颖
刘芳,赵金红,朱明慧,甘芝霖,倪元颖
(中国农业大学食品科学与营养工程学院,北京100083)
多酚氧化酶结构及褐变机理研究进展
刘芳,赵金红,朱明慧,甘芝霖,倪元颖*
(中国农业大学食品科学与营养工程学院,北京100083)
多酚氧化酶(polyphenoloxidase,PPO,EC.1.10.3.1)是动物、植物、真菌体内普遍存在的一类铜结合酶。在有氧条件下,PPO果蔬原料中的内源性多酚物质氧化为醌类物质,醌类物质聚合产生黑色素,是引起果蔬褐变的主要因素。多酚氧化酶的催化性质及活性抑制方面已经做了大量研究,取得了一定成果。但其结构(尤其是活性中心的结构)与褐变机理一直未研究清楚,本文综述了多酚氧化酶结构及褐变机理方面的研究进展,为这方面的研究工作提供参考。
多酚氧化酶;褐变;结构;活性中心;机理
早在1883年,Yoghid发现日本漆树树汁变硬可能与某种活性物质有关。1896年Betrand首次研究了这种物质,发现它是一种酶蛋白。1938年Keilin和Mann以及Kubowitz报道了多酚氧化酶的分离过程,为其性质的研究打下了基础[1]。随着研究的深入,多酚氧化酶分为单酚单氧化酶(酪氨酸酶tyrosinase,EC. 1.14.18.1)、双酚氧化酶(儿茶酚氧化酶catecholoxides,EC.1.10.3.2)和漆酶(laccase,EC.1.10.3.1)[2]。现在所说的多酚氧化酶一般是儿茶酚氧化酶和漆酶的统称。1998年,Klabunde等获得了从甘薯中分离出的多酚氧化酶的结晶,揭示了其活性中心是由一个以二价铜为中心的羟基桥组成,其中每个二价铜copper(II)与三个组氨酸相连。这一发现促进了分子水平上的构效关系模型的研究[3]。但由于多酚氧化酶的基因家族及其表达的复杂性,其反应途径、机理及其结构方面的信息仍然很不完善。多酚氧化酶在果蔬保藏、咖啡等饮料的制作及植物生理方面都有着非常重要的作用,研究其性质特点对实际生产有重要意义。而作用性质是由结构决定的,所以明确其结构是研究其作用特性及反应机理的根本。近年来,国外对多酚氧化酶结构的模拟探索逐渐深入,国内这方面的研究较浅较缺乏,缺乏对其结构信息的探索及总结。
1 PPO的一级结构
PPO通常先以无活性的前体形式存在。前体由N-端导肽、中间高度保守的Cu原子结合区和C-端疏水区3部分组成。PPO的Cu原子结合区是该酶的主要功能区,其他部分则对酶的构象、高级结构的形成和维持起作用[4]。中间高度保守的Cu原子结合区富含His残基,每个Cu与3个His残基以配位键相连,形成了有特定三维结构的活性部位[1]。Hernandez-Romero等(2006)从Ralstonia中分离出了一种酪氨酸酶,发现存在第7个组氨酸与Cu原子相连。大多数植物的PPO与细菌、真菌和哺乳动物酪氨酸酶相同,具有2个Cu原子结合区域(CuA和CuB)。其中CuA的保守性(92%~94%)要大于CuB(60%~82%)。也有人提出了第3个Cu结合区域,它富含His,CuA与PPO的水溶性有关,CuB是底物的连接位置,CuC则与分子氧相连,CuA—CuB彼此相互影响,CuB—CuC在空间相连,从而使酶整体具有活性[5]。
研究工作者在氨基酸序列方面做了大量研究工作。结构方面,PPOs不仅在氨基酸序列方面存在差异性,在其高度保守的活性中心氨基酸特征也存在差异[1]。Gerdemann C(2002)[6]比较了甜土豆中的儿茶酚酶、链孢霉菌中酪氨酸酶、淡青链霉菌酪氨酸酶、黑腹果蝇中酚氧化酶的前体、lpHC,马蹄蟹中血蓝蛋白和大章鱼血蓝蛋白几种多酚氧化酶的2个Cu结合区域的氨基酸序列,如图1所示。

图1 几种多酚氧化酶中与Cu原子结合的氨基酸序列[6]Fig.1 Sequence alignment of the copper-coordinating regions of the type-3 copper proteins.
ibCO为甜土豆儿茶酚酶(Ipomoea batatas);hsTYR为人类酪氨酸酶;ncTYR为链孢霉菌酪氨酸酶;sgTYR为淡青链霉菌酪氨酸酶;dmProPO为黑腹果蝇酚氧化酶前体;lpHC为马蹄蟹血蓝蛋白;odgHC为大章鱼血蓝蛋白。儿茶酚氧化酶和软体动物血蓝蛋白酶都有Cys-His二硫,但是节肢动物血蓝蛋白酶没有。与CuB结合的氨基酸序列结构大多相同,具有参与底物脱质子反应残基E236,但节肢动物的血蓝蛋白酶不具备该结构;而CuA结构有很大不同:虽然一般都具有H88和H118,但是第3个His常常有所差异。不同种植物,比如菠菜、梨、桃、蚕豆、胡萝卜、马铃薯、番茄、葡萄和苹果,它们的PPO具有高度的相似性(45%~95%)[7]。

图2 富士苹果与葡萄、白杨、番茄及土豆的PPOs氨基酸序列比较。框中部分是CuA与组氨酸残基结合区域,CuA,CuB and CuC组氨酸残基用着重号(*)标出Fig.2 Comparison of the derived amino acid sequences of the Fujiapple PPOs with the PPO proteins from grape berry,poplar,tomato and potato
不同种植物,比如菠菜、梨、桃、蚕豆、胡萝卜、马铃薯、番茄、葡萄和苹果,它们的PPO具有高度的相似性。图2比较了富士苹果与几种植物得氨基酸序列。整个氨基酸序列中,N-导肽与C-端保守性较低,而CuA与CuB区域比较保守。苹果PPOs氨基酸有43%~58%与其他植物PPOs一致,包括番茄、土豆、蚕豆、葡萄、杏及白杨。苹果的PPOs与其他植物的相似度为:杏(58%),葡萄(50%)和白杨50%。在这些相似片段中,存在2个高度保守的包括组氨酸残基的氨基酸序列:铜离子结合区,(CuA和CuB框中的部分)。富士PPOs的CuA区与杏、葡萄及白杨的CuA区相似度分别为88%,75%及77%。CuB为80,73及77%。同时发现,在苹果PPOs C端存在一个组氨酸残基的Cu离子结合区。同样的,在番茄、土豆及蚕豆中也都存在这样的区域(CuC,如图2所示)[7]。
2 多酚氧化酶的高级结构
因为PPO分离纯化及结晶的难度较大,以及其存在的广泛性和复杂性,其高级结构至今仍未解开。但研究普遍认为其三级结构与血蓝蛋白的结构相似。Gerdemann和Eichen(2002)比较了马铃薯PPO与章鱼HC时发现,成熟的PPO三维结构与HC(hemocyanin)很相似,但HC比PPO要多1个富含His的C-端,PPO的C-端只在前体中存在,他们推测马铃薯PPO的C-端可能与其三维结构的形成以及其酶的活性有关,并且能与Cu结合[4]。其C端与软体动物的血蓝蛋白具有同源性[8]。节肢动物的血蓝蛋白结构与酪氨酸酶结构比较,如图3所示。

图3 (a)节肢动物的血蓝蛋白[9]。区域II中包含着两个Cu原子(绿色的圆球形);(b)链霉菌属castaneoglobisporus酪氨酸酶与球蛋白ORF378结合后的整体结构[1]。酪氨酸酶用红色表示,ORF 378蛋白用蓝色表示。铜离子用绿色表示。Fig.3(a)Arthropod hemocyanin.Domain II(red)carries the active site with the two Cu atom s(green).(b)Overall structure of the tyrosinase from Streptomyces castaneoglobisporus,complexed with a“caddie”protein,ORF378.The tyrosinase is shown in red and the ORF 378 in blue.Copper atoms are shown as green spheres
彭益强等(2012)[10]研究了溴乙酸、乙酰丙酮、N-溴代琥珀酰亚胺、1,4-二硫代苏糖醇和对氯汞苯甲酸等具有相对专一性的氨基酸基团修饰剂,研究PPO的酶活性中心必需基团,结果表明富士苹果中的PPO蛋白结构中酶活性中心必需基团有组氨酸的咪唑基、精氨酸的胍基与色氨酸残基。Hernández-Romero D(2006)从R.solanacearum中分离出2种主要的具有酚酶特性的蛋白质:NP_518458与NP_519622。
根据Gerdemann等描述的儿茶酚酶的结构构造了6个铜原子与组氨酸残基组合的基本结构,如图4所示。
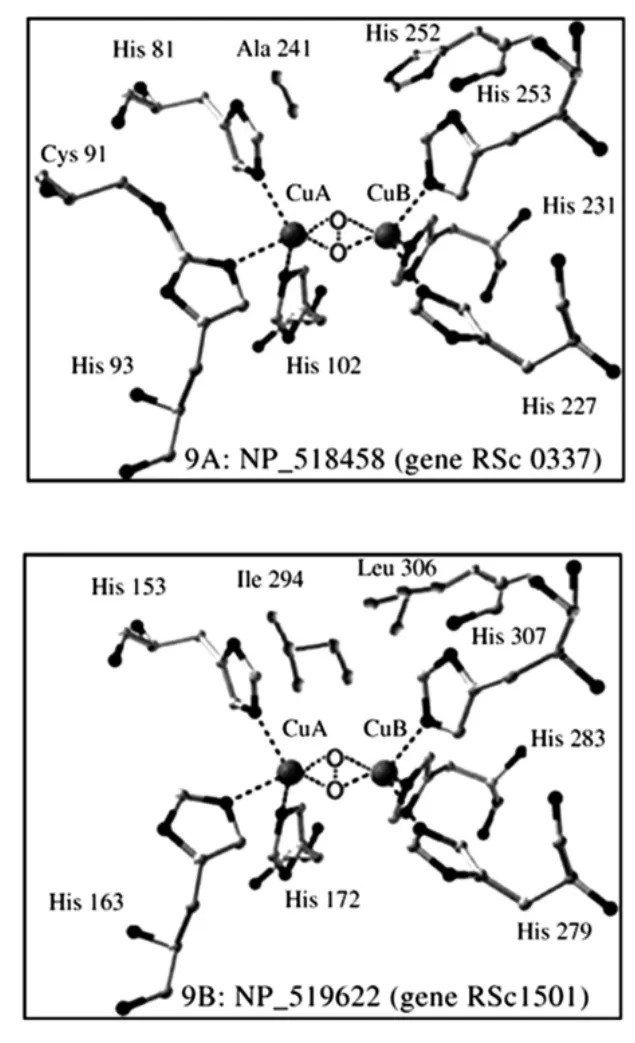
图4 两种PPOs活性中心的构象[11]Fig.4 A plausible scheme for the conformation of the active site for the two PPOs
两者存在2点不同,第一,在H3B前面的残基,在NP_518458中是H,而在NP_519622中是L。第二,在与甘薯儿茶酚酶第F261对应的位置,在NP_518458中是A,在NP_519622中是I[11]。NP_519622中有1294个基因,一个庞大的非芳香族的残基基团。随后是一个紧凑的P295残基基团。这个蛋白具有较低的单酚氧化酶活性。而NP_51845只含有一个很小的基团A241,同时表现出高酪氨酸羟化酶的活性。
Eicken C(1999)[12]发表了经过计算机软件SwissPdbViewer和POV-Ray处理的甘薯儿茶酚酶的活性中心示意图。甘薯儿茶酚酶分子量为39 KDa,大小为55×45×45Å椭球形单体。活性中心两个Cu(II)–Cu(II)相距2.5Å。其二级结构主要是α-螺旋,活性中心主要包括4个与中心的铜离子结合的α-螺旋结构α2、α3、α6和α7;外面被两个α-螺旋(α1和α4)和几个β折叠;两个维系N-端蛋白的Loop结构(氨基酸1-50)与α-螺旋结构相连的二硫键C11-C28和C27-C89)以及活性配体残基(比如控制底物接近速度的Phe(F261))。
PPO通常是一种由4个亚基组成的寡聚蛋白质,如薯蓣皂小球茎PPO和莴苣的PPO;但大白菜、香草中PPO则是由3个亚基聚合形成;蘑菇的儿茶酚氧化酶则是一种多聚酶,分重链(43 kDa)和轻链(13.4 kDa);从甲壳类动物中分离出的酪氨酸酶在体外是以6聚体的形式存在,每个亚基分子量为71 kDa[13]。Han-Ju S(2012)[14]从油菜花中分离得到的多酚氧化酶分子量为60.4 kDa,以二聚体形式存在。甜菜根和香蕉果肉中的PPO却是单体酶[15]。
3 酶促褐变机理
酶促褐变只在多酚氧化酶、多酚类底物、氧3个条件同时具备时才可能发生。不同品种、不同成熟度的果蔬的多酚类物质含量不同,多酚氧化酶的含量、种类也不同,导致酶促褐变机制不同。图5所示为Gerdemann C等[6]在前人研究的基础上提出的酶促褐变的反应机理。

图5 甲酚酶以及儿茶酚氧化酶催化反应机理Fig.5 Mechanism of cresolase and catecholase activity of TYR and/or CO.
尽管3个Cu结合区域具有相似的结构(与3个组氨酸参加相连),但是3个Cu活性却不同[16]。Chazarra等研究莴苣PPO活性发现,PPO的酶促反应呈S型曲线,反应速度与酶的纯度、底物的浓度成正比,而随着反应的进行,PPO会缓慢的变构成一个更适应于底物结合、有更高催化活性的寡聚酶[4]。Matoba Y(2006)发现多酚氧化酶的活性中心在反应过程中是变化的[17]。当邻苯二酚等底物存在时,由于其“靠近”及“定向”效应,使多肽链和底物的空间构象发生改变,相互契合,从而使底物进入活性中心,邻苯二酚基上的2个羟基与多肽链上的氨基酸残基以氢键相连,形成酶与底物的复合物,由于复合物的不稳定性,多肽链构象发生扭曲,氢键断裂,H被附着在多肽链上,酶与底物不再契合,两者都同时发生构象转变,于是产物脱离了活性部位,成为邻醌。邻醌可发生一系列次生氧化作用,形成了多种氧化产物。酶再通过脱氢作用,发生构象回转,恢复以前的天然构象,重新成为具有催化能力的蛋白质[15]。而且多酚氧化酶可与离子形成配体,从而对其活性产生影响。
国内外有关褐变机理主要3种假说:酚酶区域分布假说、自由基伤害假说、保护酶系统假说。目前国内外比较接受的是酚、酚酶的区域性分布假说。
3.1 酚酶区域分布假说
PPO在组织细胞内存在2种形式,一种呈游离态(FPPO)存在于细胞质中,具有催化活性;一种呈结合态(BPPO)束缚于细胞膜上。一旦细胞膜结构破坏发生变化后,BPPO便游离出来,向FPPO转化,FPPO活性显著提高,表现PPO和酚类物质的区催化活性[18]。切分、高温等胁迫条件引起膜系统的破坏,从而打破了区域化分布,使酶和底物相互接触而引起果蔬褐变[19]。褐变多发生在较浅色的水果和蔬菜中,如苹果、香蕉、杏、樱桃、葡萄、梨、桃、草莓和土豆等,在组织损伤、削皮、切开时,细胞膜破裂,相应的酚类底物与酶接触,在有氧情况下,发生酶促褐变。通常PPO是以非活性态存在于类囊体中,而它的酚底物在液泡中,这种空间隔离只有被打破,PPO才表现出酶活性[4]。Mishra BB(2012)[20]利用扫描电镜和荧光显微镜证实了这一点。
3.2 自由基伤害假说
自由基袭击生物大分子和膜脂,会导致膜脂过氧化加剧,膜系统结构和功能的破坏,膜透性增大,进而导致代谢障碍和膜系统的破坏和解体。正常情况下,由于机体内存在防御系统,故自由基代谢保持平衡。但在干旱、高盐分、SO2、O3、低温或水分亏缺时,由于自由基产生过多,此时活性氧的产生和清除平衡体系被打破,会导致植物细胞受到伤害,从而引起褐变的发生[21]。
3.3 保护酶系统假说
通常情况下,植物组织中有较高的还原势,正常的氧化还原代谢平衡使氧化形成的醌类物质通过还原氧化或转化而未聚和。保护酶系统包括2类物质:一是氧化酶系统,主要有超氧化歧化酶、过氧化物酶、过氧化氢酶、谷胱甘肽过氧化物酶等,它们可以清除自由基、活性氧,以防止其对细胞膜的攻击,防止膜脂过氧化;二是抗氧化酶系统,主要有谷胱甘肽还原酶、抗坏血酸、VE,类胡萝卜素、细胞色素f等,它们能清除自由基和活性氧,也可以作为抗氧化剂,对酚类物质的氧化起抑制作用。在逆境下,超氧化物歧化酶、过氧化物酶、过氧化氢酶三者作用失调,导致H2O2积累,从而引起褐变的发生[22]。
4 影响褐变差异的因素
4.1 PPO基因家族差异性
PPO由多个基因编码,表现出多基因家族性,有4个~8个基因[23-25]。但Dry和Robinson却发现在葡萄藤中只存在一种PPO基因[1]。Shetty SM(2011)[24]发现即使在同一个物种中PPO基因也存在很多个亚型。茄子中有6个PPO基因家族(PPO1-6)。Mishra BB(2013)[26]发现在8中茄子品种中有36个相似的氨基酸残基。番茄有7个编码PPO的核基因(PPOA、A′、B、C、D、E、F),串连分布于8号染色体2.2 cM(约1 650 kb)的区域内,其中PPOE、F,PPOB、D、A集中分布在12.4 kb的区域[27]。马铃薯的P1和P22个PPO基因定位在8号染色体分子标记CD60与TG216之间。Winters A(2009)[28]发现红三叶草中存在至少有6个基因组,其中的3个基因组具有高度同源性。CaiY(2013)[29]研究发现2个基因型(BTx623和HN16)的高粱中存在8个不同的基因组SbPPO1–SbPPO8。这8个基因型定位在高粱的第3染色体(SbPPO1和SbPPO2),第6染色体(SbPPO3,SbPPO4),第7染色体(SbPPO5-SbPPO7),及第10染色体(SbPPO8)上,并且分别包含0个(SbPPO6-SbPPO8),1个(SbPPO1,SbPPO2,SbPPO5)及2个(SbPPO3,SbPPO4)内含子。
4.2 PPO基因表达的差异性
多酚氧化酶能化酚类化合物选择性的羟基化生成邻苯二酚并进一步氧化脱氢生成邻苯醌。醌类物质是合成某些重要生物物质的中间体,如动物的黑色素(melanin)、植物的木多糖及昆虫的壳硬蛋白等,与植物的自我保护系统相关。Bhonwong A(2009)[33]发现番茄的PPOs主要分布于番茄的根、茎、叶、花等幼嫩易受出现病害易受到虫咬的部位。植物中多酚氧化酶基因存在2类,一类是常规表达的基因,另一类则只在有诱因,如环境胁迫、病原体侵入、动物啃食、受到损害等诱导时表达,表达后多酚氧化酶可生成黑色素,更有效的抵挡外界的不利因素的侵害。
PPO基因的表达比较复杂。不同种植物、同一植物体的不同部位及同一部位的PPO多基因家族表达的种类及表达的量都不同[4,6]。Mishra BB(2013)[26]研究了8种茄子的多酚氧化酶活性,发现其多酚氧化酶各不相同。杏果实PPO的前体Mr为67.1 kDa,成熟PPO的Mr为56.2kDa;葡萄浆果PPO前体的Mr为67kDa,成熟PPO的Mr为40 kDa;番茄中PPO前体的Mr约为67 kDa,成熟的PPOMr为57 kDa~62 kDa;菠菜叶PPO的前体Mr为64 kDa,成熟PPO的Mr为42.5 kDa[15]。苹果中PPODNA经克隆并在E.coli中表达,发现PPO含有一段转运蛋白,成熟Mr为56 kDa。虽然用抗体可在E.coli中检测到PPO的表达,却检测不到酶活[1]。
在植物不同生长期间,PPO表达也存在差异。在苹果开花期间存在2种不同的基因表达,一种只在开花后表达。但是两种基因氨基酸序列存在55%的一致性。Bhonwong A(2009)[30]报道在成熟的苹果中存在两种PPO蛋白:APO5和MD-PPO2。2种蛋白分别由504和493氨基酸残基组成,预测分子量为56.3、55.4 kDa。在咖啡的种子和叶子中,以及寄生植物菟丝子中,白菜中均发现存在2种不同的PPO[1]。
同一品种植物PPO的同工酶也存在差异。侯召华(2007)[31]报告不同品种苹果的PPO同工酶酶带不同,富士酶带数最多,有4条酶带(El,E2,E3,E4),高酸苹果45号和54号只有1条共有酶带。E3和E4为富士所特有的酶带。
4.3 PPO催化特性的差异
因品种、产地等的不同,PPO酶学特性也大不相同。PPO作用的底物有儿茶酚、花色素、绿原酸、咖啡酸、黄酮醇等。研究者对不同品种的苹果PPO活性做了大量研究分析。田兰兰等(2011)[32]以富士苹果为原料,从中提取多酚氧化酶粗提液,通过底物筛选,从不同的pH、温度和抗氧化剂对PPO酶的影响等方面进行研究。结果表明,PPO酶对4种底物催化活性不同,由高到低的顺序依次为:邻苯二酚,DL-半胱氨酸,苯甲酸,山梨酸;PPO酶的最适pH为5.0,最适温度30℃,最佳酶浓度0.25mol/L,最佳底物浓度0.6mol/L;当VC浓度达到150mmol/L,90%的PPO酶活性被抑制。王琼波等(2011)[33]从嘎拉苹果中提取多酚氧化酶(PPO),对其最适反应pH、最适反应温度、热稳定性进行研究,结果表明:嘎拉苹果PPO的最适反应pH值为6.0,最适反应温度是45℃,在80、90、100℃分别处理280、240、200 s时完全失活。Palma-Orozco G(2011)[34]从马曼果中分离出2种同工酶:PPO1和PPO2,分子量分别为16.1和18 kDa,且电泳结果表明其为单聚体。PPO1最适pH为7,最适温度是35℃。Rahman ANF(2012)[35]从花椰菜中分离出一种多酚氧化酶,其氧化间苯三酚的Km为3.3mM,最适pH 8.0,且在pH 3.0~11.0范围内可稳定20 h。最适温度为55℃。Han-Ju S(2012)[14]从油菜花中分离出的多酚氧化酶最适pH 5.5,且在pH 3.5~5.5较为稳定。在60℃~70℃之间活性较为稳定,在80℃~90℃之间易失活。
5 展望
尽管前人已做了大量的工作,至今仍有许多问题不清楚,如PPO的底物特异性是否更强(与现有结果相比);PPO的亚细胞定位;PPO活性与前体的酶解的联系,其激活机制;Cu2+是否与PPO前体和中间体结合,是否参与了PPO的转运;在催化反应中活性中心的Cu2+是否变价及其在生物方面的功能等,这些都是今后将要深入研究的方向。通过对PPO结构及基因的进一步研究,在特定的器官和组织中选择调节PPO表达,使PPO对植物体可消费部分褐变的影响降至最低,在植物体其他部分大量表达PPO基因减少食草类的侵害,通过转基因的方法来调节PPO基因的表达将是未来研究热点。
[1]Mayer AM.Polyphenol oxidases in plants and fungi:going places A review[J].Phytochemistry,2006,67:2318-2331
[2]Aniszewski T,Lieberei R,Gulewicz K.Research on catecholases, laccases and cresolases in plants.Recent progress and future needs [J].Acta Biologica Cracoviensia Series Botanica,2008,50:7-18
[3]Mitra M,Maji AK,Ghosh BK,et al.Catecholase activity of a structurally characterized dinuclear iron(III)complex[FeIII2(L)2][H3L= N,N′-bis(3-methoxysalicylaldimine)-1,3-diaminopropan-2-ol][J]. Polyhedron,2014,67:19-26
[4]王曼玲,胡中立,周明全,等.植物多酚氧化酶的研究进展[J].植物学通报,2005,22(2):215-222
[5]Sommer A,Ne’eman E,Steffens JC,et al.Import,targeting and processing of a plant polyphenol oxidase[J].Plant Physiology,1994,105:1301-1311
[6]Gerdemann C,Eicken C,Krebs B.The Crystal Structure of Catechol Oxidase:New Insight into the Function of Type-3 Copper Proteins [J].Accounts of chemical research,2002,35(3):183-191
[7]Kim JY,Seo YS,Kim JE,et al.Two polyphenol oxidases are differentially expressed during vegetative and reproductive development and in response tow ounding in the Fuji apple[J].Plant Science,2001, 161:1145-1152
[8]Marusek CM,Trobaugh NM,Flurkey WH,et al.Comparative analysis of polyphenol oxidase from plant and fungal species[J].Journal of Inorganic Biochemistry,2006,100:108-123
[9]Decker H,Tuczek F.Tyrosinase/catecholoxidase activity of hemocyanins:structural basis and molecular mechanism[J].Trends in biochemical sciences,2000,25(8):392-397
[10]彭益强,邓峰,刘宇,等.富士苹果中多酚氧化酶活性的中心必需基团与抑制动力学 [J].华侨大学学报:自然科学版,2012,33(1):51-54
[11]Hernández-Romero D,Sanchez-Amat A,Solano F.A tyrosinase with an abnormally high tyrosine hydroxylase/dopa oxidase ratio Role of the seventh histidine and accessibility to the active site[J]. FEBS Journal,2006,273(2):257-270
[12]Eicken C,Krebs B,Sacchettini JC.Catechol oxidase- structure and activity[J].Current Opinion in Structural Biology,1999,9(6):677-683
[13]Jaenicke E,Decker H.Tyrosinases from crustaceans form hexamers [J].Biochemical Journal,2003,371:515-523
[14]Sun HJ,Wang J,Tao XM,et al.Purification and Characterization of Polyphenol Oxidase from Rape Flower[J].Journal of Agricultural and Food Chemistry,2012,60(3):823-829
[15]王媛媛.HPCD钝化PPO动力学比较与结构分析[D].北京:中国农业大学,2009
[16]Mandal S,Mukherjee J,Lloret F,et al.Modeling Tyrosinase and Catecholase Activity Using New m-Xylyl Based Ligands with Bidentate Alkylamine Terminal Coordination[J].Inorganic Chemistry,2012,51:13148-13161
[17]Matoba Y,Kumagai T,Yamamoto A,et al.Crystallographic Evi-dence That the Dinuclear Copper Center of Tyrosinase Is Flexible during Catalysis[J].Journal of Biological Chemistry,2006,281(13):8981-8990
[18]弓志青,王文亮.果蔬采后酶促褐变机理及影响褐变的因素研究进展[J].中国食物与营养,2012,18(2):30-33
[19]Shimizu MM,Melo GA,Brombini dos Santos A,et al.Enzyme characterization,isolation and cDNA cloning of polyphenol oxidases in the hearts of palm of three commercially important species[J].Plant Physiology Biochemistry,2011,49:970-977
[20]Mishra BB,Gautam S,Sharma A.Browning of fresh-cut eggplant:Impact of cutting and storage[J].Postharvest Biology and Technology,2012,67:44-51
[21]孙芝杨,钱建亚.果蔬酶促褐变机理及酶促褐变抑制研究进展[J].中国食物与营养,2007,3:22-24
[22]乔方,黄晓钰,余海虎.果蔬酶促褐变机理及抑制方法研究进展[J].安徽农业科学,2007,35(24):7407.
[23]Beecher B,Skinner D.Molecular cloning and expression analysis of multiple polyphenol oxidase genes in developing wheat(Triticum aestivum)kernels[J].Journal of cereal science,2011,53:371-378
[24]Shetty SM,Chandrashekar A,Venkatesh YP.Eggplant polyphenol oxidase multigene family:cloning,phylogeny,expression analyses and immunolocalization in response to wounding[J].Phytochemistry, 2011,72:2275-2287
[25]Arias DG,Doria CMM,Ramos LR,etal.Molecular characterization of the polyphenol oxidase gene in lulo (Solanum quitoense Lam.) var.Castilla[J].Brazilian Journal of Plant Physiology,2012,24(4):261-272
[26]Mishra BB,Gautam S,Sharma A.Free phenolics and polyphenol oxidase (PPO):The factors affecting post-cut browning in eggplant (Solanum melongena)[J].Food Chemistry,2013,139(1/4):105-114
[27]Thipyapong P,Joel DM,Steffens JC.Differential expression and turnover of the tomato polyphenol oxidase gene family during vegetative and reproductive development[J].Plant Physiology,1997,113 (3):707-718
[28]Winters A,Heywood S,Farrar K,et al.Identification of an extensive gene cluster among a family of PPOs in Trifolium pretense L.(red clover)usinga large insert BAC library[J].BMC Plant Biology,2009, 9:94
[29]Cai Y,Dong Z,Zhao S,et al,Chen Y.Genome-Wide Analysis of Polyphenol Oxidase Genes and Their Transcriptional Patterns during Grain Development in Sorghum[J].International Journal of Plant Sciences,2013,174(4)
[30]Bhonwong A,Stout MJ,Attajarusit J,et al.Defensive role of tomato polyphenol oxidases against cotton bollworm(Helicoverpa armigera) and beet army worm (S podoptera exigua)[J].Journal of Chemical E-cology,2009,35:28-38
[31]侯召华.高酸苹果浓缩汁褐变影响因素的研究[D].青岛:青岛农业大学,2007
[32]田兰兰,郭玉蓉,牛鹏飞,等.富士苹果中多酚氧化酶特性的研究[J].农产品加工·学刊,2011,3:20-24
[33]王琼波,陈琦,冯金丹.嘎拉苹果多酚氧化酶性质及其抑制方法研究[J].河南农业科学,2011,40(6):118-121
[34]Palma- Orozco G,Ortiz-Moreno A,Dorantes-lvarez L,et al.Purification and partial biochemical characterization of polyphenol oxidase from mamey(Pouteria sapota)[J].Phytochemistry,2011,72(1):82-88
[35]Rahman ANF,Ohta M,Nakatani K,et al.Purification and Characterization of Polyphenol Oxidase from Cauliflower(Brassica oleracea L.)[J].Journal of Agricultural and Food Chemistry,2012,60(14):3673-3678
Advances in Research of the Structure and Browning Mechanism of Polyphenol Oxidase
LIU Fang,ZHAO Jin-hong,ZHU Ming-hui,GAN Zhi-lin,NI Yuan-ying*
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing100083,Chian)
Polyphenol oxidases(PPO,EC.1.10.3.1),found in bacteria,fungi and plants,belongs to the class of type 3 copper proteins that catalyze the oxidation of o-diphenols(catechols)to the corresponding o-quinones in the presence of oxygen.o-Quinones will then undergo spontaneous polymerization,which produces melanin,the pigment with high molecular weight and dark in color.It is believed to be the primary response for the deleterious browning of many fruits and vegetables.Although lots of research on the properties and the inhibition of its activity has been done,its structure(especially the structure of the active center)and the mechanism of browning was unclear.The present review attempts to highlight the recent advances in research of the structure and the mechanism of browning.
polyphenol oxidase;browning;structure;the active center;mechanism
10.3969/j.issn.1005-6521.2015.06.032
2013-10-24
“十二五”国家科技支撑计划项目(2012BAD31B00)
刘芳(1984—),女(汉),博士,研究方向:苹果浆褐变机理及分子调控。
*通信作者:倪元颖(1960—),女(汉),教授,主要从事果蔬加工天然产物提取、功能食品开发。
