燕麦分离蛋白疏水性及起泡性研究
2015-12-17田斌强邓乾春黄娟谢笔钧
田斌强,邓乾春,黄娟,谢笔钧
(1.河南农业大学烟草学院,河南郑州450002;2.华中农业大学食品科技学院,湖北武汉430070;3.中国农业科学院油料作物研究所,湖北武汉430062)
燕麦分离蛋白疏水性及起泡性研究
田斌强1,2,邓乾春3,黄娟2,谢笔钧2
(1.河南农业大学烟草学院,河南郑州450002;2.华中农业大学食品科技学院,湖北武汉430070;3.中国农业科学院油料作物研究所,湖北武汉430062)
采用碱提酸沉法从脱脂燕麦粉中提取得到了蛋白含量为93.01%的分离蛋白(OPI),分析其氨基酸组成,并用ANS荧光探针法研究pH、NaCl、蔗糖、CaCl2、AlCl3和尿素对燕麦分离蛋白疏水性和起泡性的影响。结果表明,OPI氨基酸组成接近FAO/WHO理想模式,pH对燕麦分离蛋白疏水性的影响最大,pH 2时疏水性最强,且酸性环境下的疏水性远远超过碱性环境。不同盐离子对蛋白疏水性的影响程度和趋势不一样,随AlCl3和尿素浓度增加,OPI疏水性减弱;而CaCl2和蔗糖浓度升高时蛋白疏水性增强。NaCl在低浓度(<0.6mol/L)时蛋白疏水性减弱,高浓度时蛋白疏水性增强。不同因素对OPI起泡性也具有较大的影响,其变化趋势与疏水性较为一致。另外,蔗糖的加入可提高OPI的起泡稳定性,而加入NaCl对其有所降低。
燕麦;分离蛋白;疏水性;ANS;起泡性
不同燕麦品种中蛋白质含量最高可达17.92%,最低为8.71%,多数在10%~15%之间[1]。燕麦蛋白是一种低过敏性的优质植物蛋白,已被应用于冷冻甜点、饮料、防晒霜、面膜、沐浴液、洗发水等产品当中[2]。关于燕麦蛋白研究主要涉及燕麦分离蛋白和浓缩蛋白的提取、成分分析、物化性质、功能性质和营养价值,尤其是化学和酶法改性后功能性质的变化情况[3-6]。由于球蛋白是燕麦总蛋白中的主要成分,含量高达70%以上,因此也有不少球蛋白的研究报道,比如已有学者通过凝胶过滤、电泳、元二色谱、差示扫描量热、紫外、荧光、拉曼光谱等手段对燕麦球蛋白性质与结构进行了表征[7-9]。国内直到近些年才有相关文献出现,目前的研究内容主要集中在燕麦麸皮蛋白的提取及功能性质研究方面[10]。
由于大多数食品或化妆品都是含水体系,所以,有必要了解燕麦蛋白在应用环境下一些相关特性的变化规律。水溶液中蛋白的疏水性是影响其在许多领域中可应用性的重要因素之一,目前为止鲜见有关燕麦蛋白疏水性研究的文献报道。荧光探针法测定蛋白的表面疏水性操作简单快速,是目前使用最广泛的方法。本文通过ANS荧光探针法研究燕麦分离蛋白表面疏水性和起泡性,为燕麦分离蛋白应用于实际生产提供一定的理论基础。
1 材料和方法
1.1 材料、试剂与仪器
燕麦:山西省农科院高寒植物研究所李刚研究员提供的晋燕八号裸燕麦;考马斯亮蓝试剂盒:南京建成生物工程研究所(批号20070329);8-苯胺基-1-萘磺酸铵:ANS,Sigma公司;实验所用其他试剂为分析纯,水为去离子水;所用主要仪器有均质机:(PT2100,Kinematic AG);离心机:(SCR20BC,日立公司);荧光分光光度计:(960MC,上海精科仪器有限公司)。
1.2 燕麦与其分离蛋白提取
燕麦分离蛋白(OPI)的提取参考文献[4]方法。OPI的得率用冷冻干燥后所得粉末的重量与原燕麦粉重量的比值表示。
1.3 蛋白质含量测定与氨基酸分析
原燕麦分和分离蛋白质中的蛋白质含量测定采用微量凯氏定氮法(换算系数6.25)。在疏水性测定中蛋白浓度用考马斯亮蓝试剂盒测定,操作步骤按照试剂盒说明书进行。燕麦蛋白氨基酸组成分析参考文献[11]进行。
1.4 燕麦分离蛋白质疏水性和起泡性的测定
燕麦分离蛋白质疏水性采用王文高[12]的方法,起泡性的测定采用Xiao[10]的方法。
2 结果及讨论
2.1 燕麦分离蛋白氨基酸分析
经分析所用晋燕八号燕麦的蛋白含量为17.52%,分离蛋白得率为11.32%,分离蛋白的蛋白含量为93.01%。

表1 燕麦分离蛋白氨基酸组成Table1 Amino acid composition of oat protein isolates(g氨基酸/100 g蛋白)
从表1可知,本实验提取的燕麦分离蛋白其氨基酸各组分含量与Hinoat燕麦浓缩蛋白相当,必需氨基酸含量为28.37%(色氨酸没有测定),接近FAO/WHO理想模式的35%,赖氨酸为第一限制性氨基酸,蛋氨酸为第二限制性氨基酸。OPI中疏水性氨基酸含量为33.54%,高于大豆分离蛋白的23.9%,可推测燕麦分离蛋白有比大豆分离蛋白较好的疏水性。
2.2 燕麦分离蛋白疏水性
2.2.1 pH对疏水性的影响
如图1a所示,pH为2时,OPI的疏水性(S0)最强;当pH从2增至4时,S0急剧下降,直至pH6.0时降至最低,随后随pH增大分离蛋白疏水强度呈缓慢增长趋势。这是因为在偏离等电点较远时,OPI的溶解性较好,溶于缓冲液中的蛋白较多,从而总的暴露表面疏水区也相应增多;而在pI附近,OPI溶解性最低,因此有效蛋白浓度也减小。
2.2.2 盐对OPI疏水性的影响
本实验分别测定了0.2 mol/L~1.0 mol/L NaCl、CaCl2和AlCl3溶解的OPI的疏水性,结果见图1b、1c和1d。从图1b可以看出,随着NaCl浓度的增高,疏水性值S0先下降后上升,当NaCl浓度为0.6mol/L时,S0最低。这可能是NaCl对蛋白的盐溶盐析作用,当NaCl浓度从0.2mol/L增至0.6mol/L时,蛋白净电荷增加并因此带上较厚的水化胶层,疏水性下降;但随着NaCl浓度超过0.6mol/L继续上升,因在蛋白分子表面疏水区域含有许多排列有序的水分子,而NaCl是很强的水结合剂,会将这些水分子抽出,从而暴露了疏水基团,使S0上升。

图1 不同因素对OPI的疏水性的影响Fig.1 Effects of different factors on surface hydrophobicity of OPI
CaCl2对OPI疏水性的影响如图1c所示。在整个观测浓度范围内,随着CaCl2浓度的增加S0呈上升趋势,即蛋白疏水性增加,这可能是由于Ca2+降低了非极性基团转移到水中的自由能,使蛋白去折叠趋势加强。
图1d表明有AlCl3存在时,随着AlCl3浓度的增大,疏水性呈下降趋势。这与Ca2+对OPI疏水性的影响正好相反。这可能是因为铝离子可以增大蛋白分子表面的净电荷并使之带上较厚的水化胶层,从而使暴露的疏水区域减小[13]。
盐可以干扰蛋白溶液中蛋白与带电集团和极性集团之间的相互作用,还可以通过修饰水的结构而影响蛋白质和水的疏水相互作用。对水结构的影响程度依赖于其阳离子和阴离子的本质。一般阳离子对水结构影响大小的顺序为Ca2+>Mg2+>Na+>K+。此序列中靠前的离子可以降低将非极性基团转移到水中的自由能,并弱化蛋白质分子间的疏水相互作用使蛋白去折叠趋势加强;这与上面的研究结果是一致的。
2.2.3 蔗糖对疏水性的影响
随蔗糖浓度增加OPI疏水性增加(图1e所示)。这可能是由于蔗糖分子是多羟基的,当这些-OH以氢键与蛋白分子结合时,会破坏维持蛋白分子高级结构的部分作用力,而使分子内部的部分疏水基团暴露出来,从而增大了蛋白疏水性。
2.2.4 尿素对疏水性的影响
图1f表明,随着尿素浓度的增加,疏水性值S0逐渐下降。其中,当尿素浓度从4mol/L升至6mol/L时,S0迅速下降;当尿素浓度大于6mol/L时,S0下降趋势极其缓慢。
尿素作为一种变性剂,对蛋白质分子结构具有较大程度的破坏作用,在本试验中,可能由于尿素不仅使OPI蛋白分子变性伸展,且破坏了暴露的疏水区,从而使蛋白分子的疏水性下降。
2.3 燕麦分离蛋白起泡性
2.3.1 pH对OPI起泡性的影响
pH对起泡性的影响曲线呈先下降后上升的趋势(如图2a所示),其中以pH4时,OPI的起泡能力(FA)最差。这是因为在接近pI时,溶液中溶解的蛋白较少,从而使有效蛋白量减少,因此起泡性差;而远离p I时,蛋白净电荷增多,排斥力增强,从而削弱了疏水反应,加大了蛋白分子的柔软度,而使分子更迅速的分散于空气-水界面包裹住空气颗粒,另一个原因也是由于溶解性比pI时增大了,因而起泡性得以增强[10]。
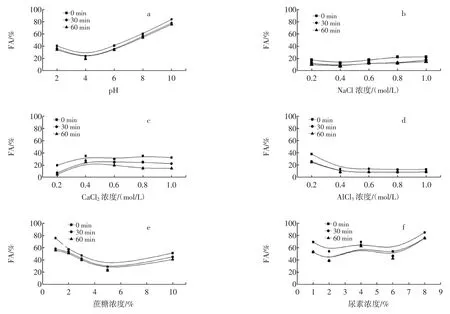
图2 不同因素对OPI起泡性的影响Fig.2 Effects of different factors on foaming ability of OPI
此外,将起泡性图与疏水性图比较可知,起泡性图是碱性pH下的起泡性好,而疏水性图则是酸性pH下的疏水性值高。这是由于在碱性条件下蛋白质的溶解度大于酸性条件,此时溶解度对起泡性的影响超过疏水性对其的影响,因此尽管疏水性值小,但由于溶液中有效蛋白浓度大大上升,所以起泡性会增高。
在各个pH环境中OPI的泡沫均较为稳定。
2.3.2 盐对OPI起泡性的影响
NaCl对OPI起泡性的影响(图2b)同疏水性图1a一样呈先降后升趋势。在NaCl浓度为0.4mol/L时,FA出现最小值。这是由于NaCl浓度小于0.4mol/L时,盐溶作用会降低FA;而大于0.4mol/L时,盐析作用中和了蛋白质电荷,而且使疏水性增大了,因此FA升高。NaCl浓度为0.8mol/L时FS最差。
如图2c所示,CaCl2浓度在0.2mol/L~1.0mol/L的范围内,FA呈上升趋势。而在0.2mol/L~0.4mol/L时,FA上升速度较快;之后则趋于平缓。
AlCl3对OPI起泡性的影响见图2d。当AlCl3浓度从0.2mol/L增至0.4mol/L时,FA急剧下降;当AlCl3浓度大于0.4mol/L时,FA变化趋势较为平缓。AlCl3高浓度时的FS要好于低浓度时的。
三种盐对OPI起泡性的影响趋势与之对疏水性的影响基本上是一致的,表明该条件下,蛋白的起泡性与其疏水性存在正相关关系。这可能是由于疏水基团有助于使蛋白迅速铺展于两相界面,从而使其起泡能力相应增强。
2.3.3 蔗糖对起泡性的影响
图2e表明,随着蔗糖浓度的升高,OPI的起泡能力先下降后上升,在蔗糖浓度为5%时达到最低值。这是因为在浓度小于5%时,随着蔗糖浓度的增大,蛋白溶液粘度增强,阻碍了蛋白分子迅速移动到空气-水界面而使起泡性降低,但随着蔗糖浓度进一步增加,OPI起泡性能力增强,这可能是由于蛋白此浓度范围内的疏水性增强所致(如图1e)。
添加蔗糖后的OPI溶液起泡稳定性(FS)要高于盐和尿素的FS,因为糖类物质能增大体相黏度,降低了薄片流体的脱水速率,从而可提高泡沫的稳定性[14]。
2.3.4 尿素对起泡性的影响
尿素浓度在1mol/L~8mol/L浓度范围内(如图1f),OPI的FA变化曲线类似于W形。如前所述,影响FA因素是多方面的,出现波动现象的原因可能是在不同浓度范围内,主要的影响因素发生变化所致。其具体作用机制有待于进一步的研究。高浓度时的起泡稳定性要优于低浓度时的。
3 结论
1)晋燕八号燕麦的蛋白含量为17.52%,分离蛋白得率为11.32%,分离蛋白的蛋白含量为93.01%。OPI的氨基酸组成接近FAO/WHO理想模式。赖氨酸为第一限制性氨基酸,蛋氨酸为第二限制性氨基酸。OPI中疏水性氨基酸含量为33.54%,高于大豆分离蛋白。
2)pH对燕麦分离蛋白疏水性的影响最大,不同盐离子对蛋白疏水性的影响程度和趋势不一样,随AlCl3和尿素浓度增加,OPI疏水性减弱;CaCl2和蔗糖浓度升高蛋白的疏水性增强。NaCl在低浓度时蛋白疏水性减弱高浓度时蛋白疏水性增强,这可能是由于各种盐对蛋白溶解性和分子结构的不同影响程度所导致的。不同因素对OPI起泡性的影响变化趋势与疏水性的变化较为一致。可见OPI的疏水性对其起泡能力具有较大的影响。蔗糖的加入可提高OPI的起泡稳定性,而加入NaCl则会降低起泡稳定性。
[1]龚海,李成雄,王雁丽.燕麦品种资源品质分析[J].山西农业科学, 1999,27(2):16-19
[2]马得泉,杨海鹏,田长叶.燕麦营养价值与保健食品开发[J].中国食物与营养,1997(3):16-19
[3]Ching-Yung Ma,Harwalkar.Chemical characterization and functionality assessment of oat protein fractions[J].Journal of Agriculture and Food Chemistry,1984,32(1):144-149
[4]Ching-Yung Ma,Khanzada.Functional properties of deamidated oat protein isolates[J].Journal of Food Science,1987,52(6):1583-1587
[5]Gilles Goulet,Rathy Ponnampalam,Jean Amiot,et al.Nutritional value of acylated oat protein concentrates[J].Journal of Agriculture and Food Chemistry,1987,35(4):589-592
[6]Rathy Ponnampalam,Gilles Goulet,Jean Amiot,et al.Germain J. Brisson.Some functional and nutritional properties of oat flours as affected by proteolysis[J].Journal of Agriculture and Food Chemistry, 1987,35(2):279-285
[7]Ching-Yung Ma,Harwalkar.Thermal coagulation of oat globulin[J]. Journal of Cereal Chemistry,1987,64(4):212-218
[8]Harwalkar,Ching-Yung Ma.Study of thermal properties of oat globulin by differential scanning calorimetry[J].Journal of Food Science, 1987,52(2):394-398
[9]Ching-Yung Ma,Harwalkar.Study of thermal denaturation of oat globulin by ultraviolet and fluorescence spectrophotometry[J].Journal of Agriculture and Food Chemistry,1988,36(1):155-160
[10]Xiao Guan.Some functional properties of oat bran protein concentrate modified by trypsin[J].Journal of Food Chemistry,2006,101 (1):163-170
[11]Ching-Yung Ma.Chemical characterization and functionality assessment of protein concentrates from oats[J].Journal of Cereal Chemistry,1983,60(1):36-42
[12]王文高.早籼稻及碎米转化为低过敏性蛋白和缓解淀粉的研究——低过敏性大米蛋白质的研究[D].无锡:江南大学.2002:31-34
[13]董元彦.无机及分析化学[M].北京:科学出版社,2000:58-59,304-318
[14]谢笔钧.食品化学[M].2版.北京:科学出版社,2004:211-301
Surface Hydrophobicity and Foaming Ability of Oat Protein Isolates
TIAN Bin-qiang1,2,DENG Qian-chun3,HUANG Juan2,XIEBi-jun2
(1.College of Tobacco Science,Henan Agricultural University,Zhengzhou 450002,Henan,China;2.College of Food Science&Technology,Huazhong Agricultural University,Wuhan 430070,Hubei,China;3.Oil Crops Research Institute,Chinese Academy of Agricultral Sciences,Wuhan 430062,Hubei,China)
Oat protein isolates (OPI)were prepared by alkali extraction and isoelectric precipitation from defatted oat groats.OPI contains93.01%protein.The amino acid composition of the isolates was analyzed,and found that OPI has more hydrophobic amino acids than soy protein isolates and the amino acids composition of OPI is close to the ideal model recommended by FAO/WHO.The hydrophobicity and the isolates were measured using ANS fluorescent probe method at various pH and different concentration solution with NaCl,sucrose,CaCl2,AlCl3and urea.The foaming ability of OPI was investigated at the same condition.The results showed that pH had the highest influence on the surface hydrophobicity of OPI and the hydrophobicity reaches its peak at pH2;the hydrophobicity of OPI atacid pH was much stronger than that at alkali pH.The trend of effect of different salts on protein hydrophobicity was not same.With AlCl3and urea concentration increased,the OPI hydrophobicity decreased,but CaCl2and sucrose was on the contrary.The hydrophobicity decreased in NaCl solution with low concentrations (<0.6 mol/L)while hydrophobicity enhanced with concentration rising. Different factors had great influence on OPI foaming,the trend was consistent with the hydrophobic.In addition,the addition of sucrose can improve foaming stability of OPI,and the accession to the NaCl reduced it.
oat;protein isolates;surface hydrophobicity;ANS;foaming ablity
10.3969/j.issn.1005-6521.2015.06.001
2014-01-06
“十一五”国家科技支撑计划项目(2006BAD27B09)
田斌强(1976—),男(汉),讲师,博士,研究方向:天然产物化学。
