盐酸克伦特罗酶标抗原的制备及鉴定
2015-12-17黄晨吴冬雪王禹张俊哲柴铭骏董志珍赵祥平
黄晨,吴冬雪,王禹,张俊哲,柴铭骏,董志珍,赵祥平
(天津出入境检验检疫局动植物与食品检测中心,天津300461)
盐酸克伦特罗酶标抗原的制备及鉴定
黄晨,吴冬雪,王禹,张俊哲,柴铭骏,董志珍,赵祥平
(天津出入境检验检疫局动植物与食品检测中心,天津300461)
选取辣根过氧化物为抗原标记酶,采用重氮化法将盐酸克伦特罗CLEN分别与牛血清蛋白(BSA)、卵清蛋白(OVA)偶联,合成包被抗原和免疫原,并通过紫外光谱扫描(UV)、SDS聚丙烯酞胺凝胶电泳法验证偶联成功。这为下一步获得针对盐酸克伦特罗类特异性单克隆抗体制备及其相应食品安全检测试剂盒开发奠定了基础。
盐酸克伦特罗;重氮化法;ELISA
盐酸克伦特罗(clenbuterol,CLEN)俗称瘦肉精,化学名称为羟甲叔丁肾上腺素,是β-肾上腺素受体激动剂(简称β-激动剂)的一种,曾作为生长促进剂在畜牧业中应用,长期使用后,在动物体内形成积累性残留[1],人食用残留该物的肉品就会引起神经过敏、心跳过速等急性中毒症状[2],因此该药物被我国明令禁止使用[3]。但因其能有效地促进蛋白质合成和肌肉组织生长,减少脂肪尤其是皮下脂肪的沉积,降低胴体脂肪含量,提高瘦肉率[4]和饲料转化率,具有一定的经济效益。因此,一些不法分子不顾消费者的健康安全,仍将其利用于畜牧生产中[5]。我国农业部1997年3月[农牧发(1997)]3号文严令禁止β-激动剂在动物生产中的应用,农业部176号公告《禁止在饲料和动物饮水中使用的药物品种目录》规定了β-激动剂类不能在饲料和饮水中使用,中华人民共和国农业部第193号公告中将盐酸克伦特罗列为违禁药品。CLEN在我国的非法使用屡禁不绝,从2000年~2001年浙江和广东等地有近2000多人因食用含有CLEN残留的动物性食品而出现中毒,这不仅直接影响了我国在畜产品上出口的竞争力,而且也严重威胁到人民的健康安全。建立有效的残留监督检测体系、提高人们对CLEN中毒危害的认识是治理其非法使用的有效措施。为了配合、贯彻执行我国政府的禁令,深入了解盐酸克伦特罗在动物体内的代谢、吸收、残留消除特点及其检测方法具有重要意义。
目前,针对盐酸克伦特罗的检测方法主要有化学分析法、色谱技术、毛细管电泳、免疫分析技术和生物传感器技术[6]。盐酸克伦特罗是一种半抗原,只有通过和其他分子量较大的载体蛋白偶联以后才能作为免疫原,并借助载体蛋白的T细胞表位产生特异性抗体,所以盐酸克伦特罗人工抗原合成是ELISA检测技术的关键[7]。
1 材料与方法
1.1 仪器与试剂
1.1.1 试剂
盐酸克伦特罗纯度高于99%;辣根过氧化物酶(HRP),为上海东风生物科技有限公司产品;NaIO4、(1∶100)乙二醇溶液、硼氢化钠(NaBH4/NaBH3CN)、亚硝酸钠、盐酸等,均为分析纯;牛血清白蛋白(BSA)、鸡蛋白蛋白(OVA);试验用水为双蒸去离子水。
1.1.2 仪器
天平(上海精科);酶标仪(BIO-TEK);双重水蒸馏器(华奥);磁力恒温搅拌器(上海司乐);紫外扫描仪(岛津);可见分光光度计(精科);摇床;电泳仪(Biochrom)。
1.2 方法
1.2.1 酶结合物的制备
酶结合物的制备是以过碘酸钠法将HRP(辣根过氧化物酶)同抗盐酸克伦特罗抗体的抗体(二抗)结合[8]。HRP经NaIO4氧化后形成的醛化酶可与抗体分子的氨基相连,形成斯夫氏硷,然后再与二抗上的氨基相结合形成酶结合物(酶标记物)。该方法所获酶结合物的产率高,酶与二抗的活性无重大损失,是目前最常用的方法。
标记流程:
1)HRP 10mg加水1mL,10mg/mL,混匀。
2)加新配过碘酸钠(0.06mol/L)1mL,混匀,4℃,30min,避光,呈黑绿色。
3)加入0.16mol/L(1∶100)乙二醇溶液1mL,20℃~25℃30min,避光,呈棕色。
4)加入二抗10mg,装入透稀袋中,搅拌结合或不搅拌,(抗体事先用0.05mol/L pH9.6 CB液平衡)用0.05mol/L pH9.6CB液1 000mL透稀,过夜,使抗体与酶充分结合,中间换液一次。
5)取出透析袋,向袋内加入硼氢化钠(NaBH4/NaBH3CN)0.4mL,混匀,4℃,2 h。
6)透稀除盐,0.02mol/LPBSpH7.2。
7)加入优质甘油50%保存酶结合物。
1.2.2 重氮法制备CLEN-BSA偶联蛋白质
免疫原和包被原的制备原理简述:盐酸克伦特罗为小分子化合物,仅具有反应原性而缺乏免疫原性,属半抗原。半抗原与载体蛋白偶联形成的偶合物,不仅具有免疫原性,而且有其本身特异的反应原性。将盐酸克伦特罗抗原与载体蛋白BSA/OVA,通过重氮法使CLEN与BSA/OVA偶联合成免疫抗原CLENENOVA和包被原CLENEN-BSA,才能刺激机体产生抗体,其具体合成路线如下[9]。
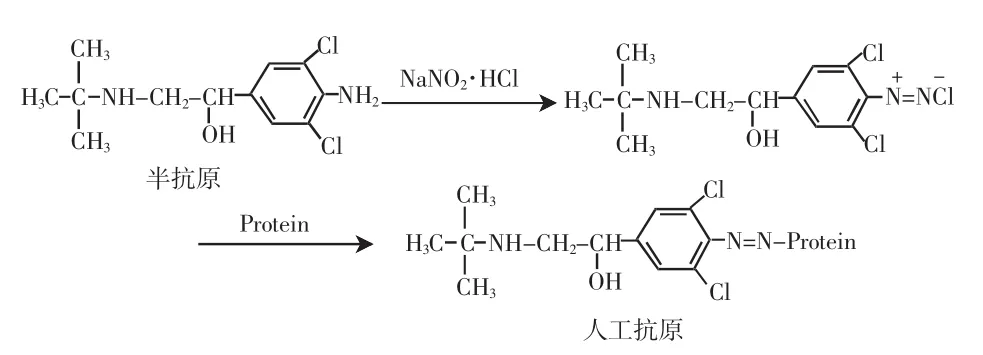
1)CLEN的偶氮化[10-13]
从10mg/mlCLEN贮备液中取5mL液体于试管中,用1.0mol/LHCI盐酸调至pH2.5,置于冰箱内,另从亚硝酸钠贮备液中取2.0m l液体放冰箱内,待以上两液体预冷至4℃后,在4℃阴暗避光的环境下将亚硝酸钠溶液逐滴加入CLEN溶液中,边加边摇动,加完后置于4℃冰箱阴暗处孵育lh,取出滴加2~3滴氨基磺酸盐溶液,除去游离的亚硝酸钠,以上操作均在4℃阴暗环境下进行,最后量出溶液体积,计算溶液中CLEN的浓度。
2)偶氮化CLEN与载体蛋白的偶联
将在预冷的盐酸和亚硝酸钠溶液中偶氮化后的CLEN,按20∶1摩尔比例,慢慢滴入BSA溶液,加完后用0.25mol/mLNaoH调至pH7.5,并在4℃冰箱阴暗处孵育24 h。随后将其在4℃冰箱中用PBS(0.01mol/L,pH.7.2)连续透析7 d,期间多次换液,最后冷冻干燥保存。
同法合成CLEN-OVA。
1.2.3 CLEN-BSA免疫原的鉴定
1)紫外分光光度计法
用生理盐水精确配制CLEN与BSA的标准溶液。称取一定量的CLEN-BSA溶于生理盐水中,用Broaford法测其蛋白质的浓度。根据此浓度调整CLEN-BSA溶液中蛋白质的浓度使其与BSA一致。用Uv3000紫外扫描仪,在波长为(200 nm~360 nm)的范围内分别进行扫描。代入参考文献[14]公式,计算出CLEN-BSA的偶联率。
2)SDS聚丙烯酞胺凝胶电泳法[14-16]
其原理是蛋白质分子在凝胶中的迁移率与其分子质量成反比,分子质量越大的蛋白质分子迁移率越小[17]。
按垂直平板电泳10%凝胶配方在模具中灌注分离胶后,小心地在分离胶表面加一层水封住胶面,放置1小时后,吸掉水,灌注浓缩胶,插入适当的梳子放置1小时后拆去梳子备用,选择CLEN-BSA作为鉴定样品,从1mg/mL的CLEN-BSA溶液中吸取1μL加入等量的样品缓冲液,100℃水浴30min后加样,同时以BSA作为对照进行电泳,电泳结束后,用考马斯亮蓝染色,用脱色液在脱色摇床上脱色,最后照相分析结果。
3)间接ELISA法鉴定
将CLEN-BSA稀释成一定的浓度,0.1、0.5、1、5、10μg/mL,100μL/孔,4℃过夜,将1%BSA+10%sucrose封闭液加入酶标板,100μL/孔,37℃温育2 h,将孔内液体甩干,用吸水纸拍干。加入倍比稀释的抗CLEN单克隆抗体,抗体稀释比例为1∶1 k、1∶5 k、1∶10 k、1∶50 k、1∶100 k,25℃避光环境中反应30min,加入100μL每孔显色液3,3′,5,5′-四甲基联苯胺(TMB),15min后显色,最后每孔加入50μL浓度为2mol/L的H2SO4终止液终止反应。设定酶标仪用双波长450/630 nm检测,测定每孔OD值。以上每一步加样后,都经过多次振荡后洗涤。
2 结果与分析
2.1 紫外扫描
紫外扫描光谱结果见图1。
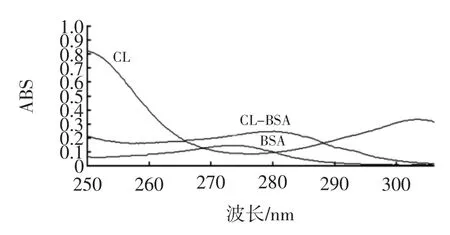
图1 CL、BSA及CLEN-BSA紫外扫描图Fig.1 Ultraviolet spectrum of CL,BSA,CLEN-BSA
由此可知,BSA、CLEN—BSA最大吸收波长都为279 nm,尽管CLEN-BSA溶液中蛋白质的浓度与BSA溶液相同,CLEN-BSA的吸光度却明显比BSA的高,同时可见CLEN—BSA的紫外吸收曲线与BSA和CLEN的紫外吸收曲线相比发生明显变化。当偶合物吸收曲线与半抗原和载体的吸收曲线不同时,可间接说明偶联成功。根据公式(1)计算得出CLEN-BSA的偶联率为17[20]。同理由CLEN、OVA偶联得CLEN-OVA紫外吸收曲线的对比可定性证明CLEN-OVA偶联成功。

2.2 SDS-PAGE电泳图分析
电泳图结果见图2,CLEN-BSA和CLEN-OVA电泳条带与BSA、OVA条带相比稍宽且有明显的滞后,说明载体蛋白连接了盐酸克伦特罗小分子,进一步证明盐酸克伦特罗与载体蛋白均偶联成功。
2.3 间接ELISA法鉴定结果
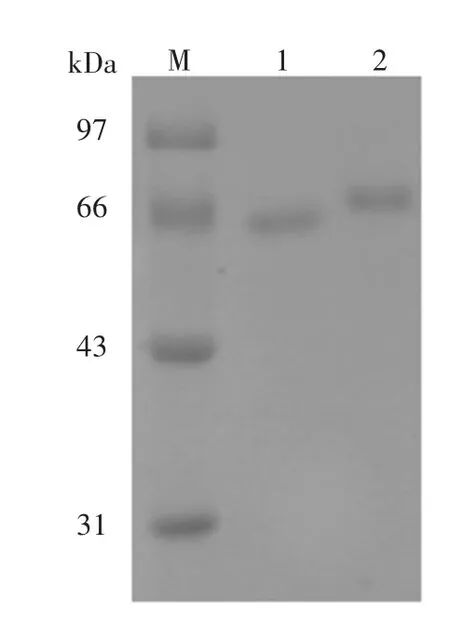
图2 SDS-PAGE电泳图Fig.2 SDS-PAGEElectrophoresis
从间接ELISA实验结果可以看到,在相同包被浓度的前提下,随着抗体稀释度增加,吸光度值变小,而相同稀释度情况下,随着包被量浓度增加,吸光度值增加,说明了CLEN-BSA免疫原的合成,具体情况见表1。
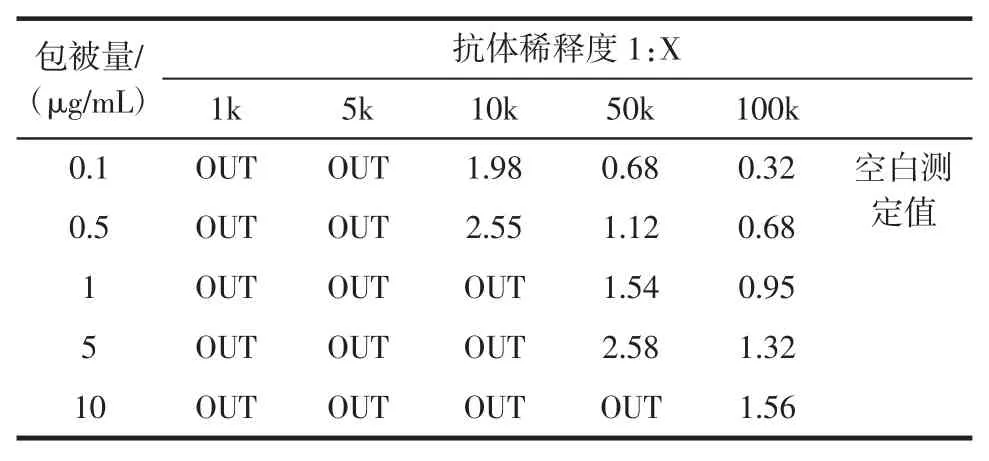
表1 间接抑制ELISA吸光度值Table1 Absorbency of indirect inhibited ELISA
3 结论
ELISA法用于动物性食品中药物残留的检测,是基于抗原抗体特异性的免疫反应与传统的色谱分析技术相比,具有选择性好,灵敏度高,操作简便,易于商品化,对操作者的专业要求比较低等优点。关于人工抗原的合成,首先由Landsteinerder提出小分子半抗原与大分子载体交联,合成完全抗原,用以研究抗原抗体反应的特异性。
通过重氮化法,合成制备了免疫原和检测原,经紫外扫描计算得到偶联比为17。CLEN-BSA与载体蛋白BSA在紫外扫描图、SDS-PAGE图上均有明显区别,能够证明CLEN与载体蛋白BSA偶联成功。间接ELISA检测证明CLEN-BSA免疫原的合成,下一步将用获得的免疫原刺激小鼠产生针对CL的抗体,为下一步的单克隆抗体的制备和ELISA试剂盒的研究提供支持。
参考文献:
[1]张彩霞,董相军.瘦肉精研究综述El1[J].养殖与饲料,2007(1):57-58
[2]王秋平,哈婧,刘硕,等.盐酸克伦特罗检测方法的研究进展[J].河北工业科技,2013(3):125-129
[3]刘国艳,柴春彦.如何全面认识“瘦肉精”[J].动物科学与动物医学,2005,19(6):1-3
[4]Mersmann H J.Overview of the effects ofβ-adrenergic receptor agonists on animal growth including mechanisms of action[J].J Anim Sci,1998,76:160-172
[5]Kuiper H A,Noordam M Y,Van Dooren- Flipsen MMH,et al.Illegal Use of β-adrenergic Agonists:European Community[J].J Anim Sci, 1998,76:195-207
[6]王选年,康晓迪.盐酸克伦特罗的残留及检测[J].动物医学进展, 2002,23(3):41-46
[7]SawayaW N,Lone K,Husain A,et al.Screening for β2-agonists in sheep urine and eyes by an enzyme—linked immuno Sorbent assay in the state of Kuwait[J].Food Control,2000,11:1-5
[8]陈曦,曹慧,徐斐,等.盐酸克伦特罗酶标抗原的制备及其ELISA检测[J].江苏农业学报,213,29(2):458-460
[9]韩森,程敬丽,马国霞,等.不同载体蛋白制备克伦特罗人工抗原的比较[J].上海畜牧兽医通讯,2006(5):23-25
[10]胥传来,王武康,贺铁明.食品中残留盐酸克伦特罗免疫原合成与鉴定[J].食品科学,2004,25(12)169-171
[11]MAO S,MAZA.Mechanization of the Bradford reaction for the spectrophotometric[J].BioChem,2006,351:155-157
[12]Yilmaz H,Tantas A,Ilgaz A.Isolation and Preparation of Monoclonal Antibody to Ovine Immuno globulin M[J].Tr J of Veterinary and Animal Sciences,1999,23:135-140
[13]赵肃清,孙远明,乐学义,等.农药人工抗原合成的研究进展[J].农药,2005,8(8):337-340
[14]杨利国,胡少昶,魏平华,等.酶免疫测定技术[M].南京:南京大学出版社,1998
[15]沈关心,周汝麟.现代免疫学实验技术[M].武汉:湖北科学技术出版社,1998:398-400
[16]朱国念,吴刚,吴慧明.有机磷杀虫剂毒死蜱人工抗原的合成与鉴定[J].中国农业科学,2003,36(6):657-662
[17]Clarke JR,Marquardt R R,Oosterveld A,et al.Development of a quantitative and sensitive enzyme-linked immunosorbent assay for ochratox in A using antibodied from the yolk of the laying hen[J].A-gric Food Chem,1993,41(10):1784-1789
[18]陈继明,龚晓明,陆承,等.免疫源蛋白与自身蛋白作为载体制备抗克伦特罗血清[J].南京农业大学学报,1998,21(3):84-88
Synthesis and Identification of Immunogen Clenbuterol
HUANG Chen,WU Dong-xue,WAN GYu,ZHANG Jun-zhe,CHAI Ming-jun,DONG Zhi-zhen,ZHAO Xiang-ping
(Animal&Plant&Foodstuffs Inspection Center,Tianjin Import&Export Inspection and Quarantine Bureau,Tianjin 300461,China)
Clenbuterol(CLEN)which was conjugated by horseradish peroxidase(HRP)was bound to bovine serum albumin(BSA)and ovalbumin(OVA)respectively by using diazotization,which aimed to synthesize artificial immunogenic antigen CLEN-BSA and artificial detection antigen CLEN-OVA.The results of UV scan,SDS-PAGE indicated that the artificial BSA and artificial detection antigen CLEN-OVA were synthesized successfully.The results demonstrated that the CLEN-BSA conjugate has immunogenicity which is good for next monoclonal antibody preparation and the research of ELISA kit.
clenbuterol hydrochloride;diazotion;ELISA
10.3969/j.issn.1005-6521.2015.06.028
2014-05-08
黄晨(1983—),女(汉),兽医师,硕士研究生,研究方向:食品安全。
