人参和酶解人参中的人参二醇和人参三醇的含量比较
2015-12-17张念洁曲新砉刘洪亮
张念洁,曲新砉,刘洪亮
(1.延边朝鲜族自治州产品质量检验所,吉林延吉133000;2.珲春绿源参业生物科技有限公司,吉林珲春133300)
人参和酶解人参中的人参二醇和人参三醇的含量比较
张念洁1,曲新砉2,刘洪亮1
(1.延边朝鲜族自治州产品质量检验所,吉林延吉133000;2.珲春绿源参业生物科技有限公司,吉林珲春133300)
建立了高效液相法色谱测定人参和通过酶解工艺处理后的人参中的人参二醇和人参三醇的含量比较的方法。色谱条件:DiamonsilC18色谱柱,流动相为甲醇∶水,(95∶5)检测波长为230 nm。结果样品经提取,水解和衍生化等前处理后,人参二醇平均回收率为92.87%,RSD为2.18%(n=6);人参三醇为平均回收率91.7%,RSD为2.10%(n=6)。人参二醇1.6 ug~16ug内有良好的线性关系,r=0.9997。人参三醇1.6 ug~16ug内有良好的线性关系,r=0.999 1。
酶解人参二醇;人参三醇;衍生化;高效液相色谱
人参的主要成分是人参皂苷(Ginsenoside),人参皂苷中人参二醇和人参三醇具有脂溶性活性成分,毒性低、分子量小、易于通过血脑屏障的特点,对动脉粥样硬化的形成有预防作用[1],人参二醇和人参三醇不仅具有降血脂、抗脂质过氧化反应、提高机体免疫力、预防感染等作用,还可产生抗疲劳、延缓衰老、调节中枢神经系统、提高机体免疫力、改善心脑血管供血不足、抑制肿瘤细胞生长等功效[2]。
现代药理学研究表明,口服人参以后,主要人参皂苷在人的消化系统中被转化成稀有人参皂苷后吸收起药效,但因含量稀少大大限制了其应用,因此制备稀有人参皂苷具有重要意义。获得大量、高纯度的稀有人参皂苷,并开发成可用于临床防治肿瘤的制剂将具有重要的科研意义和社会价值,这将对先导化合物的发现和创新药物研究具有重要意义。
用于人参皂苷糖苷化合成的方法主要有化学合成法、酶解法和微生物转化法[3]。酶解人参作为有效成分可直接被人体利用,且利用程度与肠内微生物分解能力无关,有效避免了服用人参的效能个体差异,提高了人参药用成分的利用率。
人参皂苷经强酸水解得到人参二醇和人参三醇[4]。国内外对人参二醇和人参三醇的含量测定方法报道,比色法[5]、薄层色谱法[6]、高效液相法[7]以及超临界流体色谱法[8]。本文采用衍生化试剂[9],反相高效液相色谱法对人参中酶解前后的人参二醇,人参三醇含量测定方法进行了研究比较。
1 材料与方法
1.1 仪器与试剂
日本岛津LC-10AT型高效液相色谱仪:SPD-10AD紫外可见检测器,SIL-10AD自动进样器,SCL-10A系统监控器。
甲醇:色谱纯;水:一级去离子水;甲醇配制的标准溶液储备液(1mg/mL);甲醇稀释相应的标准工作溶液;人参二醇(>99%)对照品Lot(AW017P)、人参三醇(>99%)对照品Lot(AW 016P):天津一方科技有限公司提供;3,5-二硝基苯甲酰氯(>98%):上海化成工业发展有限公司);人参酶解前后的样品由珲春绿源参业生物科技有限公司提供[10]。
1.2 色谱分析条件
液相色谱条件及系统适应性实验色谱柱为DiamonsilC18柱(4.6mm×250mm,5μm);流动相:甲醇:水(95∶5);流速:1.0mL/min;检测波长为230 nm,色谱图见图1。

图1 色谱图Fig.1 HPLC chromatogram
1.3 对照品的制备
精密移取人参二醇对照品和人参三醇对照品,置于25mL量瓶中,用甲醇溶解稀释至刻度,摇匀,得0.4mg/mL的对照品溶液作为储备液。精密吸取对照品2mL,加3,5-DNB 20mg,无水吡啶0.3mL,置75℃水浴回流1 h,取出后减压用氮气吹干,残渣用四氢呋喃溶解,定容5mL。
1.4 样品的前处理
精密称取人参提取物0.1 g,加入10mL45%乙醇超声提取1 h,加浓硫酸2.0mL置75℃水浴回流4 h,冷却后调pH6~7,环己烷提取3次,加Na2SO42 g脱洗液浓缩至近干,加入加3,5-DNB 20mg,无水吡啶0.3mL,置75℃水浴回流1 h,取出后减压用氮气吹干,残渣用四氢呋喃溶解。定容5mL。过0.45μL滤膜,进样。供液相色谱测定用。
精密称取酶解人参提取物0.1 g,其余操作与人参供试品溶液制备相同,即得。
2 结果与讨论
2.1 线性方程和方法检测限
标准曲线的制备精密吸取人参二醇对照品和人参三醇对照品,2.0、4.0、6.0、8.0mL分别置10mL量瓶中,用四氢呋喃稀释至刻度,摇匀,分别吸取20μL,注入液相色谱仪,按照1.2项下的方法测定,以对照品浓度为横坐标,对照品峰面积为纵坐标,结果经回归分析,人参二醇1.6 ug~16 ug内有良好的线性关系,回归方程Y=119 914X+32 955,r=0.999 7。人参三醇1.6 ug~16 ug内有良好的线性关系,回归方程为Y=86 139X+23 535,r=0.999 1。见表1。方法检出限按S/N=3计算,人参二醇最低检出线以信噪比为3∶1计算,人参二醇的低检出线是1ug/kg,人参三醇的低检出线是1ug/kg。
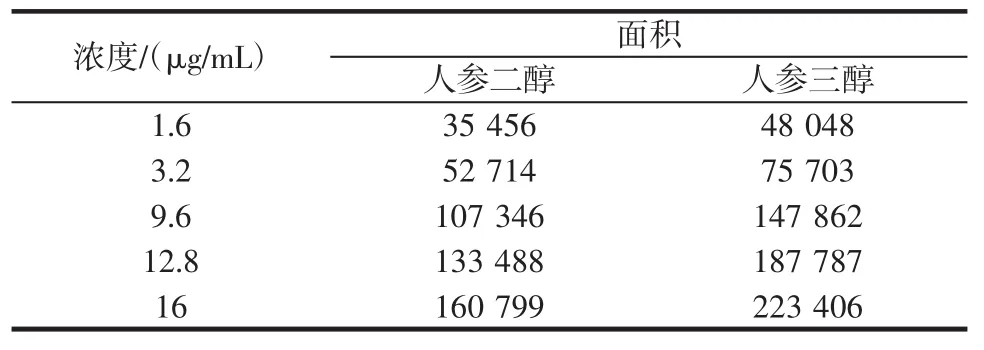
表1 浓度与面积关系Table1 Relationship of concentration and peak area
2.2 精密度实验
按照对照品溶液制备方法(1.3),配制溶液,按照1.2项下的方法测定,连续进样5次见表2。精密度实验精密吸取人参二醇、人参三醇对照品溶液20μL,测定峰面积,结果人参二醇RSD为1.63%。人参三醇RSD为1.02%,见表2。

表2 精密度实验Table2 Precision experiment
2.3 稳定性实验
稳定性实验样品溶液,按照1.2项下的方法在0、2、4、8、16、24 h分别进样20μL,测定峰面积,结果人参二醇RSD为1.81%,人参三醇RSD为1.23%,表明样品溶液在24 h内保持稳定。见表3。
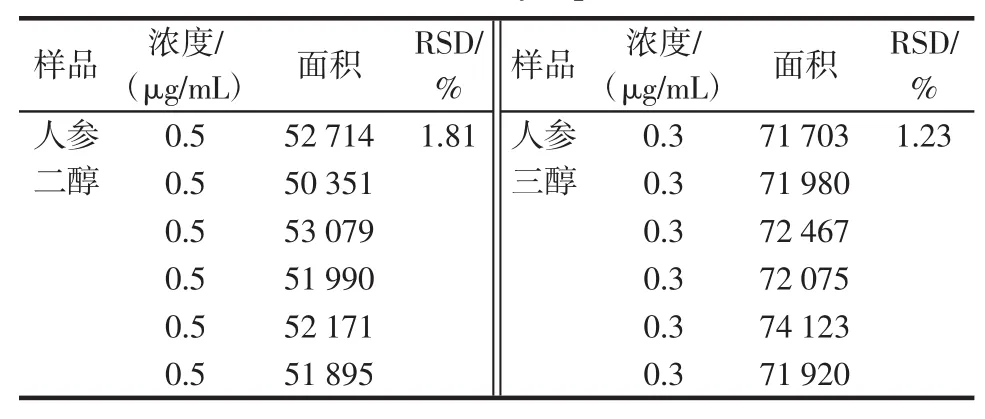
表3 稳定性实验Table3 Stability experiments
2.4 重复性实验
重复性实验取同一批样品6份,按“1.2”项方法测定峰面积,人参二醇RSD为1.50%,人参三醇RSD为1.36%。见表4。
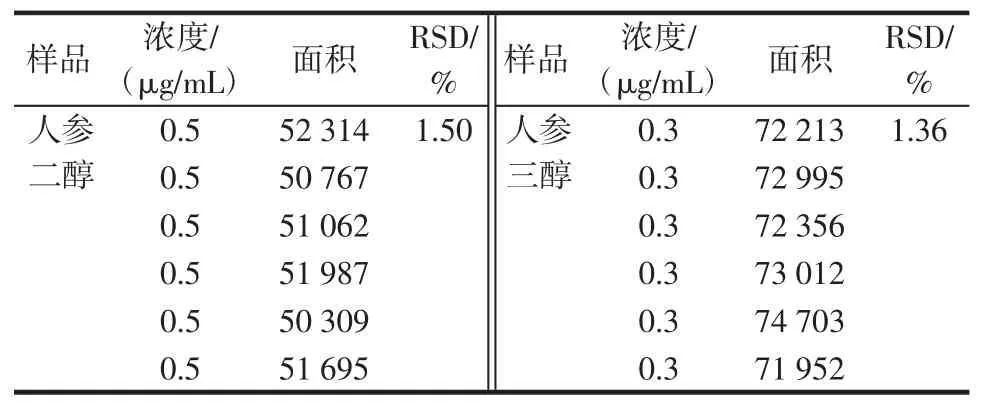
表4 重复性实验Table4 Repeated experiment
2.5 加样回收率实验
加样回收率实验精密称取人参样品0.1 g,分别加入一定量的(3个梯度浓度)人参二醇,人参三醇对照品溶液,按“1..4”的制备方法及“1.2”项条件方法进行测定,结果见表5。
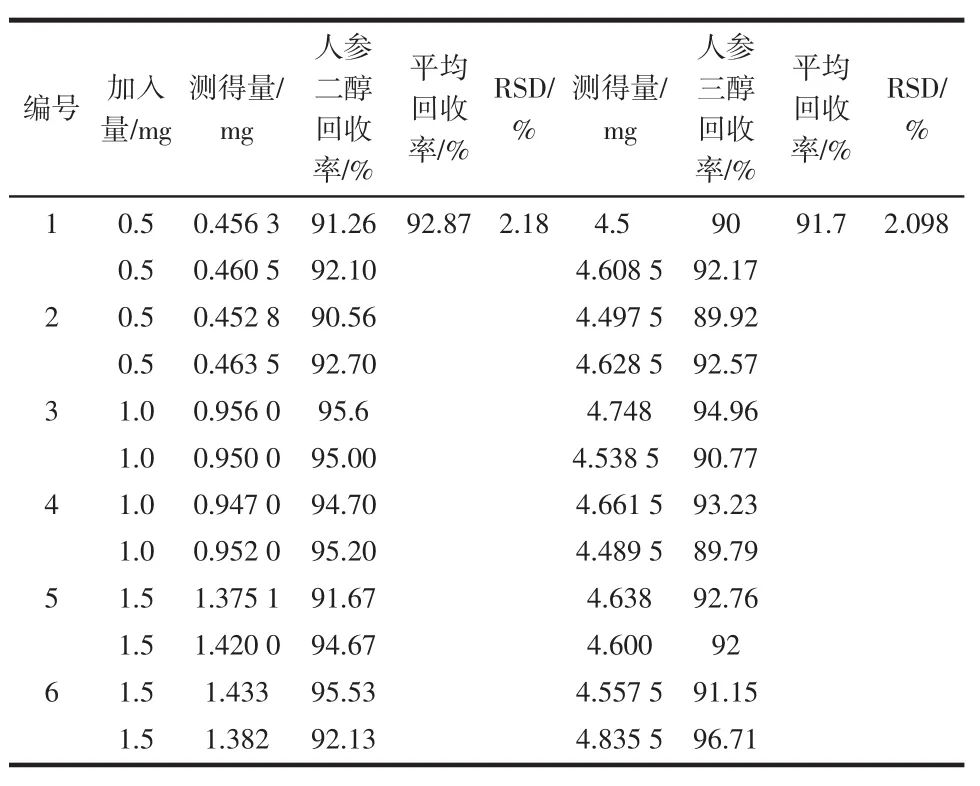
表5 加样回收率的实验结果(n=6)Table5 Results of recovery ratio
人参二醇平均回收率为92.87%,RSD为2.18%(n=6);人参三醇为平均回收率91.7%,RSD为2.10%(n=6)。
2.6 样品的含量测定
取样品按照1.2项下的方法测定,人参样品中含有人参二醇的含量、人参三醇的含量见表6。
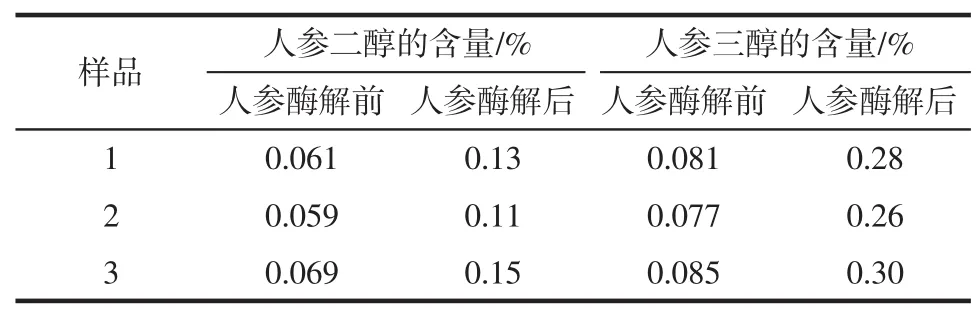
表6 样品中的人参二醇和人参三醇的含量Table6 The contents of Panoxadiol and Panaxatriol in samples
3 结论
1)经过多种实验方法的比较,最终选择该检测方法同时测出样品中的人参二醇和人参三醇的含量,本方法快速灵敏,酸水解引起苷元结果的变化,主要得到人参二醇(Panoxdiol,PD),人参三醇(Panaxatriol,PT)及C-20差向异构体[9]。衍生化方法、回流的时间、温度是整个实验成败的关键一环。经实验对比,衍生化方法解决了人参二醇和人参三醇在无紫外吸收的情况下无法测定的问题。
2)最近十几年来除了传统的化学合成法外,酶解法和微生物转化法被应用到这个领域中来,采用酶解法具有反应条件容易控制、酶系丰富、等许多化学合成法所不具备的优点。在工业化大规模制备稀有人参皂苷时首选酶解法和微生物转化法[10]。通过本次试验,样品的含量测定结果显示,酶解工艺处理过的人参中的人参二醇和人参三醇的含量均大大超过了普通人参中的人参二醇和人参三醇的含量,这与酶解工艺有关,提高了稀有人参皂甙的含量。这次试验的结果为以后的制备人参皂苷制品提供了一定的参考价值。
[1]李凤娥,孔繁利,孙新,等.人参二醇组皂苷(PDS)对血脂、血清NOMDA含量、SOD活力的影响[J].中国民康医学2009,21(21):2653-2657
[2]刘英,华吉年,郑月红,等.人参二醇组皂甙和三醇组皂甙药理作用的比较研究[J].吉林中医药,1999(2):57-60
[3]杨宁,杨世林,赵余庆.稀有人参皂苷糖苷化合成方法的研究进展[J].现代药物与临床2014,29(5):574-582
[4]曹青青,邹澄.人参二醇和人参三醇氧化反应的研究[J].云南中医学院学报 2013,36(6):4-6
[5]杨燕,罗志辉,晏全.荔枝核总皂甙的含量测定[J].化工时刊,2004,18(1):45-46
[6]张春红,李向高,张连学,等.薄层扫描法测定人参总皂苷酸水解物中人参二醇的含量[J].特产研究2006(2):71-73
[7]张雷,王志才,陈燕萍.反相高效液相色谱法快速测定人参茎叶二醇组总皂苷含量[J].分析化学 2009(A02):176
[8]李云华,李修禄,虹岚.超临界流体色谱法测定三七及云南白药中人参二醇和人参三醇的含量[J].药学学报1991,26(10):764-767
[9]李章万,徐秀荣,冯春琼,等.高效液相色谱衍生化法测定红参及生脉注射液中人参二醇和人参三醇的含量[J].华西药学杂志1999,14(4):271-273
[10]刘发贵,张成中,郑毅男.低极性人参皂苷制备研究进展[J].人参研究 2011(2):28-33
Simultaneous Determination of Residual of Panoxadiol and Panaxatriol Ginseng and Enzymolysis Ginseng by High Performance Liquid Chromatography
ZHANG Nian-jie1,QU Xin-xu2,LIUHong-liang1
(1.Yanbian State Product Inspection,Yanji133000,Jilin,China;2.Hunchun Luyuan Ginseng Industry Scienceand Technology Co.,Ltd.,Hunchun 133300,Jilin,China)
To establisha high performance liquid chromatography (HPLC)method for simultaneous determination of residual panoxadiol and panaxatriol Ginseng and enzymolysis Ginseng by HPLC external standard method.HPLC gradient elution method was used withmethanol -water(95∶5).DiamonsiC18 column was used,and panoxadiol and panaxatriol was determined at the detection wavelength of230 nm.The samples were treated by extraction,hydrolysis and derivation The averrage recovery and RSD of panoxadiol were 92.87% and 2.18%(n=6),respectively.The averrage recovery and RSD of panaxatriol were91.7%and 2.10%(n=6),respectively.The standard curve of panoxadiol was linear in the range of 1.6 ug-16 ug,r=0.999 7and The standard curve of panaxatriol was linear in the range of1.6 ug-16 ug,r=0.999 1.
enzymolysis;panoxadiol;panaxatriol;derivatization;HPLC
10.3969/j.issn.1005-6521.2015.06.007
2014-09-19
张念洁(1979—),女(汉),工程师,研究生,研究方向:分析化学(食品质量分析)。
