金银花叶抑菌成分的提取及效果研究
2015-12-17李世传杜华英熊建华汤凯洁吴国平吴磊燕
李世传,杜华英,熊建华,*,汤凯洁,吴国平,吴磊燕
(1.江西农业大学食品科学与工程学院,江西南昌330045;2.双胞胎集团研发中心,江西南昌330096)
金银花叶抑菌成分的提取及效果研究
李世传1,2,杜华英1,熊建华1,*,汤凯洁1,吴国平1,吴磊燕1
(1.江西农业大学食品科学与工程学院,江西南昌330045;2.双胞胎集团研发中心,江西南昌330096)
研究金银花叶抑菌成分的最佳提取工艺和抑菌效果。以抑菌圈大小为评价指标,通过比较普通回流、超声提取、索氏提取三种方法的效果确定相对较佳提取方法,并在单因素的基础上采用正交试验优化提取工艺,采用梯度稀释法测定提取物的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)。结果表明,最佳提取工艺为采用普通回流提取,温度为70℃、乙醇体积分数为60%、料液比为1∶15 g/m L的条件下提取时间1.5 h,金银花叶乙醇提取物对大肠杆菌和金黄色葡萄球菌的MIC分别为500μg/g和250μg/g,MBC分别为1 000μg/g和500μg/g。结论:采用普通回流提取法能较好地提取金银花叶抑菌活性成分,工艺稳定、可行。
金银花叶;抑菌活性成分;提取工艺;抑菌效果
植物资源的综合利用是近年开发研究的重点,如何最大限度地获取植物中的有效成分是提高植物综合利用的基础和保障[1-2]。金银花(Lonicera Japonica Thunb),又名忍冬,为忍冬科植物,是我国传统的中药材,具有抗菌消炎、清热解毒、凉散风热、抗病毒、保肝利胆等功能[3-5]。其叶片产量较高,资源丰富,同时有很多研究表明叶中富含绿原酸、黄酮等多酚类物质,抑菌、抗氧化等药理活性较好,特别在抑菌方面与花的相同甚至高于花[6-9]。然而有关金银花叶抑菌有效成分的优化提取却鲜有报道,本文以金银花叶为原材料,以典型的革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌为指示菌,研究了金银花叶抑菌活性物质的提取方式和提取工艺条件,同时探讨了金银花叶乙醇提取物的最低抑菌和杀菌浓度,以期为金银花叶资源的开发利用提供一定的参考。
1 试验材料与方法
1.1 材料与仪器
1.1.1 材料
金银花叶,采自江西南昌梅岭,江西中医学院邹嘉玉鉴定,阴干,粉碎,待用。
1.1.2 供试菌种
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus),江西农业大学微生物实验室提供。
1.1.3 主要试剂
无水乙醇、氯化钠:分析纯,天津永大化学试剂有限公司;蛋白胨、牛肉膏:生物试剂:北京奥博星生物技术有限责任公司,等。
1.1.4 主要仪器
HH4-数显恒温水浴锅:国华电器有限公司;RE-5旋转式蒸发仪:上海亚荣生化仪器厂;FD-1冷冻干燥机:北京博医康技术公司;DHP120恒温培养箱:上海跃进医疗机械厂;LDZX-40B电热蒸汽灭菌锅:上海申安医疗机械厂等。
1.2 方法
1.2.1 提取方式的选择
取金银花叶粉末10 g9份,用60%的乙醇作为提取剂,料液比为1∶15 g/mL,温度60℃,分别采用普通回流提取、超声提取和索氏提取,提取后真空抽滤,滤渣再以相同的条件提取一次。合并两次提取液,用旋转式蒸发仪真空浓缩,冷冻干燥得到普通回流提取物、超声提取物、索氏提取物。
将3种方式提取物进行抑菌试验,比较提取效果。
1.2.2 金银花叶提取工艺单因素试验
金银花叶含有丰富的酚酸、黄酮等多酚类活性物性,是抑菌、消炎等多种活性的功能成分,乙醇价廉易得、无毒、选择性好,极性较高,为多酚类较好的提取剂,选择乙醇溶液提取金银花叶抑菌活性成分。
分别以乙醇体积分数(0、20、40、60、80、100)、提取时间(0.5、1、1.5、2、2.5、3 h)、提取温度(25、40、55、70、85、100℃)和料液比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30 g/mL)为单因素,考察各因素对金银花叶提取物抑菌效果的影响。
1.2.3 金银花叶提取正交试验
根据单因素试验结果,综合考虑乙醇体积分数、提取时间、提取温度和料液比对提取效果的影响,安排L9(34)正交试验见表1,以确定最佳的提取参数。
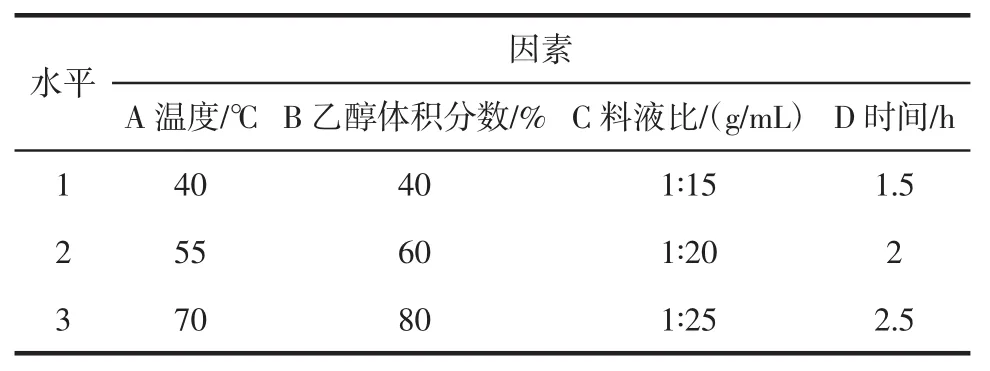
表1 正交试验因素水平表Table1 The factors and Levels for the orthogonal test
1.2.4 验证试验
取金银花叶粉末10 g,在正交试验获得的最佳工艺条件下进行提取,提取物进行抑菌试验,重复三次。
1.2.5 抑菌试验方法
牛肉膏蛋白胨培养基的配制[10]:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂17 g~20 g,蒸馏水1 000mL,用1mol/L的氢氧化钠调pH至7.4左右。
将供试菌(大肠杆菌和金黄色葡萄球菌)在斜面培养基上活化,活化后用无菌水洗脱配制成含菌数约为1×106CFU/mL的菌悬液。往无菌培养皿内倒入约15mL的培养基,冷却后往培养基内加入供试菌悬液0.2mL,用涂布器涂布均匀,制成含菌平板。样品配成浓度为0.1 g/mL,往灭菌的滤纸片(直径为12mm)上滴加20μL的供试样品,待其干燥后贴入含菌平板中,每皿一片,放入培养箱中培养培养24 h,培养温度为(37±1)℃。每个样品做3次重复,培养后测量滤纸片抑菌圈的大小,抑菌圈越大,表示抑菌效果越好[11-12]。
1.2.6 金银花叶乙醇提取物的最低抑菌浓度和最低杀菌浓度的测定
将金银花叶乙醇提取物标准液用无菌水配制成2 000、1 000、500、250、125、62.5和31.25μg/g的浓度系列,依次各取1mL注入已灭菌的液体培养基中,分别向试管中准确注入0.1mL的浓度约为1×106CFU/ mL的金黄色葡萄球菌和大肠杆菌菌悬液,另设对照组。将所有试管放于36℃中培养24 h~48 h,在黑色背景下进行观察,有细菌生长的呈浑浊,未见浑浊的则为无菌生长。取上述药物最低抑菌浓度以上未见细菌生长的各试管培养物0.1mL,移接至不含药物的无菌琼脂培养基上,用涂布器将药液涂匀,放在37℃恒温培养箱中培养24 h~48 h,观察是否有细菌生长,平皿培养基中,少于5个菌落的最低药物溶度就是该药物的最低杀菌浓度(MBC)[13-15]。
1.2.7 统计方法
2 结果与讨论
2.1 提取方式的选择
3种不同方式提取金银花叶抑菌成分的抑菌效果如表2所示。
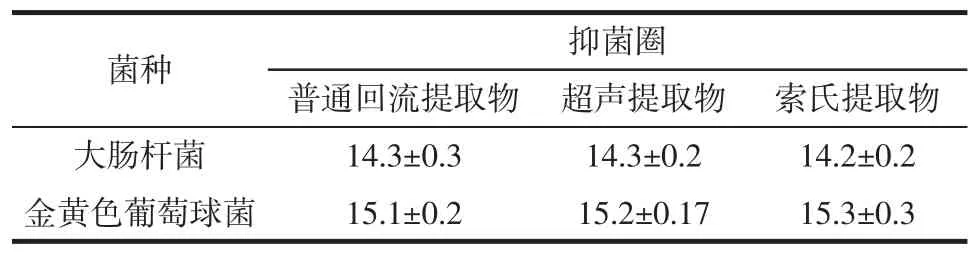
表2 金银花叶不同提取方式提取物的抑菌作用Table2 The antimicrobial effect of different method extract from the Lonicera Japonica leaves mm
由表2可知3种提取方式所得提取物对大肠杆菌和金黄色葡萄球菌都有抑菌效果且对大肠杆菌的抑制效果较金黄色葡萄球菌要差。超声提取和索氏提取的效果略好于普通回流提取,但由于超声提取需要有较大的超声设备,索氏提取提取量少、速度慢等缺点,而普通回流提取操作简单,使用方便,提取量大,并且其效果和前两者相差不大,因此选择普通回流提取作为试验的提取方式。
2.2 金银花叶乙醇溶液提取单因素试验结果
2.2.1 乙醇体积分数对金银花叶提取物抑菌效果的影响
不同乙醇体积分数提取金银花叶抑菌效果的影响如图1所示。
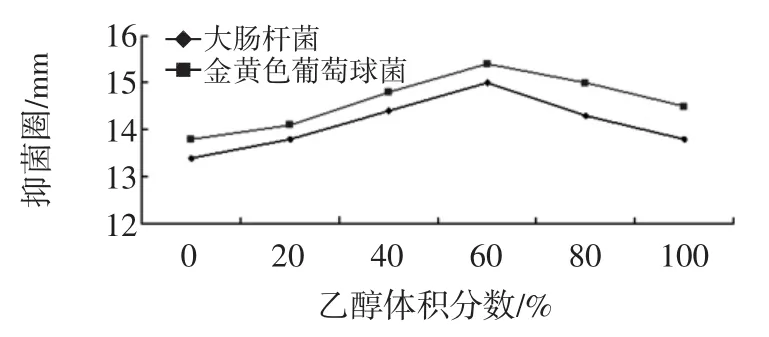
图1 乙醇体积分数对金银花叶乙醇提取物的抑菌效果的影响Fig.1 The effect of concentration of ethanol on antibacterial activities
由图1可知当乙醇体积分数小于60%时,金银花叶乙醇提取物的抑菌效果不断增强,当乙醇体积分数大于60%时抑菌效果会减弱,乙醇体积分数为60%时抑菌效果最好。表明在一定范围内提高乙醇体积分数有利于抑菌物质的提取,浓度过高反而不利于抑菌物质的提取。
2.2.2 提取时间
提取时间对金银花叶乙醇提取物抑菌效果的影响如图2所示。
由图2可知,随着提取时间的增加,金银花叶提取物的抑菌效果不断增强,但到2 h之后抑菌效果增加缓慢。为了节约时间而又使金银花叶抑菌物质充分提取,可选择2 h作为最佳条件。
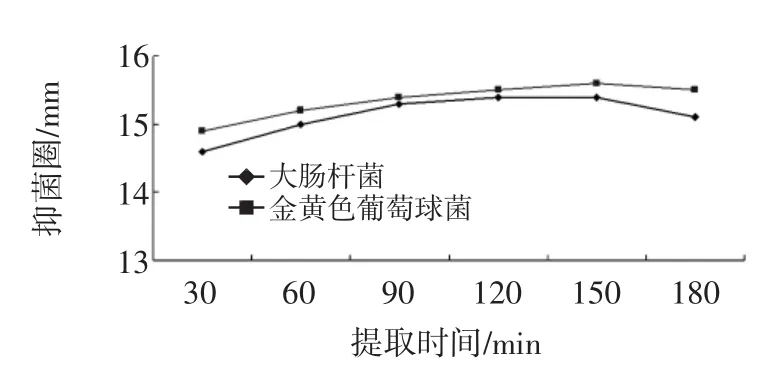
图2 提取时间对金银花叶乙醇提取物抑菌效果Fig.2 The effect of time for extraction on antimicrobial activities
2.2.3 提取温度
提取温度对金银花叶乙醇提取物抑菌效果的影响如图3所示。
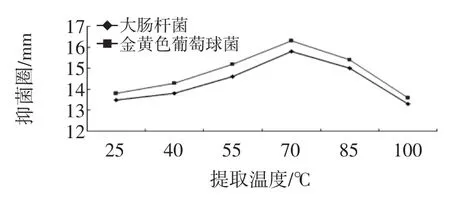
图3 温度对金银花叶乙醇提取物的抑菌效果的影响Fig.3 The effect of temperature on antimicrobial activities
由图3可知,在提取温度小于70℃时,金银花叶乙醇提取物抑菌效果不断增强,温度大于70℃后则相反,在70℃时抑菌效果最好。说明在一定范围内温度越高,越有利于金银花叶抑菌活性物质的提取。这是由于在一定温度范围内温度升高,分子运动加快,有利于分子的扩散,使得活性物质;但当温度过高时,可能会将金银花叶中的某些抑菌活性成分破坏,故反而不利于抑菌活性物质的提取。
2.2.4 料液比
不同料液比对金银花叶乙醇提取物抑菌效果的影响如图4所示。
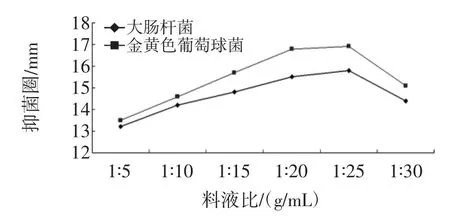
图4 料液比对金银花叶乙醇提取物的抑菌效果的影响Fig.4 The effect of proportion of solid to liquid on antimicrobial activities
图4 显示,料液比对金银花叶乙醇提取物的抑菌作用呈先上升后下降的趋势,在料液比为1∶25 g/mL时抑菌效果到达最大。料液比1∶25g/mL时的抑菌效果与1∶20g/mL时的抑菌效果相差不大,从减少浓缩时间和节约乙醇用量等方面综合考虑,料液比1∶20g/mL更为合理科学。
2.3 金银花叶提取正交试验结果
金银花叶乙醇溶液提取正交试验结果、极差及方差分析如表3、表4、表5、表6和表7所示。
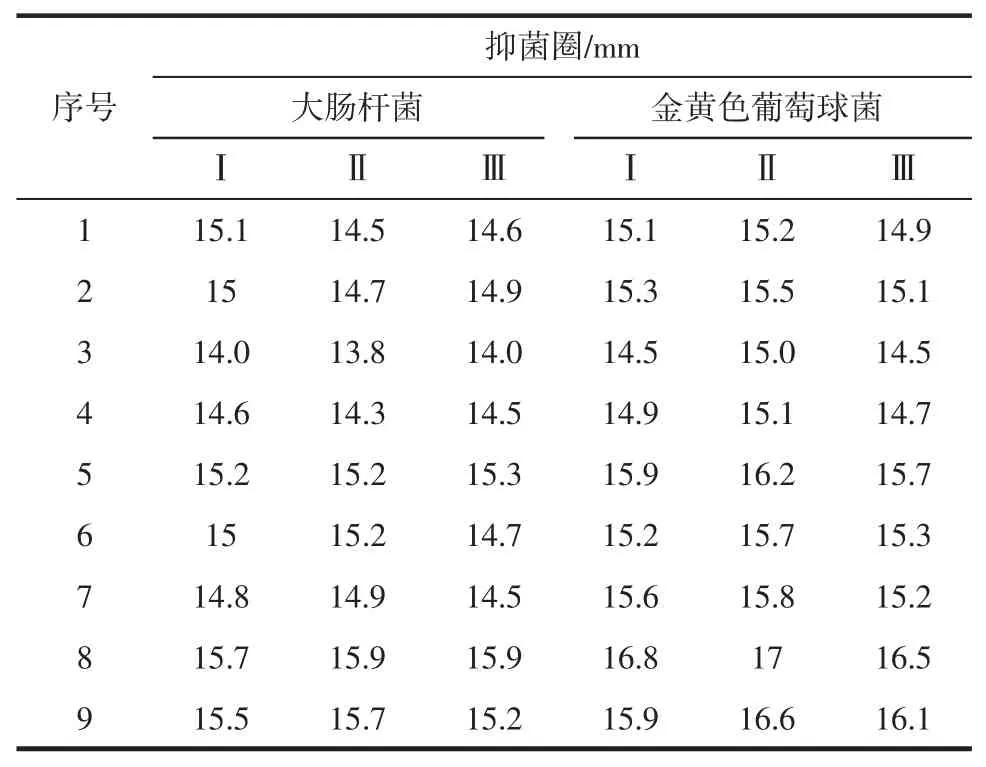
表3 金银花叶乙醇提取物正交试验结果Table3 The results of orthogonal design test
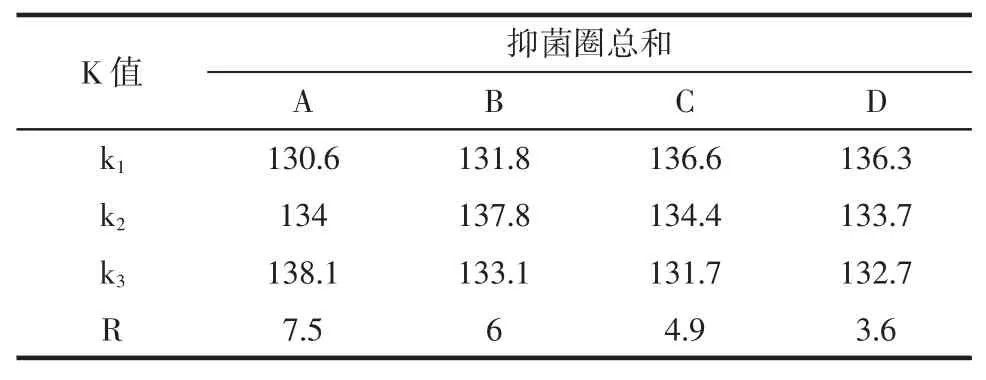
表4 金银花叶乙醇提取物对大肠杆菌抑制效果的极差分析Table4 The Poor analysis of antimicrobial activities to Escherichia coli
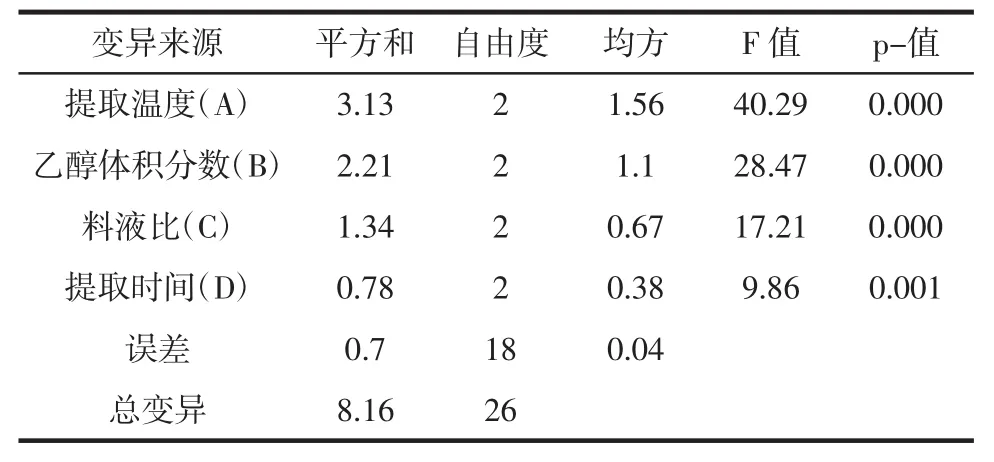
表5 乙醇提取物对大肠杆菌的抑制效果正交试验方差分析表Tab le5 Analysis of variance of antimicrobial activities to Escherichia coli
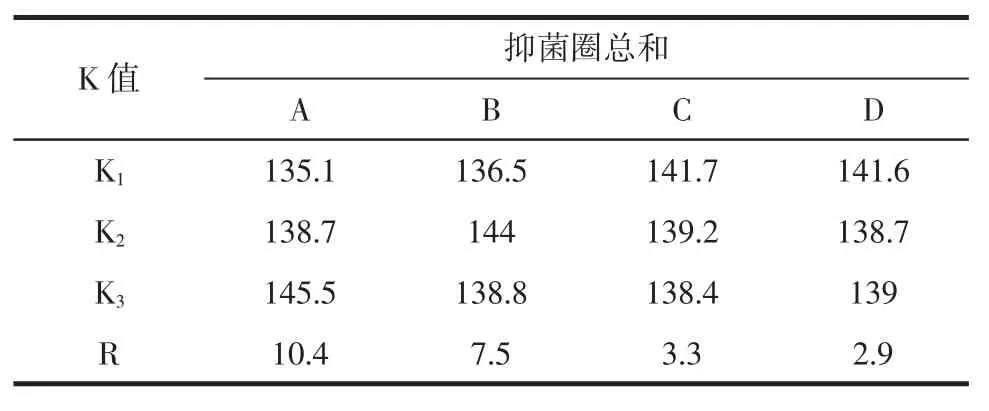
表6 金银花叶乙醇提取物对金黄色葡萄球菌抑制效果极差分析Table6 The Poor analysis of antimicrobial activities to Staphylococcus aureus
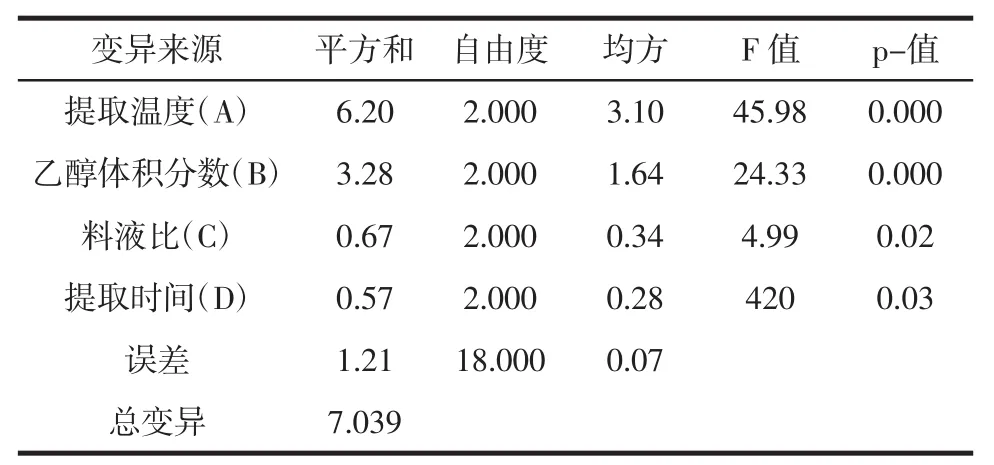
表7 乙醇提取物对金黄色葡萄球菌抑制效果的正交试验方差分析表Table7 Analysis of variance of antimicrobial activities to Staphylococcus aureus
金银花叶乙醇提取物对大肠杆菌的正交数据表3及极差分析表4显示各因素对金银花叶乙醇提取物抑菌效果的影响程度为A>B>C>D。表5方差分析结果可知,各因素对测定结果差异极显著(p<0.01)。综合极差分析和方差分析,金银花叶乙醇提取物对大肠杆菌抑制效果的最佳提取工艺为A3B2C1D1,即在提取温度为70℃、乙醇体积分数为60%、料液比为1∶15 g/mL和提取时间为1.5 h条件下,对金银花叶进行提取,其提取物对金黄色葡萄球菌的抑制效果最好。
金银花叶乙醇提取物对金黄色葡萄球菌抑制效果的正交数据表3极差分析表6显示各因素对金银花叶乙醇提取物抑菌效果的影响程度为A>B>C>D。由表7方差分析结果可知,提取温度和乙醇体积分数各水平间差异极显著(P<0.01),料液比和提取时间各水平差异不显著(P>0.05)。综合极差分析和方差分析,金银花叶乙醇提取物对金黄色葡萄球菌抑制效果的最佳提取工艺为A3B2C1D1,即在提取温度为70℃、乙醇体积分数为60%、料液比为1∶15g/mL和提取时间为1.5 h条件下,对金银花叶进行提取,其提取物抑菌效果最好。这与金银花叶乙醇提取物对大肠杆菌的抑制效果的最佳工艺相一致。
按照正交试验得出的最佳提取工艺条件,即提取温度为70℃、乙醇体积分数为60%、料液比为1∶15 g/mL和提取时间为1.5 h条件下提取金银花叶抑菌活性成分,提取物进行抑菌试验,重复3次,得到对大肠杆菌的抑菌圈为(15.8±0.2)mm,对金黄色葡萄球菌的抑菌圈为(16.9±0.17mm),与正交试验最佳工艺组数据吻合,表明该最佳工艺提取金银花叶抑菌活性成分抑菌效果好,工艺稳定。
2.4 金银花叶乙醇提取物的最低抑菌浓度(MIC)
金银花叶乙醇提取物对供试菌的最低抑菌浓度如表8所示。
从表8中可知,金银花叶乙醇提取物对金黄色葡

表8 金银花叶乙醇提取物对供试菌的最低抑菌(M IC)浓度Table8 TheM IC of extract from Lonicera Japonica Thunb leaves
萄球菌的最低抑菌浓度为250μg/g,对大肠杆菌的最低抑菌浓度为500μg/g。
2.5 金银花叶乙醇提取物的最低杀菌浓度(MBC)
金银花叶乙醇提取物对供试菌的最低抑菌浓度如表9所示。
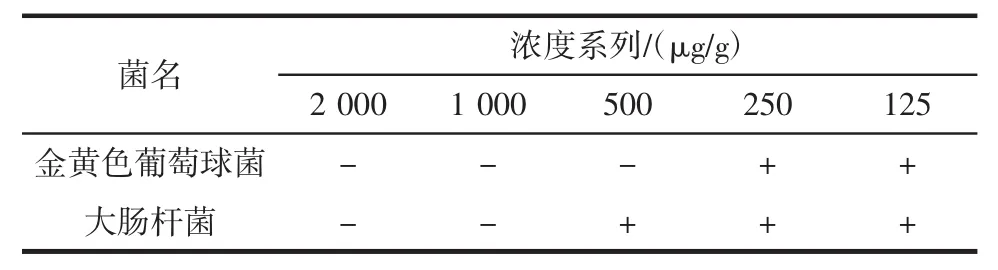
表9 金银花叶乙醇提取物对供试菌的最杀抑菌(MBC)浓度Table9 The MBC of extract from Lonicera Japonica Thunb leaves
从表9中可知,金银花叶乙醇提取物对金黄色葡萄球菌的最低杀菌浓度(MBC)为500μg/g,对大肠杆菌的最低杀菌浓度(MBC)为1 000μg/g。
3 结论
1)金银花叶抑菌成分的3种提取方式所得提取物对大肠杆菌和金黄色葡萄球菌都有抑菌效果,综合考虑各方面因素,采取普通回流提取更合理。
2)通过单因素和正交试验优化,金银花抑菌成分提取的最佳工艺为:A3B2C1D1,即在提取温度为70℃、乙醇体积分数为60%、料液比为1∶15 g/mL和提取时间为1.5 h,工艺稳定,结果可信。
3)金银花叶乙醇提取物对金黄色葡萄球菌的最低抑菌浓度为250μg/g,对大肠杆菌的最低抑菌浓度为500μg/g。
4)金银花叶乙醇提取物对金黄色葡萄球菌的最低杀菌浓度(MBC)为500μg/g,对大肠杆菌的最低杀菌浓度(MBC)为1 000μg/g。
5)金银花叶乙醇提取物对金黄色葡萄球菌的抑制效果好与对大肠杆菌的抑制效果。
[1]Bin Shan,Yi-Zhong Cai.The in vitro antibacterial activity of dietary spice and medicinal herb extracts[J].International Journal of Food Microbiology,2007,117(1):112-119
[2]Jianhua Xiong,Shichuan Li,Wenjun Wang,et al.Screening and identification of the antibacterial bioactive compounds from Lonicera japonica Thunb.Leaves[J].Food Chemistry,2013,138(1):327-333
[3]Chidananda Swamy Rumalla.Quantitative determination of phenolic acids in Lonicera Japonica Thunb using high performance thin layer chromatography[J].Journal of Liquid Chromatography&Related Technologies,2010,34(1):38-47
[4]李世传,熊建华,罗秋水,等.不同干燥方法对金银花叶成分和抑菌效果的影响[J].中国食品学报,2012,12(12):78-83
[5]Atiqur Rahman,Sun Chul Kang.In vitro control of food-borne and food spoilage bacteria by essential oil and ethanol extracts of Lonicera japonica Thunb[J].Food Chemistry,2009,116(3):670-675
[6]Eun Ju Lee,Ju Sun Kim,Hyun Pyo Kim,eta1.Phenolic constituents from the flower buds of Lonicera japonica and their 5-lipoxygenase inhibitory activities[J].Food Chemistry2010,120(1):134-139
[7]On Nuri Seo,Gon-Sup Kim,Semin Park,et a1.Determination of polyphenol components of Lonicera japonica Thunb.using liquid chromatography-tandem mass spectrometry:Contribution to the overall antioxidant activity[J].2012,134(1):572-577
[8]郭玉,阳育聪,刘运美.金银花及其叶中有效成分的比较研究[J].南华大学学报:医学版,2008,36(2):154-157
[9]孙德梅.金银花叶提取物的抗氧化活性和抑菌作用研究[J].河南科学,2002,20(5):511-513
[10]黄秀梨.微生物学实验指导[M].北京:高等教育出版社,1999:62-64
[11]赵量忠,王放银.灰灰菜抗菌物质的提取及抗菌效果的研究[J].生物技术,2004,14(4):66-67
[12]Andrews JM.For the BSAC working party on susceptibility testing, BSAC standar dized disc susceptibility testing method[J].Journal Antimicrobial Chemotherapy,2001,48(Suppl1):43-57
[13]Clinial and Laboratory Standards Institute M100-S15.American standard book number[S].Wayne:Clinial and Laboratory Standards Institute Publishing House2005:100-115
[14]李仪奎.中药药理实验方法学[M].上海:上海科技出版社,1991:291
[15]李志洲,刘军海,王俊宏,等.猪苓硒多糖连续合成工艺及抑菌性能研究[J].食品与机械,2013,29(1):31-35
Study on Extraction and Activity of Effective Antibacterial Ingredients from Lonicera Japonica Leaves
LI Shi-chuan1,2,DU Hua-ying1,XIONG Jian-hua1,*,TANG Kai-jie1,WU Guo-ping1,WU Lei-yan1
(1.College of Food Science and Engineer,Jiangxi Agricultural University,Nanchang330045,Jiangxi,China;2.The Twins Group Research and Development Center,Nanchang330096,Jiangxi,China)
To study the optimum extraction process and activity of antibacterial ingredients from Lonicera Japonica Leaves.The inhibition zone as evaluation index,and the normal reflux,ultrasonic extraction and Soxhlet extraction had been compared to obtain the relatively effective extraction method,meanwhile orthogonal experiment had been investigated based on the single factor experiment.In addition,gradient dilution method have been used for researching MIC and MBC.The results showed that,the reflux method was selected at last and the optimum condition of antibacterial ingredient sextraction was60%ethanol in 1.5 h at70℃and solid to liquid ratio 1∶15 g/mL.MIC was 250μg/g and 500μg/g for Staphylococcus aureus and Escherichia coli,respectively.MBC was 500μg/g and 1 000μg/g for Staphylococcus aureus and Escherichia coli,respectively. Conclusion,antibacterial ingredients from Lonicera Japonica Leaveswere extracted more fully by the normal reflux,the optimized technology is stable and viable.
Lonicera japonica leaves;effective antibacterial ingredients;extraction process;antibacterial activity
10.3969/j.issn.1005-6521.2015.06.002
2013-12-02
国家自然科学基金地区基金项目(31060226);江西省科技支撑项目(20122BBF60080)
李世传(1989—),男(汉),硕士研究生,研究方向:植物功能成分化学。
*通信作者:熊建华,女(汉),教授,硕士研究生导师,研究方向:食品安全及天然产物化学。
