氙气延迟后处理诱导蛋白激酶B信号通路活化对大鼠脊髓缺血再灌注损伤的保护作用
2015-12-16刘诗瑶侯思雨杨彦伟汪晓南金沐董秀华卢家凯程卫平
刘诗瑶,侯思雨,杨彦伟,汪晓南,金沐,董秀华,卢家凯,程卫平
氙气延迟后处理诱导蛋白激酶B信号通路活化对大鼠脊髓缺血再灌注损伤的保护作用
刘诗瑶,侯思雨,杨彦伟,汪晓南,金沐,董秀华,卢家凯,程卫平
目的:探讨蛋白激酶B(Akt)信号通路在氙气延迟后处理对大鼠脊髓缺血再灌注损伤中的作用。
方法:建立大鼠脊髓缺血再灌注损伤模型。采用随机数表法将实验动物分为7组(n=16):脊髓缺血再灌注组(I/R组)、脊髓缺血再灌注+氙气延迟后处理组(I/R+Xe组)、脊髓缺血再灌注+PI3K/Akt阻断剂组(I/R+wortmannin组)、脊髓缺血再灌注+阻断剂溶剂二甲基亚砜(DMSO)组(I/R+DSMO组)、脊髓缺血再灌注+PI3K/Akt阻断剂+氙气延迟后处理组(I/R +wortmannin+Xe组)、脊髓缺血再灌注+阻断剂溶剂DMSO+氙气延迟后处理组(I/R+DMSO+Xe组)、假手术组(Sham组)。分别于缺血再灌注后6、12、24、48 h观察记录大鼠后肢运动功能,于缺血再灌注后4 h(n=8)和48 h(n=8)行尼氏染色、TUNEL染色检测存活及凋亡指数,行蛋白印迹法(Western blot) 测定脊髓组织中p-Akt蛋白表达。
结果:与Sham组相比,其余各组大鼠在各检测时点后肢运动功能评分显著降低,脊髓前角运动神经元存活数量显著减少、凋亡数量显著增加,p-Akt水平显著增高(P<0.05)。I/R+Xe组较I/R组大鼠在各检测时点后肢运动功能评分显著增加,脊髓前角运动神经元存活数量显著提高、凋亡数量显著减少,p-Akt水平显著增高(P<0.05)。I/R+wortmannin+Xe组较I/R+Xe组大鼠在各检测时点后肢运动功能评分明显下降,脊髓前角运动神经元存活数量显著减少、凋亡数量显著增加,p-Akt水平显著降低(P<0.05)。
结论:氙气延迟后处理通过激活Akt信号通路对大鼠脊髓缺血再灌注损伤起到保护作用。
氙气;延迟后处理;脊髓;缺血再灌注;蛋白激酶B通路
(Chinese Circulation Journal, 2015,30:498.)
随着高血压和动脉粥样硬化发病率的增加,主动脉夹层动脉瘤的发病率随之增加[1]。外科手术是其主要治疗方法,而术后截瘫发病率高达10%,术中脊髓缺血再灌注损伤是导致术后截瘫的重要原因[2]。缺血或药物后处理对脊髓缺血再灌注损伤具有保护作用[3]。氙气作为一种惰性麻醉气体,对心脏、神经系统和肾脏的缺血性损伤有保护效应[4]。氙气延迟后处理对脊髓缺血再灌注损伤具有明确保护作用,而保护机制尚不明确[5]。蛋白激酶B(Akt)是肌醇与磷脂酰肌醇(PI)的重要激酶,Akt信号通路激活参与缺血预处理和后处理对脏器缺血再灌注损伤的保护作用[6]。本研究通过建立大鼠脊髓缺血再灌注损伤模型,观察Akt信号转导通路是否参与氙气延迟后处理对脊髓缺血再灌注损伤保护作用,以初步阐明其保护机制。
1 材料和方法
实验材料:112只8周龄雄性Sprague-Dawley(SD)大鼠(SPF级,封闭群),北京维通利华实验动物技术有限公司,体重250~350g。
大鼠脊髓缺血再灌注损伤模型建立[7]:3%戊巴比妥钠腹腔注射,经口气管插管,全程呼吸机控制呼吸。术中维持体温并行肛温监测。经左颈总动脉监测近端血压,尾动脉监测远端血压。全程记录近端、远端血压和肛温。经左髂总动脉,将2F球囊导管置入约10 cm,使前端达左锁骨下动脉开口下3~4 mm水平。经尾动脉注射500 U/kg肝素钠,2 min后充起球囊,完全阻断左锁骨下动脉远端血流,使远端血压急速下降并持续低于7 mmHg,通过体位调整维持近端血压。25 min后,抽空球囊恢复水平体位。经尾动脉注入鱼精蛋白(1 mg鱼精蛋白中和100 U肝素钠)。缝合髂总动脉穿刺处,确保血流通畅。于阻断前10 min和阻断后15 min经尾动脉行动脉血气分析。
实验动物分组和处理方案:将112只大鼠采用随机数表法分为7组,每组16只:(1)脊髓缺血再灌注组(I/R组);(2)脊髓缺血再灌注+氙气延迟后处理组(I/R+Xe组);(3)脊髓缺血再灌注+PI3K/Akt阻断剂渥曼青霉素(wortmannin)组(I/R+wortmannin组);(4)脊髓缺血再灌注+阻断剂溶剂二甲基亚砜(DMSO)组(I/R+DSMO组);(5)脊髓缺血再灌注+PI3K/Akt阻断剂wortmannin+氙气延迟后处理组(I/ R+wortmannin+Xe组);(6)脊髓缺血再灌注+阻断剂溶剂DMSO+氙气延迟后处理组(I/R+DMSO+Xe组);(7)假手术组(Sham组)(Sham组与I/R组接受相同的手术过程,但不充起球囊,将穿刺后25 min作为拟再灌注开始时间)。再灌注后30 min,DMSO各组大鼠经尾动脉注入浓度5%的DMSO(0.3 ml);wortmannin各组注入wortmannin(DMSO终浓度5%,0.6 ml/kg,总容积0.3 ml);其余各组注入生理盐水(0.3 ml)。再灌注后1 h,氙气延迟后处理各组大鼠经呼吸机吸入50%氙气+50%氧气混合气1 h;其余各组吸入50%氮气+50%氧气混合气1 h。模型成功建立标准:再灌注后4 h大鼠存活,且出现后肢运动功能不全(后肢运动功能评分<21分)。
标本取材:每组16只大鼠随机于再灌注后4 h和48 h经深麻醉处死,每时间点8只。将大鼠深麻醉后,开胸经左心室灌注200 ml冰盐水至灌洗液清亮,迅速取出脊髓,脊髓L3~L4节段置于4℃4%的多聚甲醛中固定,备行石蜡包埋切片(4 μm),进行尼氏及TUNEL染色使用,脊髓L4~L5节段放置于-80℃液氮中贮存,进行蛋白印迹法(Westernblot) 检测。
后肢运动功能评分:采用盲法于再灌注后6、12、24和48 h分别对实验动物进行后肢运动功能评分并录像,使用BBB(Basso, Beattie and Bresnahan)后肢运动功能评分表[8]。BBB评分从0分(神经功能完全缺失)到21分(神经功能正常)。
尼氏染色和神经元细胞计数:采用盲法在400倍光镜下观察并记录尼氏染色切片,每个脊髓节段随机抽取3张切片,取3张切片平均值,计数正常神经元。每组8只大鼠。
脊髓组织TUNEL染色:采用盲法在400倍光镜下观察记录TUNEL染色切片,每个脊髓节段随机抽取3张切片,取3张切片平均值,计数正常神经元。每组8只大鼠。采用TUNEL检测试剂盒(ZK-8005,北京中杉金桥生物技术有限公司)测定神经元细胞凋亡情况。凋亡神经细胞经TUNEL染色细胞核中有深染棕褐色颗粒。
p-Akt蛋白印迹法检测:脊髓组织匀浆用蛋白定量试剂盒(BCA法)行蛋白定量并调整待测样本的蛋白浓度,配制分离胶(12%),浓缩胶(5%),精确完成蛋白上样、电泳、转膜和抗原封闭。使用3% BSA-TBST稀释一抗(p-Akt,1:2 000),孵育,洗膜。5%脱脂奶粉-TBST稀释二抗[山羊抗兔lgG(H+L)HRP,1:20 000],室温轻摇40 min,洗膜。X光胶片曝光显影、定影。分别检测再灌注后4 h和48 h时点脊髓组织中p-Akt表达水平。
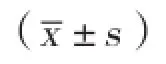
2 结果
生理参数(表1):阻断前、阻断后5 min、再灌注后15 min各组大鼠肛温、近端血压、阻断前和再灌注后15 min远端血压行组内、组间比较,差异无统计学意义(P>0.05)。各组大鼠远端血压在阻断后5 min进行组间比较,差异无统计学意义(P >0.05),各组(Sham组除外)大鼠阻断后5 min远端血压与同组阻断前远端血压比较显著降低, 差异均有统计学意义(P <0.05)。表2显示:各组阻断前10 min、再灌注后15 min所测血气分析结果行组内、组间比较,差异均无统计学意义(P>0.05)。
表1 实验过程中的生理参数
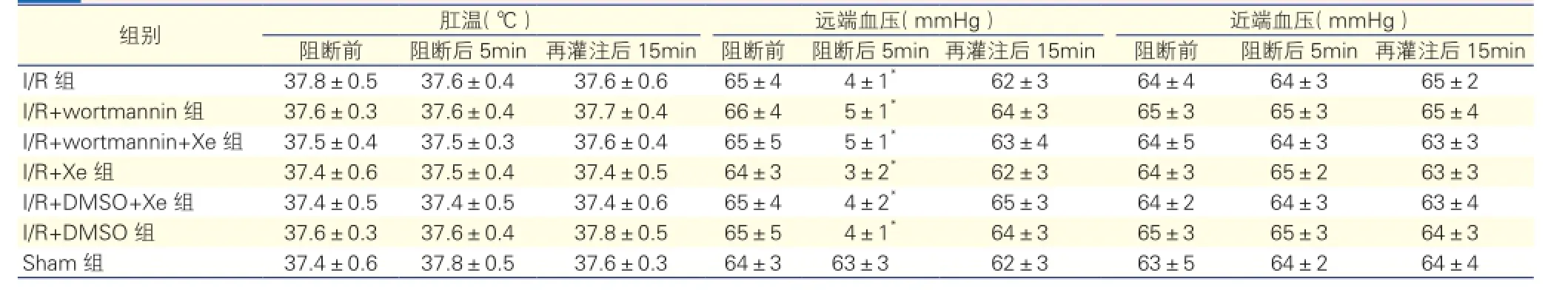
表1 实验过程中的生理参数
注: I/R组:脊髓缺血再灌注组;I/R+Xe组:脊髓缺血再灌注+氙气延迟后处理组;I/R+wortmannin组:脊髓缺血再灌注+PI3K/Akt阻断剂渥曼青霉素组;I/ R+DSMO组:脊髓缺血再灌注+阻断剂溶剂二甲基亚砜(DMSO)组;I/R+wortmannin+Xe组:脊髓缺血再灌注+PI3K/Akt阻断剂wortmannin+氙气延迟后处理组;I/R+DMSO+Xe组:脊髓缺血再灌注+阻断剂溶剂DMSO+氙气延迟后处理组;Sham组:假手术组。与阻断前血压比较*P<0.05 。1 mmHg=0.133 kPa
?
表2 阻断前和再灌注后动脉血气分析结果

表2 阻断前和再灌注后动脉血气分析结果
注:pH:酸碱度 PaO2:氧分压 PaCO2:二氧化碳分压。余注见表1
?
后肢运动功能评分(表3):Sham组大鼠后肢运动功能评分(21.0±0.2)分。其余各组大鼠在麻醉恢复后6、12、24、48 h后肢运动功能评分显著降低,与Sham组比较差异有统计学意义(P<0.05)。与I/R组大鼠相比,I/R+Xe组和I/ R+DMSO+Xe组后肢运动功能评分在各个时间点均显著提高,I/R+wortmannin组和I/R+wortmannin+Xe 组显著降低,差异均有统计学意义(P<0.05)。与I/R+Xe组大鼠相比,I/R组、 I/R+wortmannin组、I/R+wortmannin+Xe组及I/R+DMSO组后肢运动功能评分在各个时间点均显著降低(P<0.05)。
脊髓组织学改变、脊髓细胞凋亡计数、脊髓组织中p-Akt蛋白印迹法检测(表4): Sham组4 h和48 h脊髓组织可见大量正常神经元,其余各组脊髓组织中正常神经元数量显著减少、凋亡神经元数量显著增加、p-Akt水平显著增高,与Sham组比较,差异均有统计学意义(P<0.05)。与I/R组相比,I/R+Xe组和I/R+DMSO+Xe组的4 h和48 h脊髓组织正常神经元数量显著增多、凋亡神经元数量显著减少、p-A k t水平
表3 后肢运动功能评分结果
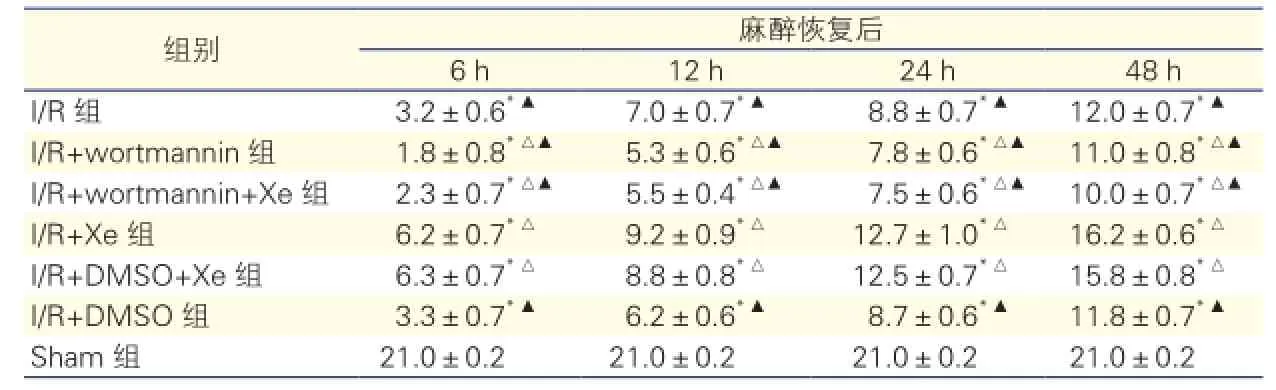
表3 后肢运动功能评分结果
注:与Sham组比较*P<0.05;与I/R组比较△P<0.05;与I/R+Xe组比较▲P<0.05。余注见表1
?
显著增高;I/R+wortm annin组和I/R+wortmannin+Xe组的4 h和48 h脊髓组织正常神经元数量显著减少、凋亡神经元数量显著增加、p-Akt水平显著降低(P<0.05)。与I/R+Xe组相比,I/R组、I/R+wortmannin组、I/R+wortmannin+Xe组和I/R+DMSO组4 h和48 h脊髓组织切片中正常神经元数量显著减少、凋亡神经元数量显著增加、p-Akt水平显著降低(P<0.05)。
表4 脊髓前角运动神经元数量、脊髓前角运动神经元凋亡数量、蛋白免疫印迹法脊髓组织p-Akt定量

表4 脊髓前角运动神经元数量、脊髓前角运动神经元凋亡数量、蛋白免疫印迹法脊髓组织p-Akt定量
注:Akt:蛋白激酶B。与Sham组比较*P<0.05;与I/R组比较△P<0.05;与I/R+Xe组比较▲P<0.05。余注见表1
?
3 讨论
研究证实,再灌注后1 h吸入50%氙气+50%氧气混合气体,对脊髓缺血再灌注损伤发挥最大保护作用[5]。大鼠脊髓缺血再灌注后4 h p-Akt达到表达高峰,12 h降至低谷;神经元再灌注后4 h出现凋亡,48 h凋数量最多[9]。因此,选择再灌注后4 h和48 h进行正常神经元、凋亡神经元计数及蛋白定量分析。正常的神经细胞胞浆中富含尼氏体,而受损的神经细胞胞浆中尼氏体数量下降,染色质深染,细胞核固缩。凋亡的神经细胞经TUNEL染色呈棕褐色。结果显示,氙气延迟后处理对大鼠脊髓缺血再灌注损伤有保护作用,BBB后肢运动功能评分显著增高,神经元存活数量显著增加,细胞凋亡显著减少,Akt信号通路被激活,p-Akt表达增加,加入Akt通道阻断剂wortmannin后这一保护作用被抑制。在实验过程中因实验条件限制,标本无法在取材同时完成检测,可能导致结果显著性降低。
研究表明,氙气可以减少缺血再灌注损伤模型中神经元的死亡,改善神经认知和神经功能障碍[4]。Fries 等[10]用猪心肺复苏模型证实,70%氙气于再灌注1 h行延迟后处理具有神经保护效应。Campos-Pires等[11]证实,氙气对休克脑缺血模型发挥延迟后处理保护作用的时间窗长达3 h。氙气的神经保护作用机制被认为与直接抑制N,N-二甲基亚硝胺受体(NMDA site)介导的兴奋毒性、兴奋细胞膜双孔钾通道及细胞膜三磷酸腺苷敏感钾通道等有关[4]。但氙气延迟后处理发挥脊髓缺血再灌注损伤保护作用的机制仍有待研究。
Bcl-2/Bax被认为是PI3K-Akt的下游效应因子。研究证实,氙气通过调节Bcl-2/bax的表达发挥延迟后处理对大鼠脊髓缺血再灌注的保护作用[5]。PI3K-Akt 信号通路参与调控多种影响细胞生存的转录因子,如环磷腺苷效应元件结合蛋白(CREB) 和核因子(NF)-κB和Forkhead 1等。CREB和NF-κB 的激活可增强抗凋亡基因Bcl-2 的表达。同时,PI3K-Akt可抑制促凋亡基因Bad 的表达。有研究指出,在全脑和局部脑缺血再灌注后均有暂时的Akt磷酸化的增强[12]。还有研究证实,局部脑缺血再灌注损伤模型缺血后处理可通过激活PI3K-Akt 信号通路产生长时程脑保护效应[13]。目前,仍很少有研究观察和分析氙气的神经保护作用与PI3K-Akt通路的关系。本研究结果证实,氙气延迟后处理对大鼠脊髓缺血再灌注的保护作用是通过PI3K-Akt通路发生作用的。
细胞凋亡的机制涉及多个方面,如线粒体膜通透性及钙离子水平等[14]。有研究表明,药物预处理及后处理均通过线粒体渗透性转运孔(mPTP)发挥对心肌缺血再灌注损伤的保护作用[15]。另一项研究指出,氙气预处理可以通过激活促存活信号(p-Akt)从而促进线粒体的存活[16]。在心肌缺血再灌注损伤后处理模型中,p-Akt 在mPTP 处高表达[17]。氙气延迟后处理激活Akt 信号通路是否通过进一步抑制mPTP 活性发挥保护作用仍有待进一步研究证实。
综上所述,氙气延迟后处理可以通过诱导Akt通路活化产生大鼠脊髓缺血再灌注损伤保护作用。
[1] 易定华 , 段维勋 . 中国主动脉夹层诊疗现状与展望 . 中国循环杂志, 2013, 28: 1-2.
[2] Nienaber CA, Clough RE. Management of acute aortic dissection. Lancet, 2015, 385: 800-811.
[3] Dezfulian C, Garrett M, Gonzalez NR, et al. Clinical application of preconditioning and postconditioning to achieve neuroprotection. Transl Stroke Res, 2013, 4: 19-24.
[4] Morais R, Andrade L, Lourenço A, et al. How xenon works: neuro and cardioprotection mechanisms. Acta Med Port, 2014, 27: 259-265.
[5] Campos-Pires R, Armstrong SP, Sebastiani A, et al. Xenon improves neurologic outcome and reduces secondary injury following trauma in an in vivo model of traumatic brain injury. Crit Care Med, 2015, 43: 149-158.
[6] Hausenloy DJ, Yellon DM. Preconditioning and postconditioning: united at reperfusion, Pharmacol Ther, 2007, 116: 173-191.
[7] Yang YW, Cheng WP, Lu JK, et al. Timing of xenon-induced delayed postconditioning to protect against spinal cord ischaemia-reperfusion injury in rats. Br J Anaesth, 2014, 113: 168-176.
[8] Basso DM, Beattie MS, Bresnahan JC, et al. A sensitive and reliable locomotorrating scale for open field testing in rats. Neurotrauma, 1995, 12: 1-21.
[9] 侯思雨, 杨彦伟, 程卫平, 等. 大鼠脊髓缺血再灌注损伤后ERK、Akt的表达与细胞凋亡研究关系. 心肺血管病杂志, 2015, 34: 62-64.
[10] Fries M, Nolte KW, Coburn M, et al. Xenon reduces neurohistopathological damage and improves the early neurological deficit after cardiac arrest in pigs. Crit Care Med, 2008, 36: 2420-2426.
[11] Campos-Pires R, Armstrong SP, Sebastiani A, et al. Xenon improves neurologic outcome and reduces secondary injury following trauma in an in vivo model of traumatic brain injury. Crit Care Med, 2015, 43: 149-158.
[12] Zhao H. Ischemic postconditioning as a novel avenue to protect against brain injury after stroke. Cereb Blood Flow Metab, 2009, 29: 873-885.
[13] Gao X, Ren C, Zhao H, et al. Protective effects of ischemic postconditioning compared with gradual reperfusion or preconditioning. Neuro sci Res, 2008, 86: 2505-2511.
[14] 王耀晟 , 邹循锋 , 鲍晓明 , 等 . 去铁敏在大鼠心肌细胞原代培养中的保护性应用 . 中国循环杂志 , 2009, 24: 387-390.
[15] Lim SY, Davidson SM, Yellon DM, et al. Preconditioning and postconditioning: The essential role of the mitochondrial permeability transition pore. Cardiovasc Res, 2007, 75: 530-535.
[16] Mio Y, Shim YH, Richards E, et al. Xenon preconditioning: the role of prosurvival signaling, mitochondrial permeability transition and bioenergetics in rats. Anesth Analg, 2009, 108: 858-866.
[17] Juhaszova M, Zorov DB, Kim SH, et al. Glycogen synthase kinase-3beta mediates convergence of protection signaling to inhibit the mitochondrial permeability transition pore. Clin Invest, 2004, 113: 1535-1549.
The Protective Roll of Xenon Delayed Post-conditioning Via AKT Signal Pathway Activation in Spinal Cord Ischemia/Reperfusion Injury in Rats
LIU Shi-yao, HOU Si-yu, YANG Yan-wei, WANG Xiao-nan, JING-mu, DONG Xiu-hua, LU Jia-kai, CHENG Wei-ping.
Department of Anesthesiology, Anzhen Hospital, Capital Medical University, Beijing (100029), China
Objective: Spinal cord ischemia/reperfusion (I/R) injury may lead spinal cord functional impairment and paraplegia, and we want to investigate the protective roll of xenon (Xe) delayed post-conditioning via protein kinase B (Akt) signal pathway activation in spinal cord I/R injury in experimental rats.Methods: A total of 112 male SD rats were divided into 7 groups: ①I/R group,②I/R+Xe group,③I/R+wortmannin (PI3K-Akt blocker) group,④I/R+DMSO (solvent) group,⑤I/R+wortmannin+Xe group,⑥I/R+DMSO+Xe group,⑦Sham group. n=16 in each group. The excise function in hind legs of rats were observed at 6, 12, 24, 48 hours after treatment; the survival neuron was examined by Nissl staining and TUNEL staining at 4, 48 hours after treatment, and the protein expression of p-Akt in spinal cord was measured by Western blot analysis.Results: Compared with Sham group, all other groups showed obviously decreased excise function in hind legsof rats with less spinal motor neurons, more apoptosis and lower protein expression of p-Akt at each time point, P<0.05. Compared with I/R group, I/R+Xe group presented increased excise function in hind legs, more spinal motor neurons, less apoptosis and elevated protein expression of p-Akt P<0.05. Compared with I/R+Xe group, I/R+wortmannin+Xe group indicated decreased excise function in hind legs, less spinal motor neurons, more apoptosis and inhibited protein expression of p-Akt, P<0.05. While protein expression level was similar between I/R group and I/R+wortmannin+Xe group, P>0.05.Conclusion: Xenon delayed post conditioning may protect spinal cord I/R injury via Akt pathway activation in experimental rats.
Xenon; Delayed post-conditioning; Spinal cord; Ischemia reperfusion injury; AKT signal pathway
2015-02-12)
(编辑:汪碧蓉)
国家自然科学基金资助项目(81070975);卫生部行业专项基金(201402009)
100029 北京市,首都医科大学附属北京安贞医院 麻醉科
刘诗瑶 硕士研究生 研究方向:心血管麻醉及围术期脏器功能保护 Email:shiyao312@sina.com 通讯作者:程卫平
Email:ch_eng9735 @sina.com
R54
A
1000-3614( 2015 )05-0498-05
10.3969/ j. issn. 1000-3614. 2015.05.020
