二甲双胍降低2型糖尿病大鼠主动脉磷酸化丝裂原活化蛋白激酶的蛋白表达
2015-12-16陈丽莉范国洽韩蕊石志平王涛张洁王雪周亚茹
陈丽莉,范国洽,韩蕊,石志平,王涛,张洁,王雪,周亚茹
二甲双胍降低2型糖尿病大鼠主动脉磷酸化丝裂原活化蛋白激酶的蛋白表达
陈丽莉,范国洽,韩蕊,石志平,王涛,张洁,王雪,周亚茹
目的:探讨p38丝裂原活化蛋白激酶( MAPK)与2型糖尿病大鼠主动脉病变的关系及二甲双胍的干预作用。
方法:25只雄性Wistar大鼠随机分为对照组和实验组,实验组采用高脂高糖饲料喂养联合链脲佐菌素注射建立2型糖尿病大鼠模型。将成模糖尿病大鼠随机分为2组:2型糖尿病空白对照组(2型糖尿病组,n=7)、2型糖尿病+二甲双胍干预组(二甲双胍组,n=8)。二甲双胍组给予二甲双胍200 mg/kg灌胃8周,于干预末行腹腔葡萄糖耐量试验,次晨心尖取血并分离血清,全自动生化分析仪测定血糖、血脂等生化指标;放免法测定胰岛素水平;采用酶联免疫吸附方法测定血清细胞间黏附分子-1( ICAM-1), 血管细胞黏附分子-1(VCAM-1)和核因子-κB水平;取胸主动脉进行苏木素伊红(HE)染色,光镜下观察血管病理变化;免疫组化法检测大鼠胸主动脉磷酸化p38 MAPK、核因子-κB、单核细胞趋化蛋白-1蛋白的表达。
结果:(1)HE染色可见2型糖尿病组大鼠主动脉管壁结构层次不清,内膜增厚,内皮细胞肿大变性,中膜平滑肌细胞排列紊乱,胶原纤维增生。(2)与对照组相比,2型糖尿病组大鼠空腹胰岛素[(20.00 ± 5.91) mIU/L vs(11.34 ± 3.88)mIU/L]、核因子-κB [(170.22±21.53) μmol/L vs(78.68±12.15) μmol/L]、ICAM-1[(130.59±16.00) pg/ml vs(75.63±19.52)pg/ml]、VCAM-1 [(990.19±119.18) ng/ml vs(616.54±54.51) ng/ml]、总胆固醇 [(4.15±0.41) mmol/L vs(2.18±0. 93 ) mmol/L]、甘油三酯 [(1.83±0.40) mmol/L vs(0.81±0.27)mmol/L]、低密度脂蛋白胆固醇[(2.53±0.44) mmol/L vs (1.24±0.47)mmol/L]水平明显升高(P<0.05),胰岛素曲线下面积(30.78 ± 11.25)mIU·L-1·h vs(47.55 ± 5.23)mIU·L-1·h明显降低(P<0.05),主动脉磷酸化p38 MAPK、核因子-κB、MCP-1蛋白表达水平升高(P<0.05),差异均有统计学意义。(3)实验结束时二甲双胍组大鼠空腹血糖、空腹胰岛素、核因子-κB、单核细胞趋化蛋白-1、VCAM-1、甘油三酯、总胆固醇水平较2型糖尿病组明显降低(P< 0.05);二甲双胍组和2型糖尿病组间胰岛素曲线下面积无明显差异(P> 0.05)。二甲双胍组大鼠主动脉磷酸化p38 MAPK、核因子-κB、单核细胞趋化蛋白-1蛋白表达水平也较二甲双胍组明显降低(P<0.05),差异有统计学意义。
结论:p38 MAPK信号通路的激活在糖尿病大血管病变发生发展中起重要作用,二甲双胍通过降低p38 MAPK磷酸化水平、抑制炎症反应、调节脂代谢而起到血管保护作用。
糖尿病;动脉粥样硬化;p38丝裂原活化蛋白激酶;二甲双胍
(Chinese Circulation Journal, 2015,30:487.)
研究显示,动脉粥样硬化的病理改变与丝裂原活化蛋白激酶(MAPK)的过度激活有关[1,2]。磷酸化p38 MAPK通过启动核因子-κB,促进内皮细胞分泌血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)表达,加剧中性粒细胞和单核细胞与内皮细胞黏附,诱发血栓形成和血管再狭窄,介导动脉粥样硬化形成。
二甲双胍除能够有效降糖、降低胰岛素水平及增加胰岛素敏感性外,还有抗炎、抗氧化应激、改善血脂、改善血管内皮功能等作用[3-5]。本实验通过高糖、高脂饮食联合小剂量链脲佐菌素(STZ)制备2型糖尿病大鼠模型,继而采用二甲双胍进行干预治疗,实验结束后检测各组大鼠血糖、血脂等生化指标,血清核因子-κB、VCAM-1、ICAM-1水平变化及胸主动脉中磷酸化的p38 MAPK蛋白表达水平,探讨p38 MAPK与糖尿病动脉粥样硬化的关系及二甲双胍对2型糖尿病动脉粥样硬化的影响及其机制。
1 材料与方法
实验对象及分组:实验时间为2012-11至2013-08,25只体重80 g左右的4周龄Wistar雄性大鼠(SPF级,购自河北医科大学基础医学院动物实验中心),采用数字表法随机分为对照组(n=6)和实验组(n=19),对照组采用标准饲料喂养;实验组采用高脂高糖饲料喂养(含20%蔗糖、10%熟猪油、2.5%胆固醇、1%胆酸、66.5%标准饲料)。喂养4周后,实验组大鼠隔夜空腹腹腔注射STZ(美国Sigma公司,30 mg/kg,用前以柠檬酸缓冲液配成1%的浓度),对照组仅注射等容积的柠檬酸缓冲液。于实验的第6周即注射STZ 2周后,空腹8小时测血糖≥ 7.8 mmol/L者为糖尿病成模标准[6]。19只实验大鼠中造模成功者15只。将成模实验大鼠随机分为2组:2型糖尿病空白对照组(2型糖尿病组, n=7)、2型糖尿病+二甲双胍干预组(二甲双胍组,n=8,二甲双胍由中美上海施贵宝制药有限公司提供)。二甲双胍组给予二甲双胍200 mg/kg[7]溶于饮用水中灌胃,每日1次,对照组和2型糖尿病组给予等量饮用水灌胃,每周测体重1次,共8周,整个实验过程共持续14周。二甲双胍组有1只大鼠在实验过程中死亡(可能死于高血糖)。
观察指标及检测方法:二甲双胍干预第8周末,行腹腔葡萄糖耐量试验(禁食12 h,腹腔注射葡萄糖2 g/kg,在注射葡萄糖后0、30、60、90、120 min尾静脉采血),采用近似梯形的计算公式计算葡萄糖曲线下面积和胰岛素曲线下面积。次日麻醉下心尖取血,分离血清,检测血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、 核因子-κB、ICAM-1、VCAM-1水平。酶联免疫吸附试剂盒购自bio-swamp公司。碘[125I]胰岛素放射免疫分析药盒购自北京北方生物技术研究所。
取约1 cm胸主动脉以4%多聚甲醛固定,进行苏木素伊红(HE)染色,光镜下观察血管病理变化;免疫组化法测定胸主动脉中磷酸化的p38 MAPK、核因子-κB、单核细胞趋化蛋白-1的蛋白表达水平。兔抗大鼠单核细胞趋化蛋白-1、核因子-κB抗体购自武汉博士德生物公司,兔抗大鼠p38 MAPK单克隆抗体购自上海bioworld公司。
统计学分析:采用SPSS16.0统计软件进行分析,正态分布的数据以均数±标准差表示,非正态分布数据以中位数(最小值,最大值)表示。正态分布及方差齐性资料采用 t检验及单因素方差分析,组间两两比较采用 SNK-q 检验;不符合正态分布的资料,采用非参数检验。以P<0.05 为差异有统计学意义。
2 结果
实验结束时大鼠血清生化指标比较(表 1):2型糖尿病组和二甲双胍组大鼠空腹血糖水平较对照组明显升高(P<0.05),二甲双胍组空腹血糖较2型糖尿病组明显下降 [(9.03±1.49)mmol/L vs(12.99±2.07)mmol/L,P<0.05];2型糖尿病组和二甲双胍组葡萄糖曲线下面积水平明显高于对照组(P<0.05),但前两组组间葡萄糖曲线下面积比较无统计学意义(P>0.05)。2型糖尿病组大鼠空腹胰岛素明显高于对照组和二甲双胍组(P<0.05),对照组胰岛素曲线下面积水平明显高于2型糖尿病组和二甲双胍组(P<0.05),但2型糖尿病组和二甲双胍组的胰岛素曲线下面积水平比较差异无统计学意义(P>0.05)。2型糖尿病组和二甲双胍组大鼠TG 、TC、LDL-C、ICAM-1、VCAM-1、核因子-κB水平均明显高于对照组(P<0.05),二甲双胍组TG 、TC、ICAM-1、VCAM-1、核因子-κB水平低于2型糖尿病组(P<0.05);与对照组相比,2型糖尿病组和二甲双胍组HDL-C水平显著降低(P<0.05)。
表1 实验结束时三组大鼠血清生化指标
注:与对照组比*P<0.05;与2型糖尿病组比△P<0.05。#1只大鼠在实验过程中死亡
?
三组大鼠病理形态学比较(图1):对照组可见血管壁结构清晰,内膜光滑完整,平滑肌细胞排列整齐,内皮细胞结构完整。2型糖尿病组主动脉管壁结构层次不清,内膜增厚,中膜平滑肌细胞排列紊乱,胶原纤维增生血管壁弥漫性隆起,内膜明显增厚,内膜下平滑肌细胞排列紊乱、增生,内有脂质沉积,胶原纤维和弹性纤维增多。二甲双胍组血管内皮细胞基本完整,内膜偶有增厚,中膜平滑肌细胞排列基本整齐。
三组大鼠p38 MAPK、核因子-κB、单核细胞趋化蛋白-1蛋白表达的改变(图2):胸主动脉p38 MAPK、核因子-κB、单核细胞趋化蛋白-1蛋白表达于血管内膜细胞胞质内,呈棕黄色颗粒沉着。免疫组织化学表达积分见表2。与对照组相比,2型糖尿病组主动脉磷酸化p38 MAPK、核因子-κB、单核细胞趋化蛋白-1表达水平升高,差异有统计学意义(P<0.05);与2型糖尿病组相比,二甲双胍组主动脉磷酸化p38 MAPK、核因子-κB、单核细胞趋化蛋白-1表达水平降低(P<0.05)。

图1 各组大鼠主动脉苏木素伊红染色(×200倍)
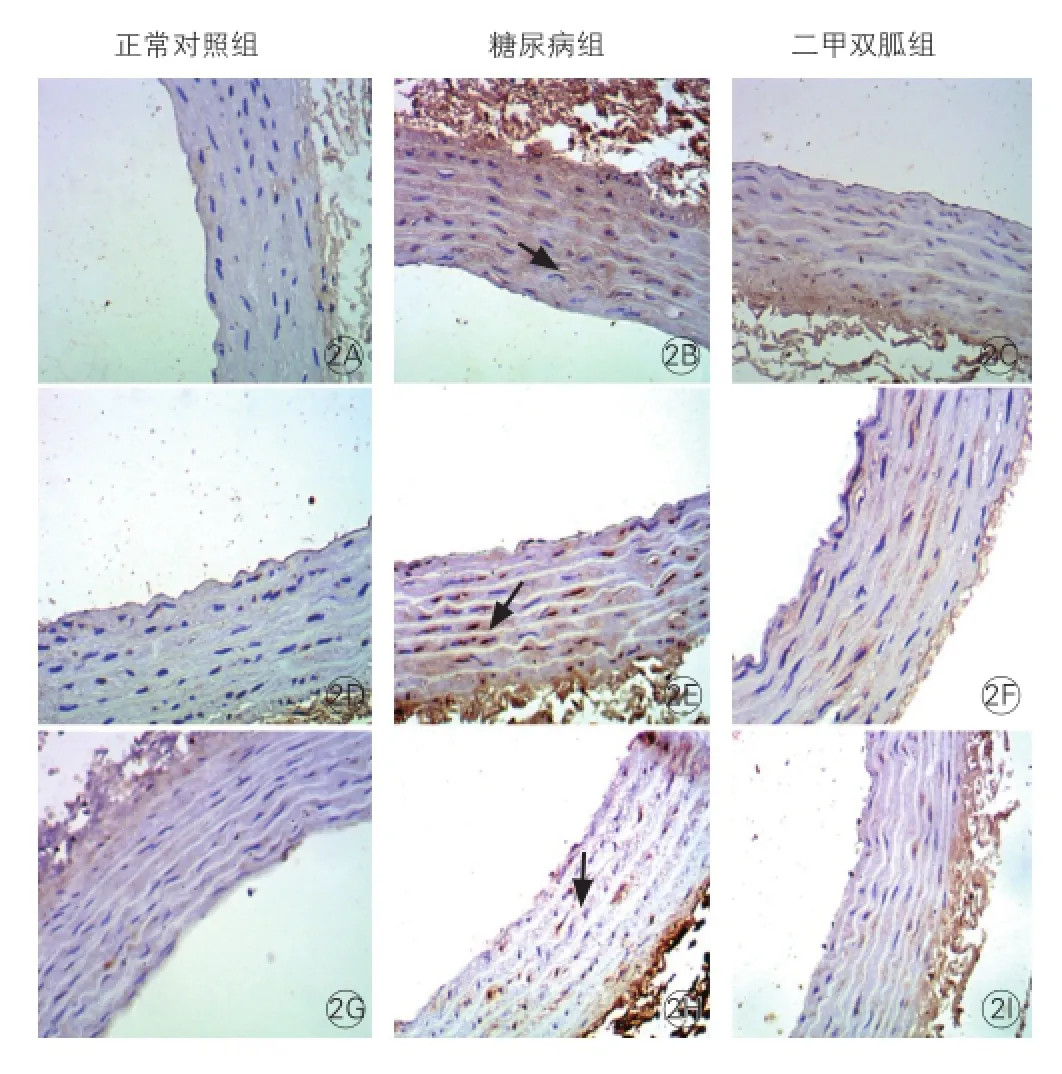
图2 三组大鼠主动脉中单核细胞趋化蛋白-1、 核因子-κB、p38丝裂原活化蛋白激酶的表达(×200)
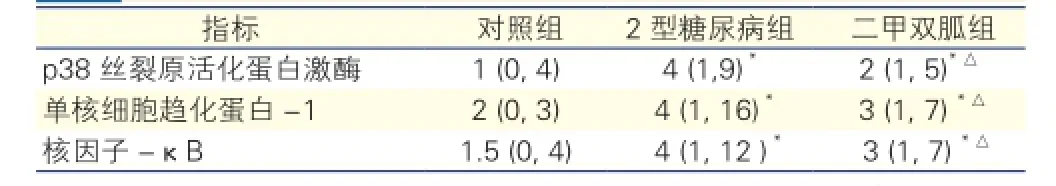
表2 三组大鼠免疫组化表达积分#
3 讨论
糖尿病大血管病变的病理基础为动脉粥样硬化,它与单纯的动脉粥样硬化相比病变范围大、程度重、发生早[8]。然而,糖尿病大血管病变的发病机理尚未完全阐明,目前认为,2型糖尿病大血管病变除与糖脂代谢紊乱有关外,尚与其他因素,如血管内皮功能损伤、炎症和氧化应激、 MAPK介导的信号转导通路激活有关[9,10]。 Yoon等[11]研究表明,晚期糖基化终末产物(AGE)可诱导血管平滑肌细胞增殖、形成活性氧簇,诱导核因子-κB、促MAPK信号转导通路的激活,从而使炎症因子的表达增加,血管内皮功能受损,导致糖尿病大血管病变的发生。上述研究提示,糖尿病大血管病变与炎症因子和内皮功能障碍有关。MAPK介导的信号转导通路是生物信号引起核反应的重要通路,在细胞生长、增殖、分化及凋亡的调节中起到至关重要的作用,动脉粥样硬化的病理改变与MAPK的过度激活有关[1,2],其中p38 MAPK通路与内皮细胞损伤关系密切,是参与炎症反应的细胞内的重要通路:非磷酸化的p38 MAPK通过磷酸化状态,促进下游底物磷酸化来快速实现信号传递,启动核因子-κB,促进内皮细胞分泌VCAM-1、ICAM-1,加剧中性粒细胞和单核细胞与内皮细胞黏附,诱发血栓形成和血管再狭窄,介导炎症反应,参与动脉粥样硬化形成。2型糖尿病患者存在的胰岛素抵抗、高血糖和(或)高游离脂肪酸水平、以及炎性细胞因子等均能激活p38 MAPK信号通路[12]。本实验中,2型糖尿病组大鼠胸主动脉HE染色可见主动脉发生了炎症和损伤,另外,2型糖尿病组大鼠主动脉p38 MAPK蛋白表达水平及血清中核因子-κB、VCAM-1、ICAM-1水平明显升高,说明p38 MAPK及炎症因子参与了2型糖尿病大血管病变的发生、发展。
本实验结果显示,二甲双胍组空腹血糖较2型糖尿病组明显降低,但葡萄糖曲线下面积无统计学差异,可能与二甲双胍主要通过减少肝糖输出降低空腹血糖,但对餐后血糖作用较弱有关。胰岛素曲线下面积在2型糖尿病组有明显的降低,可能与糖尿病时高糖状态对胰岛β细胞的抑制状态有关。同时,本实验发现,相对于2型糖尿病组,二甲双胍组可见到胰岛素曲线下面积有增加的趋势,可能与二甲双胍抑制肝糖输出、促进葡萄糖的摄取和利用,降低空腹血糖、改善葡萄糖负荷后血糖,一定程度改善胰岛β细胞分泌功能有关。
现有研究认为,有效地控制血糖可延缓但不能防止2型糖尿病患者大血管并发症的发生,这可能与2型糖尿病患者常合并血脂代谢异常、高血压,存在氧化应激、凝血及纤溶系统紊乱等因素有关[13,14]。研究表明,二甲双胍能改善血脂水平、抑制氧化应激和黏附分子的形成,能够抗炎、改善血管内皮功能并激活纤溶系统,具有降糖以外的大血管保护作用[3-5]。本实验证实,二甲双胍组的血清TC、TG、核因子-κB、VCAM-1、ICAM-1水平较糖尿病组明显降低,且胸主动脉组织炎细胞浸润等情况明显改善,进一步说明二甲双胍除降糖外,还可起到改善血脂、抗炎、改善血管内皮功能等作用,从而改善糖尿病大血管病变。本研究还发现,与实验组相比,二甲双胍组p38 MAPK、核因子-κB、单核细胞趋化蛋白-1表达水平明显下降,与Tseng 等[15]的研究结果一致,说明二甲双胍可能通过下调血管p38 MAPK的表达、抑制p38 MAPK信号转导通路,阻断白细胞介素、肿瘤坏死因子、黏附分子及炎性介质的释放,从而有效改善糖尿病大鼠主动脉粥样硬化情况,发挥对糖尿病大血管病变的保护作用。
总之,p38 MAPK参与了糖尿病大血管病变的发生。通过干预p38 MAPK信号转导通路中的某些环节可缓解糖尿病大血管病变的发生、发展。二甲双胍除降糖作用外,还可通过下调血管p38 MAPK磷酸化水平、抑制炎症反应、调节脂代谢,发挥对糖尿病大血管的保护作用。
[1] Liu Y, Liang C, Liu X, et al. AGEs increased migration and inflammatory responses of adventitial fibroblasts via RAGE, MAPK and NF-kappaB pathways. Atherosclerosis, 2010, 208: 34-42.
[2] Zhang R, Zhou SJ, Li CJ, et al. C-reactive protein/oxidised low-density lipoprotein/β2-glycoprotein I complex promotes atherosclerosis in diabetic BALB/c mice via p38 mitogen-activated protein kinase signal pathway. Lipids Health Dis, 2013, 12: 42-53.
[3] Lu J, Ji J, Meng H, et al. The protective effect and underlying mechanism of metformin on neointima formation in fructose-induced insulin resistant rats. Cardiovasc Diabetol, 2013, 12: 58.
[4] Ghatak SB, Dhamecha PS, Bhadada SV, et al. Investigation of the potential effects of metformin on atherothrombotic risk factors in hyperlipidemic rats. Eur J Pharmacol, 2011, 659: 213-223.
[5] Ishibashi Y, Matsui T, Takeuchi M, et al. Metformin inhibits advanced glycation end products (AGEs)-induced renal tubular cell injury by suppressing reactive oxygen species generation via reducing receptor for AGEs (RAGE) expression. Horm Metab Res, 2012, 44: 891-895.
[6] 郭啸华, 刘志红, 李恒, 等. 高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点. 中国糖尿病杂志, 2002, 10: 35-39.
[7] Kravchuk E, Grineva E, Bairamov A, et al. The effect of metformin on the myocardial tolerance to ischemia-reperfusion injury in the rat model of diabetes mellitus typeⅡ. Exp Diabetes Res, 2011, 2011: 907496.
[8] Keymel S, Heinen Y, Balzer J, et al. Characterization of macro-and microvascular function and structure in patients with type 2 diabetes mellitus. Am J Cardiovasc Dis, 2011, 1: 68-75.
[9] Zhang X, Song Y, Han X, et al. Liquiritin attenuates advanced glycation end products-induced endothelial dysfunction via RAGE/ NF-κB pathway in human umbilical vein endothelial cells. Mol Cell Biochem, 2013, 374: 191-201.
[10] 王芳, 赵学礼. 2型糖尿病大血管病变与血清脂联素及炎症因子关系的研究. 中国循环杂志, 2009, 24: 45-47.
[11] Yoon SJ, Yoo YW, Lee BK, et al. Potential role of HMG-CoA reductase inhibitor on oxidative stress induced by advanced glycation endproducts in vascular smooth muscle cells of diabetic vasculopathy. Exp Mol Med, 2009, 41: 802-811.
[12] Liu Z, Cao W. p38 mitogen-activated protein kinase: a critical node linking insulin resistance and cardiovascular diseases intype 2 diabetes mellitus. Endocr Metab Immune Disord Drug Targets, 2009, 9: 38-46.
[13] Stolar M. Glycemic control and complications in type 2 diabetes mellitus. Am J Med, 2010, 123: 3-7.
[14] 高岩, 纪立农, 刘晓宁, 等. 血浆中糖基化终级产物水平的升高与糖尿病周围大血管并发症的关系. 中国循环杂志, 2004, 19: 213-215.
[15] Tseng SC, Huang YC, Chen HJ, et al. Metformin-mediated downregulation of p38 mitogen-activated protein kinase-dependent excision repair cross-complementing 1 decreases DNA repair capacity and sensitizes human lung cancer cells to paclitaxel. Biochem Pharmacol, 2013, 85: 583-594.
Metformin Decreasing the Aortic p38 MAPK Protein Expression in Experimental Rats With Type 2 Diabetes Mellitus
CHEN Li-li, FAN Guo-qia, HAN Rui, SHI Zhi-ping, WANG Tao, ZHANG Jie, WANG Xue, ZHOU Ya-ru.
Department of Endocrinology, Third Hospital of Hebei Medical University, Shijiazhuang (050051), Hebei, China
Objective: To explore the relationship between p38 MAPK protein expression and macro vascular lesions in type 2 diabetes mellitus (DM) rats with the effect of metformin intervention.Methods: A total of 25 healthy male Wistar rats were randomly divided into 2 groups: Control group, the rats had normaldiet for 4 weeks and then received citrate buffer solution for modeling control, n=6. Experimental group, the rats received high fat diet for 4 weeks and then received streptozotocin injection for DM modeling, n=19; there were 15 rats successfully developed DM and randomly divided into 2 subgroups: DM control (DM-C) group, n=7 and DM + metformin group, n=8, in which DM rats received metformin 200 mg/kg·d for 8 weeks. At the end of intervention, intraperitoneal injections of glucose tolerance test ( IPGTT ) was performed, laboratory biochemical indexes and fasting insulin level were detected, protein expressions of nueclear factor (NF-κB), monocyte chemo-attractant protein-1(MCP-1) in the thoracic aorta were examined by immunohistochemistry.Results: ①HE staining showed that DM-C group had increased tunica intimae thickness, endothelia cell swollen, media smooth muscle disorder and collagen fiber hyperplasia.②Compared with Control group, DM-C group had increased levels of fasting insulin (20.00 ± 5.91) mIU/L vs (11.34 ± 3.88) mIU/L, NF-κB (170.22 ± 21.53) μmol/L vs (78.68 ± 12.15) μmol/L, ICAM-1 (130.59 ± 16.00) pg/ml vs (75.63 ± 19.52) pg/ml, VCAM-1 (990.19 ± 119.18) ng/ml vs (616.54 ±54.51) ng/ml, and increased TC (4.15 ± 0.41) mmol/L vs (2.18 ± 0.39) mmol/L, TG (1.83 ± 0.40) mmol/L vs (0.81 ± 0.27) mmol/L, LDL (2.53 ± 0.44) mmol/L vs (1.24 ± 0.47) mmol/L, P<0.05; while decreased AUCi (30.78 ± 11.25) mIU·L-1·h vs (47.55 ± 5.23) mIU·L-1·h, P<0.05; increased protein expressions of p38 MAPK, NF-κB and MCP-1, P<0.05.③Compared with DM-C group, DM + metformin group presented decreased levels of fasting insulin, NF-κB, ICAM-1, VCAM-1, TC, TG, P<0.05; increased aortic protein expressions of p38 MAPK, NF-κB and MCP-1; while AUCi was similar between 2 groups, P>0.05.Conclusion: The activation of p38 MAPK pathway plays an important role in DM macro angiopathy, metformin protects blood vessel via decreasing p38 MAPK level, inhibiting inflammatory reaction and regulating lipid metabolism in DM rats.
Diabetes mellitus; Atherosclerosis; p38 MAPK; Metformin
2014-09-08)
(编辑:漆利萍)
中华医学会临床科研专项资金(09010220177)
050051 河北省石家庄市,河北医科大学第三医院 内分泌二科(陈丽莉、范国洽、韩蕊、石志平、王雪、周亚茹), 心血管二科(王涛),河北省骨科生物力学重点实验室(张洁)
陈丽莉 硕士研究生 主要从事糖尿病并发症发病机制及干预研究 Email:chenlily163@163.com 通讯作者:周亚茹
Email:lzhouyaru@gmail.com
R541
A
1000-3614(2015)05-0487-05
10.3969/j.issn.1000-3614.2015.05.018
