高效液相色谱法测定喹噁林类药物对刺参组织DNA的氧化损伤
2015-12-13姜向阳邹荣婕徐英江宋向军宫向红刘慧慧田秀慧孙国华安红红张秀珍
姜向阳,邹荣婕′2,徐英江,宋向军,宫向红,刘慧慧,田秀慧,孙国华,刘 云,安红红,张秀珍′*
(1.山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室,山东 烟台 264006;2.烟台山水海产有限公司,山东 烟台 264006; 3.上海海洋大学食品学院,上海 201306)
高效液相色谱法测定喹噁林类药物对刺参组织DNA的氧化损伤
姜向阳1,邹荣婕1′2,徐英江1,宋向军1,宫向红1,刘慧慧1,田秀慧1,孙国华1,刘 云3,安红红3,张秀珍1′*
(1.山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室,山东 烟台 264006;2.烟台山水海产有限公司,山东 烟台 264006; 3.上海海洋大学食品学院,上海 201306)
为探索喹噁林类药物在刺参养殖中使用的安全性问题,采用高效液相色谱-紫外法对喹噁林类药物引起刺参组织DNA氧化损伤效应进行研究。采集经过不同添加剂量、不同时间喹噁林药物处理过的刺参组织,提取DNA,酶解后用高效液相色谱-紫外法对DNA氧化损伤标志物8-羟基脱氧鸟苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)进行测定分析。结果表明:高效液相色谱-紫外检测法,操作简单,具有广泛的适用性、稳定性和准确性,灵敏度高,并且样品用量少,分析速度快。8-OHdG的含量随着乙酰甲喹质量浓度的增加和处理时间的延长而显著增加(P<0.05),存在质量浓度-反应、时间-反应关系,并且是一个持续性的过程。喹烯酮对DNA的氧化损伤也是随着添加剂量的增加而显著加重(P<0.05)。说明乙酰甲喹和喹烯酮能引起刺参组织DNA的氧化损伤,对其遗传物质具有一定的遗传毒性,因此需要规范喹噁林类药物在刺参养殖中的使用。关键词:喹噁林;刺参;DNA氧化损伤;高效液相色谱法
DNA氧化损伤是指由活性氧自由基(reactive oxygen species,ROS)损伤DNA碱基而产生了DNA加合物,从而造成DNA分子损伤。8-羟基脱氧鸟苷(8-hydroxy-2’-deoxguanosine,8-OHdG)是DNA氧化损伤的主要修饰产物之一,其分子式为C10H13N5O5,主要是由化学致癌物代谢活化和电离辐射等过程产生的大量活性氧簇直接攻击DNA中的鸟嘌呤,使脱氧鸟苷(deoxyguanosine,dG)氧化为8-OHdG[1],见图1。8-OHdG一旦避开了机体自身修复,就可能成为致突变、致畸、致癌的启动因子。8-OHdG在体内稳定存在,为代谢终产物,只能通过DNA氧化损伤途经形成,因此8-OHdG的含量可反映体内DNA的氧化损伤程度,被公认为是20多种DNA氧化损伤产物中最主要的标记物之一[2]。因此测定机体8-OHdG含量对评估体内氧化损伤程度、氧化应激与DNA损伤的相互关系具有重要意义。
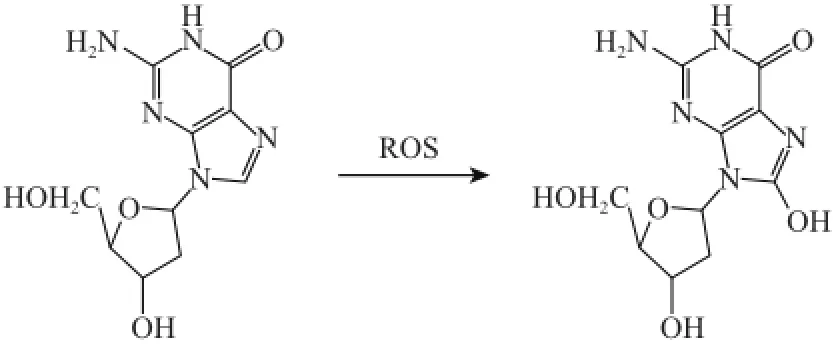
图1 8-OHdG的形成Fig.1 8-OHdG formation by oxygen radicals
喹噁啉类药物是指具有喹噁啉-Nl,N4-二氧化物基本结构的一类化学合成的具有抗菌和促生长作用的动物专用药,主要包括卡巴氧、喹乙醇、喹赛多、喹烯酮和乙酰甲喹等,喹烯酮和乙酰甲喹是国内独立合成的喹噁啉类新兽药[3-4]。喹烯酮化学名称为3-甲基-2-苯乙烯酮基-喹噁林-1,4-二氧化物,分子式为C18H14N2O3,结构式如图2A所示,该药物可促进动物生长并提高饲料转化率,对多种肠道致病菌(特别是革兰氏阴性菌)有抑制作用。乙酰甲喹化学名称为3-甲基-2-乙酰基喹噁林-1,4-二氧化物,分子式为C11H10N2O3,结构式如图2B所示,该药物为广谱抗菌药,对革兰氏阴性菌作用强于阳性菌,对密螺旋体作用较强,且该类药物能显著促进动物生长。
刺参作为名贵的滋补良品和美膳佳肴,具有很高的营养价值和药用价值,市场需求量日益增大,促进了刺参养殖业的迅速发展。随着工厂化养殖的迅猛发展,药物的使用更为频繁,对药物的安全性应该更为关注[5]。研究表明喹乙醇、乙酰甲喹等喹噁啉类药物具有致突变作用和潜在的致癌作用[6],因此该类药物的安全性问题逐渐受到重视。本实验以药浴乙酰甲喹、饲喂含有喹烯酮药物的刺参为研究对象,采用酶解法将DNA裂解后,用高效液相色谱-紫外(high performance liquid chromatographyultraviolet,HPLC-UV)法测定刺参样品中8-OHdG含量,以此反映样品DNA的氧化损伤程度,从分子水平研究该类药物对刺参遗传毒性,探讨该类药物在刺参养殖过程中使用的安全性。

图2 乙酰甲喹(A)和喹烯酮(B)的结构式Fig.2 Chemical structures of MEQ and QCT
目前8-OHdG的检测方法主要有:32P后标记法、酶联免疫吸附法、高效液相色谱-电化学分析法、气相色谱-质谱分析法、高效毛细管电泳法、超高效液相色谱-串联质谱法、HPLC-UV分析法等[2,7],本实验采用HPLC-UV法,该方法操作简单,具有广泛的适用性、稳定性和准确性,灵敏度高,样品用量少,分析速度快。
1 材料与方法
1.1 材料与试剂
实验刺参幼参由山东省海洋与渔业厅黄河三角洲海洋渔业科研推广中心提供,选取大小均一,平均体质量0.6 g左右的幼参,于300 L塑料水槽中(水体体积为250 L)暂养7 d后随机分组用于实验。
dG(CAS号:312693-72-4,纯度≥99%)、脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNase Ⅰ)、碱性磷酸酶、蛋白酶K、乙酸铵(分析纯)、苯酚(分析纯)、氯仿(分析纯) 生工生物(上海)股份有限公司;8-OHdG(CAS号:88847-89-6,纯度≥98%)、蛇毒磷酸二酯酶 美国Sigma公司;喹烯酮、乙酰甲喹 山东康乐动物保健有限公司;磷酸二氢钾(分析纯) 天津永达化学试剂有限公司;甲醇(色谱纯) 德国Meker公司;超纯水(由超纯水仪制备)。
1.2 仪器与设备
UltiMate 3000高效液相色谱仪(配有二极管阵列检测器) 美国Thermo公司;Milli-Q Gradient超纯水仪 法国Millipore公司;小型台式冷冻离心机 德国Eppendorf公司;金属浴 杭州博日公司。
1.3 方法
暂养后的刺参幼参随机分为11 组,每组设3 个平行,每个水槽500 头刺参。乙酰甲喹用药方式为每次换水后直接泼洒到水体中,质量浓度分别为0.5、1、2、4、6 mg/L;喹烯酮用药方式为拌饵料投喂,添加量为10、20、50、80、100 mg/kg饵料,每天按照刺参生物量的5%投喂,最后一组为对照组。实验期间水温与实际保苗生产水温一致,变化范围为18~26 ℃。溶解氧保持在6~8 mg/L,24 h持续充气,pH值为7.8~8.2,盐度为30~32。实验随机抽取饲养了52 d时刺参样品进行测定,检测不同质量浓度乙酰甲喹和喹烯酮对刺参DNA氧化损伤程度的影响;随机抽取药浴于4 mg/L乙酰甲喹7、12、20、32、40、52、66 d的刺参DNA进行8-OHdG含量的测定,检验药浴时间长短对刺参DNA氧化损伤程度的影响。1.3.1 溶液的配制
dG标准贮备液配制:精确称取10 mg dG标准品用超纯水溶解并定容至100 mL,配成100 μg/mL的标准贮备液,置4℃冰箱保存,有效期2 个月。
8-OHdG标准贮备液配制:将1mg 8-OHdG标准品用超纯水溶解并定容至10 mL,配成100 μg/mL的标准贮备液,置4 ℃冰箱保存,有效期2 个月。
dG和8-OHdG混合标准中间液配制:分别移取1 mL的dG和8-OHdG标准贮备液,于10 mL容量瓶中,用超纯水定容至刻度,配成0.05~10 μg/mL的混合标准工作液,置4 ℃冰箱保存,有效期1 个星期。
1.3.2 DNA的提取
分别随机抽取每组实验中活性良好的刺参5 头,取其体壁(含肌肉)组织,提取总DNA。DNA提取采用优化过的CTAB法[8]:取200 mg刺参组织样品用液氮磨至粉状,加入700 μL 65 ℃预热的CTAB提取缓冲液,同时加入8 μL 20mg/mL的蛋白酶K,置于55 ℃水浴槽,水解3~5 h,其间每0.5h轻轻摇动,直至裂解澄清。然后加入700 μL苯酚-氯仿(1∶1,V/V),颠倒2~3 min,使两者混合均匀,12 000 r/min离心15 min,取上清液,加入等体积氯仿混匀2~3 min。离心,重复上步直至上清液澄清无浑浊,取上清液,再加入2 倍体积的无水乙醇,—20 ℃沉淀2 h,离心,晾干沉淀,加入50 μL超纯水溶解。
1.3.3 DNA的氧化损伤实验
参考孙咏梅等的方法[9],将50 μL对照组刺参DNA中加入50 μL磷酸缓冲溶液(pH 6.8、10 mmol/L),95 ℃加热10 min后,冰上骤冷3 min,加入50 μL FeSO4(1.3 mmol/L)、50 μL乙二胺四乙酸(ethylenediamine tetraacetic,EDTA)(6.5 mmol/L)后,再加入50 μL H2O2(100 mmol/L),37 ℃反应2 h,通过Fenton反应产生•OH以攻击DNA样品,进而产生8-OHdG。
1.3.4 DNA酶解过程
DNA酶解参考宋玉玲等[10]的方法,将提取的50 μL DNA样品溶液中加入10 U的DNase Ⅰ、20 U的碱性磷酸酶以及0.05 U蛇毒磷酸二酯酶,轻微振荡混匀后在37 ℃条件下避光酶解24 h。酶解反应完成后′用0.45 μm滤膜过滤,滤液供HPLC分析。
1.3.5 HPLC条件
色谱柱为ODS-3(4.6 mm×250 mm,5 μm);柱温30 ℃;检测波长300 nm;流速1.0 mL/min;进样量20 μL;流动相为甲醇- KH2PO4溶液(50 mmol/L,pH 3.5)(7∶93,V/V),等度洗脱。
1.4 数据分析
HPLC采用外标法定量,数据结果用SPSS 13.0统计软件进行单因素方差分析,最小显著差法进行多重比较。
2 结果与分析
2.1 色谱条件的确定
色谱条件采用汪莉君等[11]的方法并结合仪器和色谱柱情况略加改进,对流动相中甲醇与50 mmol/L KH2PO4(pH 3.5)的比例进行优化调整,最后确定的比例为体积比7∶93,由图3可看出,dG和8-OHdG峰形良好,且与杂质峰能获得良好分离。8-OHdG的质量浓度在0.05~10 μg/mL范围内,线性良好,8-OHdG的线性方程为:Y=0.000 5X+0.006 8(R2=1.000 0)。取50 ☒L质量浓度为0.05 mg/L,标准混合工作液,经1.3.4节方法处理,HPLC分析后,RSN不小于3条件下确定方法的检出限为0.05 ☒g/mL。
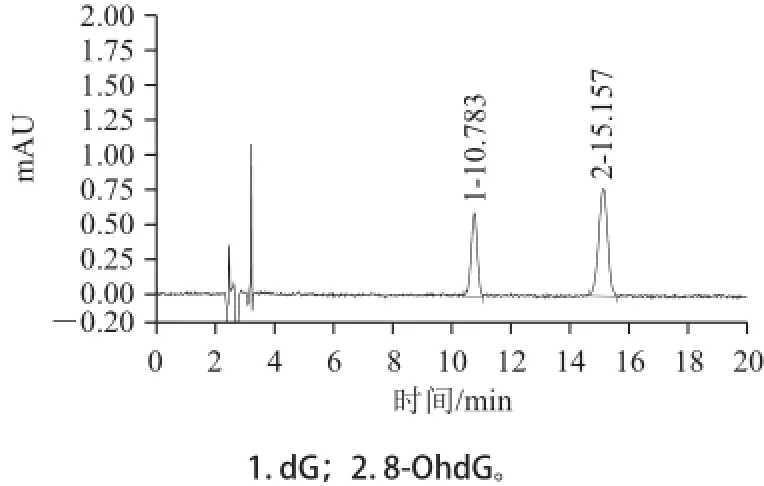
图3 标准品色谱图Fig.3 Liquid chromatograms of dG and 8-OhdG standards
2.2 方法的回收率、精密度和8-OHdG的确定
分别取50 μL质量浓度为0.05、0.25、1.0 mg/L的标准混合工作液,经1.3.4节方法处理后,用于HPLC分析,进行回收率测定。结果显示,dG和8-OHdG的回收率为91.3%~99.5%,批内相对标准偏差(relative standard deviation,RSD)和批间RSD均小于4%,说明该方法能够准确测定刺参组织样品酶解液中dG和8-OHdG的含量。在优化好的条件下,将氧化损伤实验得到的样品重复测定6 次,记录色谱峰的保留时间和峰面积,测得的8-OHdG的平均保留时间为15.185 min,峰面积的平均值为0.273 mAU•min,对应的RSD分别为0.10%和3.86%。8-OHdG的平均质量浓度为0.49 μg/mL,RSD为1.86%,表明该方法的精密度好。
将1.3.3节中得到的损伤后的DNA按照1.3.4节方法处理后进行HPLC测定,结果见图4A,测定液中加入0.5 mL 8-OHdG标准溶液(1.0mg/L)后的HPLC图见图4B,在15.173 min处的色谱峰相比较图4A 15.197 min处的色谱峰,峰形不变,峰高增加,表明图4A中15.197 min处的色谱峰即为8-OHdG,说明该酶解和仪器方法适用于本实验。

图4 DNA损伤(A)和加标(B)样品色谱图Fig.4 Liquid chromatograms of sample with DNA damage (A and spiked sample (B)
2.3 8-OHdG的稳定性
在优化的条件下,每隔1 h对同一样品进行重复进样,HPLC测定。结果表明,8-OHdG酶解液在室温条件下至少可以稳定24 h。
2.4 乙酰甲喹药浴质量浓度、药浴时间对刺参DNA氧化损伤程度的影响
应用建立的方法分别对经过不同药浴质量浓度和药浴时间乙酰甲喹处理过的刺参DNA样品进行8-OHdG分析。药浴52 d时不同质量浓度乙酰甲喹对刺参的影响,见图5。刺参DNA中8-OHdG的含量随乙酰甲喹质量浓度增高而增高,呈浓度依赖性升高,乙酰甲喹质量浓度的变化对刺参组织DNA中8-OHdG含量变化有显著影响(P<0.05)。由图6可见,4 mg/L乙酰甲喹条件下,随着作用时间的延长,8-OHdG含量显著增加(P<0.05),呈现时间-反应关系,两个实验都表明药物诱导机体发生了氧化性DNA损伤,DNA损伤是导致基因突变的重要基础,说明乙酰甲喹对刺参幼参有一定的遗传毒性。

图5 乙酰甲喹质量浓度与刺参组织DNA中8-OHdG含量的关系Fig.5 Relationship between MEQ concentration and 8-OHdG content
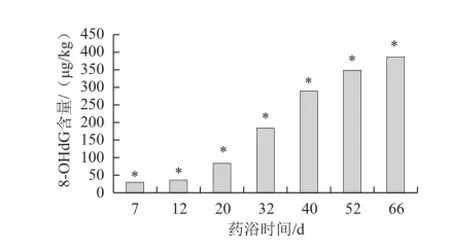
图6 乙酰甲喹(4 mg/L)药浴时间与8-OHdG含量的关系Fig.6 Relationship between MEQ medicated bath and 8-OHdG content
2.5 饲料中不同添加剂量喹烯酮对刺参DNA氧化损伤程度的影响
将饲喂不同剂量喹烯酮52 d时的刺参DNA样品进行HPLC分析(图7)表明,刺参DNA中的8-OHdG的含量随喹烯酮添加剂量的升高而增多,喹烯酮的添加剂量与8-OHdG的含量呈剂量-反应关系,差异显著(P<0.05),表明药物诱导机体发生了DNA氧化损伤,喹烯酮具有一定的遗传毒性。

图7 喹烯酮添加量与8-OHdG含量的关系Fig.7 Relationship between QCT addition and 8-OHdG content
3 讨 论
遗传毒性是指环境中的理化因素作用于有机体,使其遗传物质在染色体水平、分子水平和碱基水平上受到各种损伤,从而造成的毒性作用。8-OHdG作为体内DNA氧化损伤的主要标志物之一,是氧化代谢终产物,只能通过DNA氧化损伤途径产生8-OHdG的致突变性主要表现在特异性碱基丢失,邻近嘧啶的错读,以及损伤部位腺嘌呤的错误插入[12]。选取8-OHdG作为体内DNA氧化损伤标志物主要由以下几方面原因[2]:1)8-OHdG在体内稳定存在,一旦形成不再被机体进一步代谢;2)8-OHdG不能由细胞内外的dG通过非DNA氧化途径形成,分析组织细胞核DNA及线粒体DNA中8-OHdG可反映体内DNA氧化损伤程度。
喹噁林类药物中的喹乙醇和卡巴氧,目前在水产养殖上已经禁止使用,乙酰甲喹和喹烯酮作为我国自主研发的一类新型喹噁林类药物,对畜禽及水产动物防病作用效果显著。1997年Acree等[13]研究喹噁啉类药物在脱氧代谢过程中发现有氢氧自由基产生,过多的自由基可以和DNA或者蛋白质结合,导致DNA断裂、蛋白质损伤等氧化应激反应,对细胞组织有很强的破坏作用。含有N—O基团的乙酰甲喹、喹烯酮在脱氧过程中也会产生类似的毒性反应,导致细胞损伤,影响机体功能。Ihsan[14-15]、王旭[16]等系统地评价了乙酰甲喹的遗传毒性,对乙酰甲喹进行了细菌回复突变实验、染色体畸变实验、体内微核实验和繁殖实验,结果表明了乙酰甲喹具有潜在的基因毒性和胚胎毒性。很多的研究结果也证明乙酰甲喹在细胞水平具有一定的遗传毒性,主要表现为细胞存活率下降、DNA损伤和细胞内活性氧增加,能诱发细胞内基因位点的突变[17-18]。张伟等[19]发现,乙酰甲喹微核实验结果为阳性;在加与不加S9时,细胞的畸变率均大于10%,为阳性,并呈现剂量-反应关系。上述结果显示乙酰甲喹具有一定的遗传毒性。
很多研究结果也证实了喹烯酮具有一定的致突变性和遗传毒性。Chen Qian等[20]报道,喹烯酮以5~15 mg/L作用Vero细胞,无论加S9处理与否,都出现显著的DNA损伤。班曼曼[21]利用SCGE技术也证实喹烯酮对Chang Liver和L-02细胞DNA均有显著损伤。张伟[19]采用Ames实验对喹烯酮的遗传毒性进行了研究,结果表明在不加S9提取物情况下,喹烯酮对菌株TA 97、TA98、TA100和TA1537具有一定的致突变性。涂宏刚等[22]在V79细胞hgpr基因突变实验中发现喹烯酮在10 μg/mL的剂量下引起V79细胞hgpr基因突变率变化与溶剂对照组差异有统计学意义。靳溪[23]、陈开跑[24]等在HepG2细胞中以不同质量浓度给予喹烯酮,进行单细胞凝胶电泳和彗星实验后发现,喹烯酮能够对HepG2细胞造成显著的DNA损伤效应,并呈剂量-反应关系。Wang Di等[25]研究发现喹烯酮暴露导致Balb/c小鼠DNA损伤,小鼠肝脏和肾脏的ROS水平明显上升以及抗氧化系统受到明显抑制,氧化应激是喹烯酮引起体内遗传毒性的重要原因。程序外DNA合成实验中发现,喹烯酮10~20 μg/mL能引起人外周血淋巴细胞程序外DNA合成显著增加,呈剂量反应关系,表明喹烯酮能引起人外周血淋巴细胞DNA损伤[26]。
本实验通过经新型喹噁林类乙酰甲喹和喹烯酮药物处理过的刺参样品进行8-OHdG含量的测定后发现,两类药物都能引起刺参组织DNA的氧化损伤,并且随着药物浓度增加和时间延长,8-OHdG含量显著增加(P<0.05),呈现剂量-反应、时间-反应关系,并且是一个持续性的过程,表明乙酰甲喹和喹烯酮在分子水平具有一定的遗传毒性。目前对乙酰甲喹和喹噁林类药物的遗传机制研究处于起步阶段,尚需更多研究对此加以证实,以确认其安全性,并制定此类药物在水产养殖业中的使用规范,以促进水产养殖产业的健康发展。
[1] 张德莉′朱圣姬′罗光富′等. 自由基与DNA氧化损伤的研究进展[J]. 三峡大学学报: 自然科学版′2004′26(6): 563-567.
[2] 徐永俊′徐顺清. DNA氧化损伤生物标志物8-OH-dG的检测及其在医学中的应用[J]. 癌变·畸变·突变′2002′14(1): 50-53.
[3] 吴永宁′邵兵′沈建忠. 兽药残留检测与监控技术[M]. 北京: 化学工业出版社′2007: 621-626.
[4] 张华海. 喹噁啉类在大鼠和猪肝微粒体中脱氧速率与肝细胞中毒性研究[D]. 武汉: 华中农业大学,2010.
[5] 张春云′王印庚′荣小军′等. 国内外海参自然资源、养殖状况及存在问题[J]. 海洋水产研究′2004′25(3): 89-97.
[6] 王旭′谈自强′黄玲利′等. 兽用喹噁林类遗传毒性研究进展[J]. 中国兽药杂志′2013′47(5): 62-65.
[7] 赵燕′郝卫东. 8-羟基-2′-脱氧鸟苷的生物学意义及其尿中含量的测定方法[J]. 癌变·畸变·突变′2007′19(5): 418-420.
[8] 荣俊冬′张迎辉′郑志雷′等. 不同提取缓冲液对三尖杉DNA提取质量的影响[J]. 广东林业科技′2013(5): 22-25.
[9] 孙咏梅′戴树桂′裘著革. DNA加合物8-羟基脱氧鸟苷特性研究[J]. 上海环境科学′2001′20(9): 409-413; 459.
[10] 宋玉玲′汪海林. 超高效液相色谱-串联质谱法测定氧化损伤标志物8-羟基脱氧鸟苷[J]. 色谱′2010′28(12): 1123-1127.
[11] 汪莉君′邵华′许光′等. 高效液相色谱-紫外法检测尿中8-羟基脱氧鸟苷[J]. 中国卫生检验杂志′2008′18(6): 1030-1032.
[12] PILGE A R☒DIGER H W. 8-Hydroxy-2-deoxyguanosine as a marker of oxidative DNA damage related to occupationaland environmental exposures[J]. International Archives of Occupational and Environmental Health′2006′80: 1-15.
[13] ACREE W JOYCE J POWELL J et al Thermodchemical and theoretical study of some quinmoxaline 1′4-dioxides and of pyrazine 1′4-dioxide[J]. Journal of Organic Chemistry′1997′62: 3722-3726.
[14] IHSAN A WANG X TU H G et al Genotoxicity evaluation of mequindox in different short-term tests[J]. Food and Chemical Toxicology′2013′51: 330-336.
[15] IHSAN A WANG X LIU Z Y et al Long-term mequindox treatment induced endocrine and reproductive toxicity via oxidative stress in male Wistar rats[J]. Toxicology and Applied Pharmacology′2011′252: 281-288.
[16] 王旭′IHSAN A′黄先菊′等. 乙酰甲喹的毒理学研究[C]//科技引领产业、支撑跨越发展: 第六届湖北科技论坛论文集萃. 2011: 220-221.
[17] LIU Jing MAN Quyang JIANG Jun et al Mequindox induced cellular DNA damage via generation of reactive oxygen species[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis′2012′741: 70-75.
[18] 母培强′刘菁′唐先青′等. 乙酰甲喹的细胞毒性及其羰基还原和羟化代谢[J]. 畜牧与兽医′2012′44(增刊1): 375-376.
[19] 张伟. 喹烯酮临床前毒理学研究[D]. 武汉: 华中农业大学′2007.
[20] CHEN Qian TANG Shusheng JIN Xi et a1. Investigation of the genotoxicity of quinocetone carbadox and olaquindox in vitro using vero cells[J]. Food and Chemical Toxicology′2009′47(2): 328-334.
[21] 班曼曼. 喹噁啉类药物及其代谢物致人源肝细胞毒性研究[D]. 南京: 南京农业大学′2009.
[22] 涂宏刚′戴梦红′姚敏′等. 喹噁啉类药物对V79细胞hgprt基因位点的突变效应[J]. 毒理学杂志′2007′21(4): 335.
[23] 靳溪′陈倩′邹家杰′等. 喹烯酮致HepG2细胞DNA损伤效应的研究[C]//中国环境诱变剂学会第14届学术交流会议论文集. 2009: 125-130.
[24] 陈开跑′陈倩′靳溪′等. 喹噁林类药物致HepG2细胞DNA损伤与修复[J]. 中国兽医杂志′2010′46(5): 90-92.
[25] WANG Di ZHONG Ying LUO Xiao et al Pu-erh black tea supplementation decrease quinocetone-induced ROS generation and oxidative DNA damage in Ballb/c mice[J]. Food and Chemical Toxicology′2011′49(2): 477-484.
[26] 黄玲利′李娟′王旭′等. 喹烯酮的食品安全性研究进展[J]. 中国兽药杂志′2013′47(6): 56-59.
Determination of Oxidative DNA Damage Induced by Quinoxaline in Apostichopus japonicas Tissue Using High Performance Liquid Chromatography
JIANG Xiangyang1′ZOU Rongjie1′2′XU Yingjiang1′SONG Xiangjun1′GONG Xianghong1′LIU Huihui1′TIAN Xiuhui1′SUN Guohua1′LIU Yun3′AN Honghong3′ZHANG Xiuzhen1′*
(1. Shandong Provincial Key Laboratory of Restoration for Marine Ecology Shandong Marine Resource and Environment Research Institute Yantai 264006′China; 2. Yantai Shanshui Seafood Co Ltd.′Yantai 264006′China; 3. College of Food Science and Technology Shanghai Ocean University Shanghai 201306′China)
8-Hydroxy-2’-deoxyguanosine (8-OHdG) is one of the main modified products from oxidative DNA damage when deoxyguanosine (dG) is oxidized by a large amount of active oxygen species (ROS). Once 8-OhdG has avoided to be repaired within the body, it maybe the initiation factor causing mutagenic, teratogenic and carcinogenic effect. 8-OHdG is a metabolic end product that is stable within the body. It is not formed by non-DNA oxidation pathway outside the cell. The content of 8-OHdG can refl ect the degree of oxidative damage in DNA. Thus, it is important to determine the content of 8-OHdG in order to evaluate the interaction between oxidative damage, oxidative stress and DNA damage in the body. The quinoxaline-induced DNA oxidative damage in Apostichopus japonicas tissues was determined by high performance liquid chromatography (HPLC) in this study. Sea cucumber tissue treated with quinoxalines at different concentrations and for different time periods were collected. DNA were extracted and treated enzymatically, and then 8-OHdG as an indicator of DNA oxidative damage was measured and analyzed by HPLC. The results showed that the HPLC-UV method displayed a wide applicability, stability and accuracy, high sensitivity, less samples and fast analysis. The 8-OHdG content remarkably increased along with increasing concentration and processing time of mequindox. The dose- and time-dependent response relationship existed, which were a continual process. The oxidative damage to DNA caused by quinocetones signifi cantly increased with increasing concentration (P lt; 0.05). It was indicated that there was obvious genetic toxicity resulting from oxidative DNA damage caused by mequindox and quinocetone in sea cucumber. Thus, it is necessary to control strictly quinoxalines applied in sea cucumber.
quinoxaline; Apostichopus japonicas; oxidative DNA damage; high performance liquid chromatography (HPLC)
S859.79
A
1002-6630(2015)06-0211-05
10.7506/spkx1002-6630-201506040
2014-05-25
山东省科学技术发展计划项目(2012GHY11517);烟台市科技发展计划项目(2012134);国家海洋公益性行业科研专项(201105013);水生动物营养与饲料泰山学者岗位项目(2007-2012)
姜向阳(1980—),男,助理研究员,硕士,研究方向为水产动物疫病防治。E-mail:jxy0535@126.com
*通信作者:张秀珍(1964—),女,研究员,本科,研究方向为水产品质量安全。E-mail:zxz0535501@126.com
