鸡胸软骨中Ⅱ型胶原的制备工艺优化
2015-12-13于劲松
程 媛,曹 慧*,徐 斐,于劲松,袁 敏
(上海理工大学医疗器械与食品学院,上海 200093)
鸡胸软骨中Ⅱ型胶原的制备工艺优化
程 媛,曹 慧*,徐 斐,于劲松,袁 敏
(上海理工大学医疗器械与食品学院,上海 200093)
对鸡胸软骨Ⅱ型胶原的制 备工艺进行优化。采用盐酸胍和NaCl 2种抽提方法去除杂蛋白,然后用胃蛋白酶酶解并考察酶解温度、酶解时间和酶添加量对胶原提取率的影响。结果表明:4 mol/L的盐酸胍能有效去除杂蛋白;当酶解温度18℃、胃蛋白酶添加量1.59%、酶解43 h时提取率最高,且此条件下的胶原提取率为56.54%,且保持着完整的二级结构。经过酶解后制备的Ⅱ型胶原电泳图谱出现α、β 2条带,无其他杂带,Ⅱ型胶原纯度较高。
鸡胸软骨;Ⅱ型胶原;提取
Ⅱ型胶原是生物体内透明软骨的主要结构组分[1],具有维持关节软骨的形态结构和抗张力强度的功能[2]。近年来的研究表明,类风湿性关节炎(rheumatoid arthritis,RA)的发病与Ⅱ型胶原自身免疫反应有关[3-5],口服Ⅱ型胶原诱导免疫耐受对类风湿关节炎有显著的防治作用[6]。
目前,常用的胶原提取方法有酸提取法、碱提取法和酶提取法。酸提取法耗时长,且胶原的溶解量小[7-9]。碱提取法会破坏胶原纤维中含有羟基和巯基的氨基酸,也会破坏胶原分子内和分子间的交联作用,同时使产物发生消旋现象[10-13]。酶法提取是利用蛋白酶将胶原蛋白的端肽和非螺旋区域切除,使切除后的胶原溶解进而将其提取,提取率较高[14-17]。目前国内外关于鸡胸软骨Ⅱ型胶原提取的研究普遍存在处理量小、过程复杂等问题,而且没有对胃蛋白酶处理过程中Ⅱ型胶原三股螺旋结构的保持进行研究。在制备胶原的过程中,杂蛋白的去除、酶解过程的控制以及提取产物二级结构的保持始终是研究的难点和重点之一,现在还缺乏系统完整的研究,这在一定程度上阻碍了Ⅱ型胶原在工业上的应用。为解决这些问题,本实验以鸡胸软骨为原料,利用酸性条件下酶解的方法来提取Ⅱ型胶原,着重研究了鸡胸软骨中杂蛋白的去除、影响鸡胸软骨Ⅱ型胶原的提取因素及其二级结构的测定,确定了最佳的提取工艺,以期为鸡胸软骨Ⅱ型胶原在生物领域的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜软骨 上海申宏冷藏储运有限公司;胃蛋白酶(1∶10 000 U/mg) 美国Sigma公司;其他试剂(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
TLID-2005袖珍型低温恒温槽 宁波天恒仪器厂;LD85B3型真空冷冻干燥机 美国Millrock科技公司;UV-6000 PC型紫外-可见分光光度计 上海元析仪器有限公司;傅里叶变换红外光谱(Fourier transform infrared spectoscopy,FTIR)仪 美国Thermo电子公司。
1.3 方法
1.3.1 鸡胸软骨Ⅱ型胶原的提取流程
鸡胸软骨→清洗→剔除肌肉、骨膜、腱等非软骨物质→冷冻→粉碎脱脂→除杂蛋白→胃蛋白酶酶解→盐析→透析脱盐→冷冻干燥→Ⅱ型胶原制品
1.3.2 杂蛋白的去除
以Ⅱ型胶原提取率为评价指标,比较盐酸胍溶解和NaCl抽提2 种方法对软骨中杂蛋白的去除效果[18]。剔除软骨中残肉及其他非软骨成分,用甲醇-氯仿(2∶1,V/V)脱脂,再将脱脂后的样品混悬于1 mol/L NaCl或一定浓度盐酸胍溶液中,搅拌12 h,以5 000 r/min的转速离心15 min,弃上清液,保留沉淀。
1.3.3 胃蛋白酶酶解工艺
取等量去除杂蛋白后的沉淀混悬于0.5 mol/L HAc溶液中,加入一定质量分数的胃蛋白酶,4 ℃条件下酶解,酶解后10 000 r/min、4 ℃离心20 min。取上清液,用0.9 mol/L NaCl溶液盐析,所得沉淀用0.5mol/L HAc溶液透析,冷冻干燥。考察酶解温度、酶解时间和酶添加量对胶原提取率的影响。提取率计算见下式[19]。

1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)
采用SDS-PAGE电泳鉴定胶原蛋白的纯度[19]。其中分离胶质量浓度为8 g/100 mL,浓缩胶为5 g/100 mL。将制备的胶原蛋白溶液置于沸水浴中煮沸3 min,10 000 r/min离心10 min,取上清液15 μL上样。120 V电压电泳完毕后,用0.1 g/100 mL考马斯亮蓝R-250溶液染色6 h,醋酸溶液脱色至背景无色后拍照。
1.3.5 FTIR
取适量冷冻干燥后的Ⅱ型胶原和溴化钾,置于玛瑙研钵中,研磨成粉后装样压片。采用FTIR仪对样品在400~4 000 cm—1区间进行扫描[19-20]。
2 结果与分析
2.1 鸡胸软骨中杂蛋白的去除
2.1.1 不同杂蛋白去除方法对提取率的影响
鸡胸软骨中的主要杂蛋白是蛋白多糖,因而本研究首先以Ⅱ型胶原的提取率为指标,比较了NaCl抽提和盐酸胍溶解2 种杂蛋白去除方法对提取率的影响。结果如图1所示。

图1 2种杂蛋白去除方法对Ⅱ型胶原提取率的影响Fig.1 Effects of two proteoglycan-removing methods on extracting ratio of type Ⅱ collagen
如图1所示,盐酸胍溶解处理后Ⅱ型胶原的提取率为56.95%,显著高于NaCl抽提的提取率28.62%。这可能是由于盐酸胍分子为极性分子,极易形成氢键,可以破坏杂蛋白分子内外原有的氢键,从而达到去除杂蛋白的目的。因而,选取盐酸胍溶解法去除软骨中的杂蛋白。
2.1.2 盐酸胍浓度对杂蛋白去除效果的影响

图2 盐酸胍浓度对Ⅱ型胶原提取率的影响Fig.2 Effect of guanidine hydrochloride concentrations on extraction efficiency of type Ⅱ collagen
进一步考察盐酸胍浓度对鸡胸软骨中杂蛋白的去除效果。由图2可见,随着盐酸胍浓度的增加,Ⅱ型胶原提取率不断提高,当盐酸胍浓度超过4 mol/L时,杂蛋白的去除效果没有显著增加。因此选择浓度为4 mol/L的盐酸胍来去除鸡胸软骨中的杂蛋白。
2.2 酶法提取Ⅱ型胶原的最佳工艺条件
2.2.1 温度对Ⅱ型胶原二级结构及提取率的影响
为了保持Ⅱ型胶原在提取过程中二级结构的完整,首先探讨温度对Ⅱ型胶原二级结构的影响,结果如图3~5所示。
由图3可见,随着温度的升高,酰胺A带吸收峰减弱,表明维持Ⅱ型胶原三股螺旋结构的氢键逐渐减弱,二级结构遭到破坏。酰胺Ⅱ、Ⅰ带随温度的升高虽然存在,但吸收峰减弱,表明三股螺旋结构遭到破坏。由图4、5得出,温度由5 ℃升高至150 ℃,酰胺Ⅰ带的吸收峰发生蓝移(向高波数移动),酰胺Ⅱ带的吸收峰则发生红移(向低波数移动),表明在升温的过程中,低波数对应的螺旋结构减少,高波数对应的转角结构增加,使酰胺Ⅰ带发生蓝移;而低波数对应的伸展肽链结构增加,低波数对应的无序结构增加,使酰胺Ⅱ带发生红移。以上结果说明在升温过程中,Ⅱ型胶原3 条α链之间参与形成的氢键不断减弱,螺旋结构逐渐减少,使得肽链伸直,螺旋度减低,Ⅱ型胶原的无序结构增加。由此可见,温度对Ⅱ型胶原的二级结构有显著影响。根据以上结果确定Ⅱ型胶原的提取温度范围为0~50℃。在0~50 ℃范围内,随着温度的升高,Ⅱ型胶原的提取率呈先升高后降低的趋势。图6显示:5~35℃Ⅱ型胶原提取率的变化,在5~20 ℃时,Ⅱ型胶原提取率随温度升高而增大;当温度继续升高至35 ℃时,提取率明显降低。当温度达到50℃时,基本无Ⅱ型胶原提出,可能是由于50 ℃已经到达Ⅱ型胶原的变性温度,使提取的Ⅱ型胶原发生变性。

图3 不同温度条件下(5~150 ℃)Ⅱ型胶原的FTIR谱图TIRFig.3 FTIR spectra of type Ⅱ collagen with variable temperatures
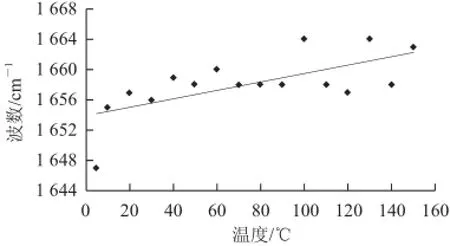
图4 不同温度条件下(5~150 ℃)酰胺Ⅰ带的波数变化Fig.4 Wavelength variations of amide Ⅰ band with variable temperatures
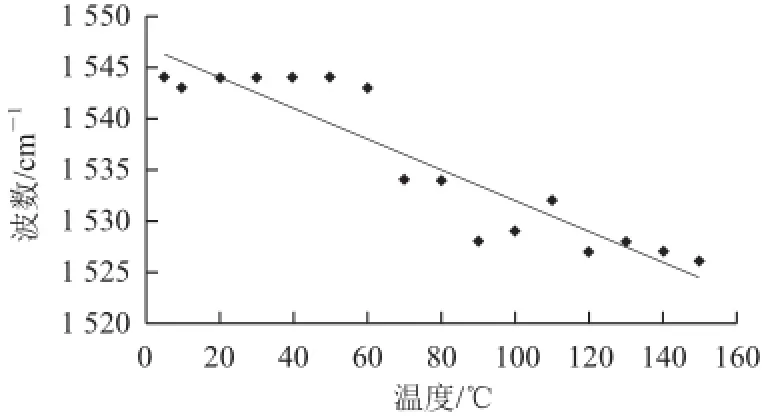
图5 不同温度条件下(5~150 ℃)酰胺Ⅱ带的波数变化Fig.5 Wavelength variations of amide Ⅱ band with variable temperatures

图6 温度对Ⅱ型胶原提取率的影响Fig.6 Effects of temperatures on extracting efficiency of type Ⅱ collagen
2.2.2 胃蛋白酶添加量对Ⅱ型胶原的提取率及二级结构的影响
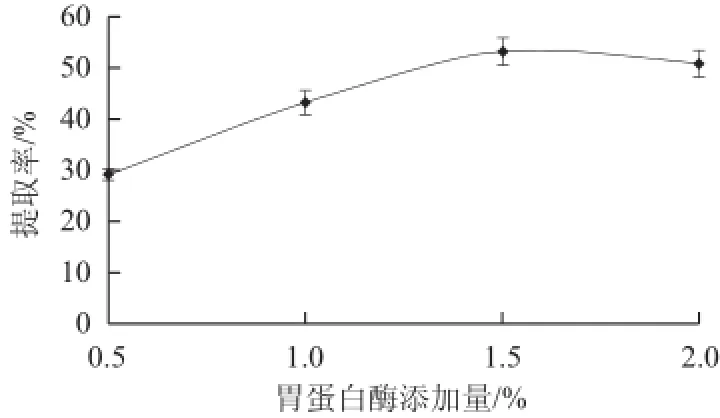
图7 胃蛋白酶添加量对Ⅱ型胶原提取率的影响Fig.7 Effects of pepsin concentrations on extracting efficiency of type Ⅱ collagen
胃蛋白酶添加量与Ⅱ型胶原的提取率有着密切关系。由图7可知,在0.5%~1.5%的酶添加量范围内,Ⅱ型胶原的提取率随着胃蛋白酶用量的增大而提高。这是由于在较低的酶用量范围,底物量相对较大,足以饱和胃蛋白酶,酶解反应的速度与胃蛋白酶用量呈正相关关系;当酶添加量超过1.5%时,Ⅱ型胶原的提取率下降,提取量降低。

图8 不同胃蛋白酶添加量下Ⅱ型胶原的FTIR图谱TIRFig.8 FTIR spectra of type Ⅱ collagen with various concentrations of pepsin
由图8可见,当胃蛋白酶添加量在0.5%~1.5%范围内,Ⅱ型胶原在3 400~3 450、2 923、1 625~1 690、1 500~1 600 cm—1和1 200~1 300 cm—1处的吸收峰未发现明显的变化。当胃蛋白酶添加量达到2%时,酰胺A带、酰胺B带、酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅱ、Ⅰ带的吸收峰明显减弱,表明三股肽链之间的氢键减弱,这是由于在高添加量的胃蛋白酶作用下, Ⅱ型胶原发生了一定程度的水解,分子内和分子间的氢键减弱,二级结构遭到一定程度的破坏。此外,酰胺Ⅰ带还发生明显蓝移,表明在提取过程中,胶原蛋白的螺旋结构减少,转角结构增加。而酰胺Ⅱ带发生了明显的红移,表明胶原蛋白的伸展肽链结构增加,无序结构增加,二级结构遭到一定程度破坏。因此选取胃蛋白酶添加量为1.25%~1.75%。
2.2.3 酶解时间对Ⅱ型胶原提取率及二级结构的影响

图9 酶解时间对Ⅱ型胶原提取率的影响Fig.9 Effects of digestion times on extracting efficiency of type Ⅱ collagen
酶解时间是影响Ⅱ型胶原提取率及二级结构的一个重要因素,由图9可见,水解时间较短时,Ⅱ型胶原的提取率较低增长速度较快。当水解时间超过36 h后,Ⅱ型胶原的提取率基本不再发生变化,达到稳定值。这是因为提取时间较短,胃蛋白酶没有与底物充分作用,同时酶解后的Ⅱ型胶原还没有及时完全地溶解到醋酸溶液中。

图10 不同酶解时间Ⅱ型胶原的FTIR图谱TIRFig.10 FTIR spectra of type Ⅱ collagen with various times
由图10可知,长时间的酶解对Ⅱ型胶原的二级结构产生明显的影响。随着酶解时间的延长,酰胺A带发生蓝移,表明由含有N—H基团的肽段参与形成的氢键发生断裂;当酶解时间为72 h时,酰胺Ⅰ带蓝移,表明胶原蛋白的螺旋结构减少,转角结构增加,同时Ⅱ型胶原的FTIR曲线在1028 cm—1处的峰消失,而在943、859 cm—1和537 cm—1处出现了杂峰,表明整个Ⅱ型胶原的螺旋度减少,无序结构增加,二级结构遭到破坏。因此选择酶解时间为24~48 h。
2.2.4 响应面试验结果
选取酶解温度、胃蛋白酶添加量及酶解时间作为主要因素,以Ⅱ型胶原的提取率(R)为响应值,设计响应面试验,进一步优化Ⅱ型胶原酶解条件。试验设计及结果见表1。
利用Design-Expert软件对表1试验数据进行回归拟合,得到以Ⅱ型胶原提取率为目标函数的二次回归方程:R=55.19—5.12A+0.53B+2.87C+0.31AB+0.043AC+1.7BC—11.19A2—1.93B2—3.12C2。根据回归模型利用Design Expert软件进行分析,得出提取Ⅱ型胶原的最佳工艺条件为酶解温度17.77 ℃、胃蛋白酶添加量1.59%、酶解时间42.67 h,Ⅱ型胶原提取率理论预测值可达56.65%。考虑到实际操作条件,最佳工艺条件确定为酶解温度18 ℃、胃蛋白酶添加量1.59%、酶解时间43 h。在此条件下进行验证实验,胶原提取率为56.54%。可见,试验结果与模型拟合良好,该方程能真实地反映各因素对胶原提取率的影响。

表1 响应面分析设计及试验结果Table1 Program and experimental results of response surface methodology
2.3 Ⅱ型胶原的SDS-PAGE电泳
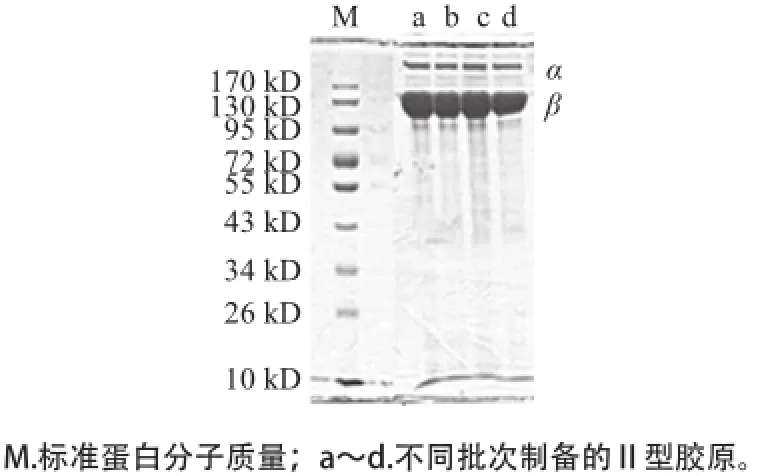
图11 Ⅱ型胶原的SDS-PAGE图谱AGEFig.11 SDS-PAGE spectrum of type Ⅱ collagen
采用SDS-PAGE电泳对提取后Ⅱ型胶原的纯度及分子质量进行了鉴定。由图11所见,提取的Ⅱ型胶原在SDS-PAGE图谱上出现了α、β 2个条带,其分子质量分别约为110 kD和220 kD。根据已有的资料[21-25],在分子质量约110 kD附近出现的条带为胶原蛋白的α链;在220 kD附近出现的条带是α链的二聚体,即β-链。这是典型的Ⅱ型胶原SDS-PAGE图谱,图谱上无其他杂带,不同批次提取的胶原蛋白具有较高的纯度。
3 结 论
本实验用盐酸胍和NaCl 2 种抽提方法去除杂蛋白,经4 mol/L的盐酸胍溶解处理后Ⅱ型胶原的提取率明显高于NaCl盐析。采用响应面法优化鸡胸软骨Ⅱ型胶原提取工艺,确定适宜提取工艺条件为:酶解温度18 ℃、胃蛋白酶添加量1.59%、酶解时间43 h,在此条件下,Ⅱ型胶原提取率为56.54%,且保持着完整的二级结构。经过酶解后制备的Ⅱ型胶原电泳图谱出现α、β 2 条带,无其他杂带,Ⅱ型胶原纯度较高。
[1] 宁志刚′王富友′崔运利′等. 可溶性猪软骨Ⅱ型胶原蛋白的提取与鉴[J]. 重庆医学′2011′40(10): 47-50.
[2] 顾其胜′蒋丽霞. 胶原蛋白与临床医学[M]. 上海: 第二军医大学出版社′2003: 60-67.
[3] DEYI Z MIKSIK I ECKHARDT A Preparative procedures and purity assessment of collagen proteins[J]. Journal of Chromatography B′2003′790(1/2): 245-275.
[4] CORNEIIA M W JAMES W F JORG J G Immunosenescence autoimmunity and rheumatoid arthritis[J]. Experimental Gerontology′2003′38(8): 83 -841.
[5] SUSAN E S GARY S F Rheumatoid arthritis reguiation of synoviai infiammation[J]. Intern Jenory Biochemistry Cell Bioindustry′2004′36(3): 372-378.
[6] 卢延旭′陈敏珠. 可溶性鸡Ⅰ型胶原对关节炎大鼠的免疫治疗作用[J]. 中国临床药理学与治疗学′2004′9(2): 180-183.
[7] 黄敏′陈海光′刘朝霞′等. 鱿鱼皮胶原蛋白制备技术研究罗非鱼鱼皮酸溶性胶原蛋白的制备工艺研究[J]. 安徽农业科学′2013(22): 9427-9430.
[8] 楚水晶. 马面鱼皮胶原蛋白的制备及特性研究[D]. 大连: 大连工业大学′2010.
[9] 朱芳骞. 鲍鱼内脏胶原蛋白多肽的制备及其体外抗氧化活性研究[D]. 福州: 福建农林大学′2012.
[10] RIGO C HARTMANN D J BAIRATI A Electrophoretic and immunochemical study of collagens from Sepia officinalis cartilage[J]. Biochimica et Biophysica ACTA-Biomembranes′2002′1572: 77-84.
[11] 钟朝辉′李春美′梁晋鄂. 鱼鳞蛋白提取工艺的优化[J]. 食品科学′2006′27(7): 162-166.
[12] 任秀艳′曹戈′王孟云. 玉米胚芽蛋白的碱法提取工艺及特性研究[J]. 食品工业科技′2014′35(10): 279-283.
[13] SATO K YOSHINAKA R SATO M et al A simplified method determing collagen in fish muscle[J]. Bulletin of the Japanese Society of Scientific Fisheries′1986′52(5): 889-893.
[14] 陈良′刘辉′谌素华. 鱼皮胶原提取的工艺研究[J]. 食品科技′2010′35(8): 281-284.
[15] 张路′代龙′杨田义. 酶解法从猪皮中提取胶原的工艺优选[J]. 中国实验方剂学杂志′2011′17(4): 8-11.
[16] 刘高梅′任海伟′王永刚. 猪软骨Ⅱ型胶原蛋白的制备及结构表征[J]. 食品研究与开发′2012′33(8): 47-50.
[17] 程波′吴洁′张玉蓉′等. 酶法提取人工养殖鲟鱼皮中胶原蛋白的工艺研究[J]. 食品研究与开发′2012′33(3): 1-4.
[18] 曹慧. 鸡胸软骨Ⅱ型胶原的制备及功能性研究[D]. 无锡: 江南大学′2008.
[19] 石服鑫′曹慧′徐斐′等. 不同来源Ⅱ型胶原结构及其免疫活[J] . 食品与发酵工业′2014′40(2): 22-26.
[20] PLEPIS A M G DAS-GUPTA D K GOISSIS G Pyroelectric properties of anionic collagen and anionic collagen P(VDE/TRFE composites[C]//Proceedings of the 10thInternational Symposium on Electrets Athens Greece′1999: 233-236.
[21] 梅焕平′张源潮′李华. Ⅱ型胶原微量提取与纯化[J]. 泰山医学院学报′1999′20(4): 342-343.
[22] 陆雪芹′许时婴′曹慧. 鸡胸软骨粉中Ⅱ型胶原的提取及结构分析[J]. 食品科学′2009′30(4): 76-80.
[23] LI Zhongrui WANG Bin CHI Changfeng Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel[J]. Food Hydrocolloids. 2013′31(1): 103-113.
[24] LIU Dasong ZHOU Peng LI Tiancheng Comparison of acid-soluble collagens from the skins and scales of four carp species[J]. Food Hydrocolloids′2014′41: 290-297.
[25] 焦坤. 羊肩胛软骨Ⅱ型胶原的提取及其理化特性研究[J]. 呼和浩特: 内蒙古农业大学′2012.
Preparation Technology of Collagen Type Ⅱ from Chicken Sternal Cartilage
CHENG Yuan CAO Hui*′XU Fei YU Jinsong YUAN Min (School of Medical Instruments and Food Engineering University of Shanghai for Science and Technology Shanghai 200093′China)
This paper reported the preparation of the type Ⅱ collagen from chicken articular cartilage Guanidine hydrochloride and NaCl were used to remove the contaminating proteins and the collagen was then digested with pepsin The study investigated effects of reaction temperature reaction time and concentration of enzyme on extraction efficiency The results showed that guanidine hydrochloride at 4 mol/L removed heteropolysaccharide effectively The optimal conditions for collagen type Ⅱ extraction were as follows temperature′18 ℃; gastric protein concentration′1.59%; and digestion time′43 h Under these conditions the extraction efficiency of collagen was 56.54%.
chicken stemal cartilage type Ⅱ collagen extract
TS251.94
A
1002-6630(2015)06-0024-05
10.7506/spkx1002-6630-201506005
2014-08-01
国家自然科学基金青年科学基金项目(31201421);国家高技术研究发展计划(863计划)项目(2013AA102207);上海市研究生创新基金项目(JWCXSL1302)
程媛(1988—),女,硕士研究生,研究方向为功能性配料及添加剂。E-mail:664039430@qq.com
*通信作者:曹慧(1976—),女,副教授,博士,研究方向为功能性配料及添加剂。E-mail:caohuian@126.com
