痉挛型瘫痪大鼠骨骼肌DNA甲基化水平与肌纤维构型①
2015-12-13王玉昌庞伟冯欢欢刘师振张慧
王玉昌,庞伟,冯欢欢,刘师振,张慧
痉挛型瘫痪大鼠骨骼肌DNA甲基化水平与肌纤维构型①
王玉昌1,庞伟1,冯欢欢1,刘师振2,张慧3
目的探讨骨骼肌在痉挛状态下对DNA甲基化水平的影响及与肌纤维构型的相关性。方法健康5日龄Wistar新生仔鼠100只,随机分为模型组和对照组。前者制备痉挛型瘫痪大鼠模型成功后饲养30 d。对两组大鼠腓肠肌进行肌肉活检。分别进行骨骼肌DNA甲基化水平测定、骨骼肌Ⅰ型肌球蛋白重链mRNA半定量RT-PCR检测,透射电镜观察。结果模型组骨骼肌总体DNA甲基化水平(4.95±0.83)×10%,显著低于对照组的(6.59±0.75)×10%(P<0.001);模型组骨骼肌Ⅰ型肌球蛋白重链mRNA表达量(1.23±0.31),显著高于对照组的(0.44±0.29)(P<0.001)。电镜观察,模型组骨骼肌Z线排列不规整,两旁骨骼肌线粒体增多,线粒体肿胀,线粒体嵴部分断裂;粗细肌丝数量关系失衡,肌原纤维包膜融合,有的包膜间隙增宽。结论痉挛型瘫痪大鼠骨骼肌DNA低甲基化,Ⅰ型肌球蛋白重链mRNA高表达;电镜检测以Ⅰ型纤维表现为主。没有充足证据表明骨骼肌DNA甲基化水平与肌纤维构型改变相关。
痉挛型瘫痪;甲基化;超微结构;Ⅰ型肌球蛋白重链
[本文著录格式]王玉昌,庞伟,冯欢欢,等.痉挛型瘫痪大鼠骨骼肌DNA甲基化水平与肌纤维构型[J].中国康复理论与实践, 2015,21(5):519-523.
CITED AS:Wang YC,Pang W,Feng HH,et al.DNA methylation and muscle fiber configuration on skeletal muscle in spastic paralysis rats[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(5):519-523.
痉挛型瘫痪是脑性瘫痪中发病率最高的一种类型,预后相对较好,发病率约占脑瘫的60%~70%[1]。康复过程中,肢体功能恢复时程较长,肌力增加幅度较慢。究其原因,除了上运动神经元损伤外,骨骼肌特性的改变也会起重要作用。近年来,国外学者开展相关的组织化学研究,揭示痉挛型骨骼肌纤维组成以Ⅰ型纤维为主[2];对于痉挛肌肉形态改变的分子机制缺乏报道[3-4]。DNA甲基化是最常见的表观遗传学修饰之一[5],能在不影响基因结构的基础上,调控基因的表达,从而影响组织的表型。本研究探讨痉挛状态对
肌肉DNA甲基化水平及肌纤维超亚微结构的影响。
1 材料与方法
1.1 实验动物及分组
清洁级5日龄Wistar大鼠100只,体重(21.10± 1.25)g,由吉林长春市亿斯实验动物技术有限责任公司提供,动物许可证号SCXK(吉)-2011-0004。室温21~26℃、相对湿度43%~45%环境下饲养。
大鼠按体重编号,运用随机数字表,抽出50个数字为模型组,其他为对照组。
1.2 器材与药品
戊二醛:FLUKA CHEMIKA。RNA提取试剂盒:北京鼎国生物工程公司。ABI Prism 7000型定量PCR:美国应用生物系统公司。HITACHI H-7650型透射电子显微镜:SONY。生理盐水:哈尔滨三联药业有限公司,批号130131A52。水合氯醛:天津市百世化工有限公司,批号20140513,用生理盐水配制成10%溶液。
1.3 方法
1.3.1 模型制备
模型组采用两血管阻断法[6]及双侧颈总动脉结扎法制作痉挛型瘫痪模型。对照组只行颈总动脉剥离、探查术。
1.3.2 模型检测
模型制备过程中死亡10只,术后24 h死亡6只;对照组麻醉过程中死亡4只。连续观察48 h,模型组存活34只,对照组存活46只。术后30 d,模型组采用悬吊试验和改良Ashworth评定表进行评定,大鼠下肢稳定性差,四肢很少有随意活动,跛行,下肢肌张力1级以上视为合格。
大鼠30日龄后,其行为、肌张力已与成年大鼠没有明显差异,神经行为学特征性表现能充分展示,相当于人类痉挛型瘫痪典型临床症状表现阶段[7]。
术后30 d,取模型组和对照组腓肠肌活检。分为3份。
1.3.3 DNA甲基化水平检测
腓肠肌组织用Agilent LC 1100型高效液相色谱仪进行总甲基化检测。
总甲基化水平=5 mC的峰面积/(c的峰面积+5 mC的峰面积)×100%
1.3.4 RT-PCR检测
腓肠肌组织行RNA提纯及DNase检测。采用Thermoscript PT-PCR系统和ABI.PRISM7000sequence导向系统进行mRNA的RT-PCR的热循环。参照大鼠骨骼肌Ⅰ型肌球蛋白重链(myosin heavy chain-I, MHC-Ⅰ)合成引物:
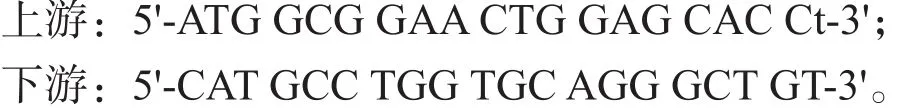
按照标准扩增30次。
原始数据转换采用standard dilutions Linkeg软件进行数据转换。
1.3.5 透射电镜观察
腓肠肌组织修成1×1×1 mm,2.5%戊二醛固定,随机编号,送两个电镜实验室观察。1%四氧化锇二次固定,乙醇逐级脱水,4号胶囊包埋,醋酸铀和柠檬酸铅依次染色,H-7650型透射电子显微镜观察。
1.4 统计学分析
对总体甲基化水平数据由十位数转换为个位数。数据用SPSS 17.0统计软件进行处理。甲基化水平与半定量RT-PCR数据用(¯±s)表示,采用独立样本t检验。甲基化水平与MHC-ⅠmRNA表达量进行Pearson相关性分析。显著性水平α=0.05。
2 结果
2.1 DNA甲基化水平和MHC-ⅠmRNA表达量
模型组骨骼肌DNA甲基化水平显著低于对照组(P<0.001),MHC-ⅠmRNA显著高于对照组(P<0.001)。见表1。
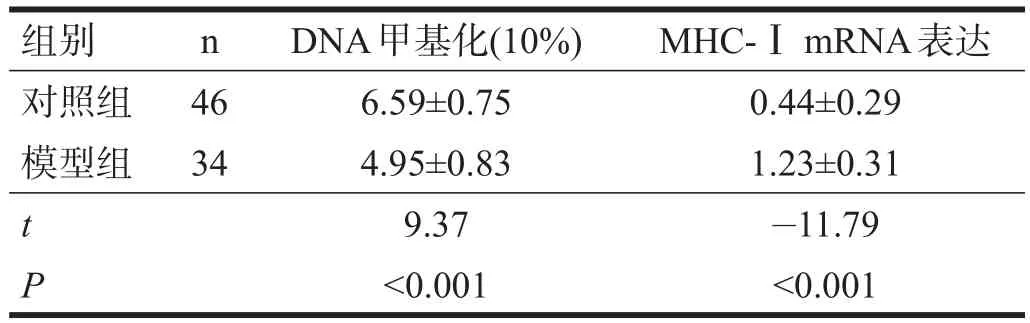
表1 两组骨骼肌DNA甲基化水平和MHC-ⅠmRNA的比较
模型组骨骼肌DNA甲基化水平和MHC-ⅠmRNA表达量呈弱负相关(r=-0.09,P<0.001),对照组DNA甲基化水平和MHC-ⅠmRNA表达量呈弱负相关(r=-1.18,P=0.01)。
2.2 电镜观察
骨骼肌纤维纵切面上,对照组肌原纤维由上千条粗、细两种肌丝有规律地平行排列组成,Z线完整,线粒体规律排列在Z线两旁,明、暗带规律排列。横切面可见粗细肌丝呈点状规律分布,一条粗肌丝周围有6条细肌丝;一条细肌丝周围有3条粗肌丝(图1)。
模型组可见线粒体排列在Z线之间数量多,线粒体结构不完整,且集合分布于肌膜下;可见脂滴、肌浆膜间隙增宽、肌浆膜模糊不清。对线粒体放大后可
见其大小不一,部分肿胀,部分萎缩,嵴部分断裂;线粒体排列不规律,胞浆基质疏松变淡,明暗带模糊不清,Z线部分断裂,线粒体排列不规律,局部放大可见Z线水纹状,模糊不清,部分断裂等。横切面上,粗细肌丝不规律排列,可见部分融合现象,可见粗肌丝周围绕7~8个细肌丝,另有粗肌丝周围围绕5个清晰的细肌丝(图1)。
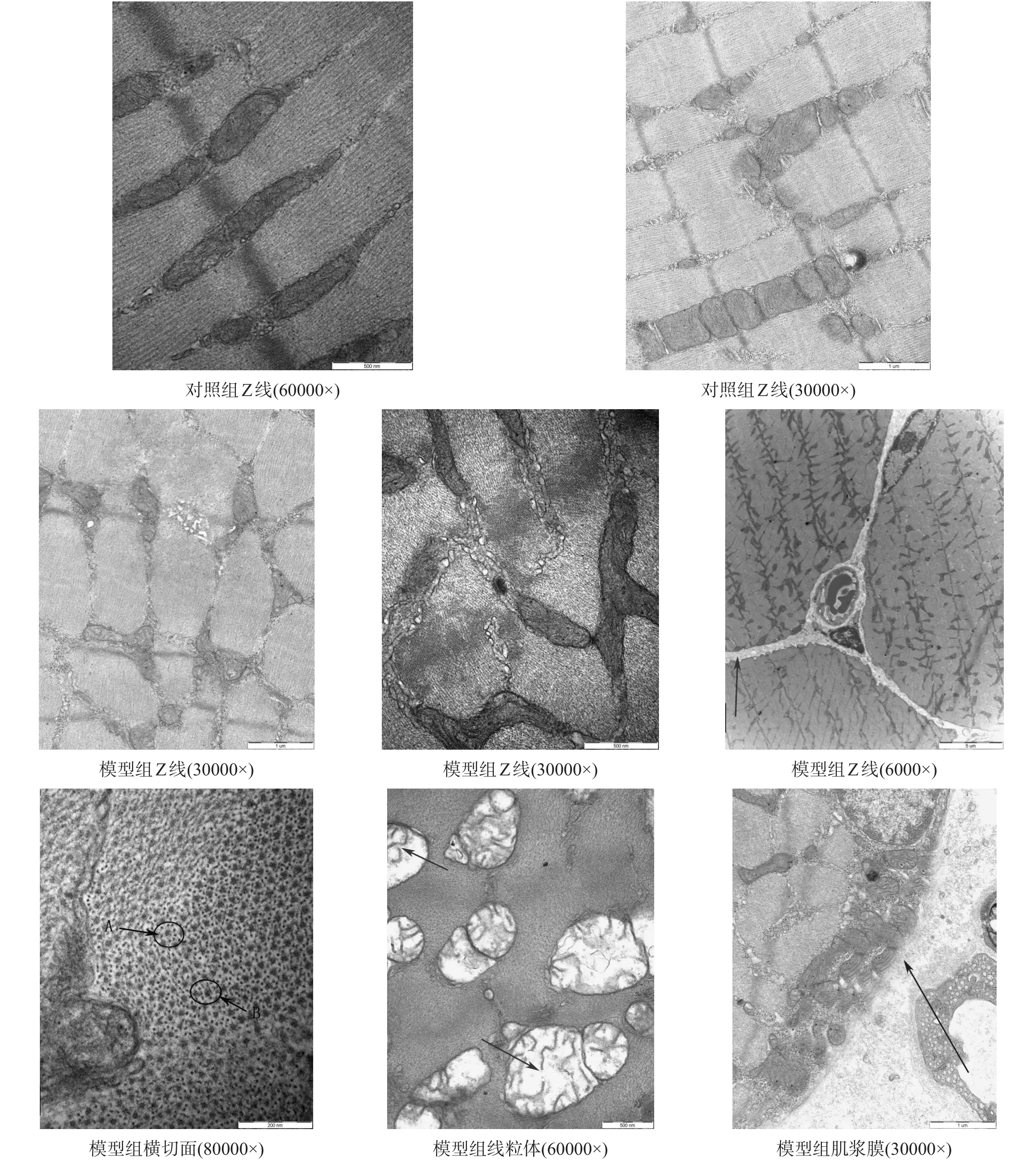
图1 大鼠腓肠肌透射电镜观察
3 讨论
骨骼肌纤维根据收缩特性和能量来源分为Ⅰ型和Ⅱ型(Ⅱa、Ⅱb、Ⅱx)。Ⅰ型肌纤维肌球蛋白ATP酶活性低,收缩速度相对较慢,但大量的线粒体使其具有强氧化活动的能力,因此可以持续低强度收缩;由于肌红蛋白含量高,故呈红色,又称红肌纤维,属于慢收缩氧化性。Ⅱa型属于快收缩氧化酵解型,Ⅱb型属于快收缩酵解型,Ⅱx型是较少的未分化纤维,可见于妊娠30周之前[8-9]。
有研究显示,痉挛肌肌纤维构型以Ⅰ型纤维占优势[10-11]。这一组型有利于痉挛肌肉维持持续、耐疲劳、高张的肌张力状态。
骨骼肌非正常收缩将导致其内DNA甲基化水平的变化[12]。甲基化是最常见的DNA修饰之一[13]。DNA甲基化是转录活性的主要调节者,环境因素会影响甲基化水平,这可能与一些神经系统疾病,如阿尔茨海默病有关。DNA甲基化水平对大脑各功能区的分布发挥着至关重要的作用[14-15]。
高张状态下,骨骼肌可能进行表观遗传修饰,即DNA甲基化水平的改变;异常的甲基化水平反过来又加重痉挛肌肉的功能障碍。
本研究显示,痉挛骨骼肌的甲基化水平低于正常肌肉;MHC-ⅠmRNA高表达。MHC-Ⅰ是肌球蛋白重链异形体之一,也是骨骼肌Ⅰ型纤维的重要组成部分,构成Ⅰ型纤维特性的结构基础。MHC异形体是骨骼肌纤维类型的标志性蛋白,而MHC异形体蛋白合成主要是受转录水平调控[16]。MHC-ⅠmRNA高表达表明痉挛骨骼肌以Ⅰ型纤维为主,与组织化学水平所观察到的表现一致。Mikeska等认为,DNA甲基化对相关基因的表达起抑制作用[17]。本研究支持这一观点。
国外研究表明,环境因素可以影响呼吸链的电子正常传递,从而影响骨骼肌线粒体能量的产生,线粒体DNA编码的蛋白质翻译缺陷会导致呼吸链中氧化磷酸化的过程紊乱,从而引起骨骼肌能量代谢失衡[18-19]。本研究电镜观察显示,病变以线粒体和粗细肌丝改变为主,这可能与痉挛型骨骼肌维持高张状态所需能量有关。Sakellariou等研究表明,正常的骨骼肌粗细肌丝排列规整,如一条粗肌丝周围有6条细肌丝,而一条细肌丝周围有3条粗肌丝[20-21]。
虽然本研究中痉挛型骨骼肌低甲基化水平与MHC-ⅠmRNA高表达量呈负相关,但不足以说明它与肌纤维构型的相关性。本研究采用总甲基化水平代表肌球蛋白相关位点的甲基化水平,并不精确;MHC的异形体众多,本研究只观察MHC-Ⅰ,并不确定其他异形体的表达情况。此外,本研究只是初步探讨了痉挛状态对骨骼肌的超亚微结构。如何选取合适的肌球蛋白相关位点以及肌球蛋白重链异形体,是以后的研究方向。
痉挛型骨骼肌近似一种老龄化状态,其肌肉大小、收缩特性等有别于同龄骨骼肌[22]。骨骼肌的痉挛状态阻碍功能的发挥,给康复带来负面影响,尤其是对肌张力协调性要求比较高的精细运动功能,这极大地影响了患者生活质量[23-25]。我们在进行抗痉挛康复治疗的同时,如能更好地把握骨骼肌超亚微结构的变化,能更好指导康复计划的实施及康复效果的预测。
[1]Hurley DS,Sukal-Moulton T,Msall ME,et al.The cerebral palsy research registry:development and progress toward national collaboration in the united states[J].Child Neurol,2011,26 (12):1534-1541.
[2]Choi HF,Blemker SS.Skeletal muscle fascicle arrangements can be reconstructed using a Laplacian vector field simulation[J].PLoS One,2013,8(10):e77576.
[3]Morris RT,Spangenburg EE,Booth FW.Responsiveness of cell signaling pathways during the failed 15-day regrowth of aged skeletal muscle[J].JAppl Physiol,2004,96(1):398-404.
[4]Weisleder N,Takizawa N,Lin P,et al.Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy[J].Sci Transl,2012,4(139):139ra85.
[5]罗君,凌志强.DNA甲基化分析技术的研究进展[J].国际检验医学杂志,2013,34(6):691-693.
[6]Zhou C,Shimazu T,Durduran T,et al.Acute functional recovery of cerebral blood flow after forebrain ischemia in rat[J]. Cereb Blood Flow Metab,2008,28(7):1275-1284.
[7]王江涛,毛英丽,李洪华,等.新生大鼠痉挛型脑瘫动物模型构建及评价的实验研究[J].中国妇幼保健,2011,26(19): 2992-2995.
[8]Nordin M,Frankel VH.Basic Biomechanics of the Musculoskeletal System[M].Lippincott:Williams&Wilkins,2001: 100-111.
[9]Lauritzen HP,Brandauer J,Schjerling P,et al.Contraction and AICAR stimulate IL-6 vesicle depletion from skeletal muscle fibers in vivo[J].Diabetes,2013,62(9):3081-3092.
[10]Klyen BR,Scolaro L,Shavlakadze T,et al.Optical coherence tomography can assess skeletal muscle tissue from mouse models of muscular dystrophy by parametric imaging of the attenuationcoefficient[J].BiomedOptExpress,2014,5(4): 1217-1232.
[11]Suhr F,Gehlert S,Grau M,et al.Skeletal muscle function during exercise-fine-tuning of diverse subsystems by nitric oxide[J].Int J Mol Sci,2013,14(4):7109-7139.
[12]Barrès R,Yan J,Egan B,et al.Acute exercise remodels promoter methylation in human skeletal muscle[J].Cell Metab, 2012,15(3):405-411.
[13]Moore LD,Le T,Fan G,et al.DNA methylation and its basic function[J].Neuropsychopharmacology,2013,38(1):23-38.
[14]Sanchez-Mut JV,Aso E,Panayotis N,et al,DNA methylation map of mouse and human brain identifies target genes in Alzheimer's disease[J].Brain,2013,136(10):3018-3027.
[15]Bakulski KM,Dolinoy DC,Sartor MA,et al.Genome-wide DNA methylation differences between late-onset Alzheimer's disease and cognitively normal controls in human frontal cortex[J].Alzheimers Dis,2012,29(3):571-588.
[16]Andersen JL,Gruschy-Knudsen T,Sandri C,et al.Bed rest increases the amount of mismatched fibers in human skeletal muscle[J].Appl Physiol,1999,86(2):455-460.
[17]Mikeska T,Craig JM.DNA methylation biomarkers:cancer and beyond[J].Genes(Basel),2014,5(3):821-864.
[18]Kopajtich R,Nicholls TJ,Rorbach J,et al.Mutations in GTPBP3 cause a mitochondrial translation defect associated with hypertrophic cardiomyopathy,lactic acidosis,and encephalopathy[J].Am J Hum Genet,2014,95(6):708-720.
[19]Boczonadi V,Horvath R.Mitochondria:impaired mitochondrial translation in human disease[J].Int J Biochem Cell Biol, 2014,48(5):77-84.
[20]Sakellariou GK,Vasilaki A,Palomero J,et al.Studies of mitochondrial and nonmitochondrial sources implicate nicotinamide adenine dinucleotide phosphate oxidase(s)in the increased skeletal muscle superoxide generation that occurs during contractile activity[J].Antioxid Redox Signal,2013,18(6): 603-621.
[21]Li Y,Lai N,Kirwan JP,et al.Computational model of cellular metabolic dynamics in skeletal muscle fibers during moderate intensity exercise[J].Cell Mol Bioeng,2012,5(1):92-112.
[22]Garvey SM,Dugle JE,Kennedy AD,et al.Metabolomic profiling reveals severe skeletal muscle group-specific perturbations of metabolism in aged FBN rats[J].Biogerontology, 2014,15(3):217-232.
[23]Klotz MC,Kost L,Braatz F,et al.Motion capture of the upper extremity during activities of daily living in patients with spastic hemiplegic cerebral palsy[J].Gait Posture,2013,38 (1):148-152.
[24]Palomero J,Vasilaki A,Pye D,et al.Aging increases the oxidation of dichlorohydrofluorescein in single isolatedskeletal muscle fibers at rest,but not during contractions[J].Am J Physiol Regul Integr Comp Physiol,2013,305(4):R351-R358.
[25]Yang YB,Zhang J,Leng ZP,et al.Evaluation of spasticity after stroke by using ultrasound to measure the muscle architecture parameters:a clinical study[J].Int J Clin Exp,2014,7(9): 2712-2717.
DNAMethylation and Muscle Fiber Configuration on Skeletal Muscle in Spastic Paralysis Rats
WANG Yu-chang1,PANG Wei1,FENG Huan-huan1,LIU Shi-zhen2,ZHANG Hui3
1.Rehabilitation Medical Research Institute of Jiamusi University,Jiamusi,Heilongjiang 154002,China;2.Shandong Jining No.1 People's Hospital,Jining,Shandong 272000,China;3.Yanzhou Tielu Hospital,Jining,Shandong 272100,China
Objective To investigate the DNA methylation of skeletal muscle in spastic paralysis rats and correlation with the muscle fiber configuration.Methods 100 5-day old Wistar rats were randomly divided into model group and control group.The former was established the spastic paralysis modle and reared for 30 days.Then,tissues from the gastrocnemius of all the rats were observed with triplicate DNA methylation,myosin heavy chain-I(MHC-I)mRNA with RT-PCR and transmission electron microscopy.Results The DNA methylation was(4.95±0.83)×10%in the model group,significantly less than(6.59±0.75)×10%in the control group(P<0.001);while the MHC-I mRNA was(1.23±0.31),significantly more than(0.44±0.29)in the control group(P<0.001).The Z-line was disordered,and the mitochondria near the Z-line increased,with edema and partially broken in cristae.The balance between the thick and thin filaments was broken,and myofibrils envelope fused.Conclusion Hypomethylation and hyperexpression of MHC-I mRNA have been found in skeletal muscle of spastic paralysis rats,which may result in type I fibers increase.However,there was no sufficient evidence to support the correlation between the DNAmethylation and the secondary pathological changes.
spastic paralysis;methylation;ultrastructure;myosin heavy chain-I
10.3969/j.issn.1006-9771.2015.05.006
R742.3
A
1006-9771(2015)05-0519-05
2015-01-05
2015-03-02)
1.黑龙江省研究生创新科研项目(No.LM2014-049);2.佳木斯大学校级科技创新团队项目(No.Cxtd-2013-02)。
1.佳木斯大学康复医学院暨黑龙江省小儿脑瘫防治疗育中心,佳木斯大学儿童神经康复实验室,黑龙江佳木斯市154002;2.济宁市第一人民医院,山东济宁市272000;3.济宁市兖州区铁路医院,山东济宁市272100。作者简介:王玉昌(1987-),男,汉族,山东曹县人,硕士研究生,主要研究方向:小儿脑损伤的发病机制和防治研究。通讯作者:庞伟,男,副教授、副主任医师。E-mail:pangwei76@aliyun.com。
