时钟基因启动子甲基化频率随增龄的组织特异性改变①
2015-12-13祝艳秋陆璐李林蔡彦宁张兰
祝艳秋,陆璐,李林,蔡彦宁,张兰
时钟基因启动子甲基化频率随增龄的组织特异性改变①
祝艳秋1a,陆璐1a,李林1a,蔡彦宁1b,张兰1a
目的探索时钟基因启动子甲基化频率增龄性改变及其在衰老中的作用。方法4月龄(青年组,n=9)、20月龄(老年组,n=10)C57BL小鼠,采用甲基化特异性聚合酶链反应方法检测小鼠胃、脾、血管、肾、纹状体中时钟基因Per1/2、Bmal1/2、Cry1/2、Clock、Npas2启动子甲基化水平。结果老年组脾组织Cry1、Bmal2和NPas2启动子区甲基化频率高于青年组(P<0.05),胃组织Per1基因启动子甲基化频率低于青年组(P<0.05),血管组织Bmal1启动子区甲基化频率高于青年组(P<0.05)。结论多种时钟基因启动子甲基化可能参与衰老进程,并具有组织特异性。
衰老;昼夜节律;时钟基因;启动子甲基化
[本文著录格式]祝艳秋,陆璐,李林,等.时钟基因启动子甲基化频率随增龄的组织特异性改变[J].中国康复理论与实践, 2015,21(5):514-518.
CITED AS:Zhu YQ,Lu L,Li L,et al.Tissue-specific changes of clock DNA promoter methylation with aging[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(5):514-518.
昼夜节律是生物体内广泛存在的一种生命时钟,其周期约为24 h,它可以在分子生物学、生理学水平对大脑及外周等各种器官组织功能产生影响。研究显示,衰老能够导致昼夜节律异常,包括活动高峰幅度降低以及节律丢失;时钟基因表达及功能紊乱也影响衰老相关疾病,如老年健康女性发生昼夜活动节律减少,此类节律的延后将增加其患痴呆症和轻度认知障碍的风险,增加其死亡风险[1-3]。
昼夜节律由多种时钟基因,如Per1/2、Cry1/2、 Clock、Npas2、Bmal1/2等控制[4]。时钟基因具有节奏性的表达由相互关联的转录反馈/前馈回路产生,从而驱动生理和行为节律[5-6]。时钟基因DNA启动子CpG岛区域甲基化是基因转录的主要调控方法之一。有研究证实,时钟基因启动子甲基化水平升高能抑制基因表达[7]。目前已有研究发现,衰老相关疾病患者体内存在部分时钟基因甲基化异常,如帕金森病患者体内Npas2基因启动子甲基化水平显著降低[8-9]。
以前的研究证实,在C57小鼠组织中存在多种时
钟基因启动子的甲基化[10]。本研究观察C57衰老小鼠不同组织时钟基因启动子甲基化的增龄性改变,探索时钟基因启动子甲基化在衰老过程中的作用,以及时钟基因启动子甲基化在中枢和外周组织中的差异。
1 材料与方法
1.1 材料
Wizard DNA purification resin:PROMEGA公司。CpG甲基化酶SssI:NEW ENGLAND BIOLAB公司。HS Taq:TAKARA公司。引物合成:上海生工生物有限公司。
1.2 动物
雄性C57BL/6J小鼠,购自军事医学科学院实验动物中心,SPF级,许可证号SCXK(军)2007-004。3月龄小鼠10只饲养17个月至20月龄,作为老年组。老年组饲养至19月龄时,另购入3月龄小鼠9只饲养1个月至4月龄作为青年组。明暗时间为12 h∶12 h,室温恒温23℃,任意摄取水食。
1.3 取材
所有小鼠至预定月龄后,于同一时间点全部处死。取小鼠新鲜组织胃、血管、脾、肾及纹状体,冻存于-80℃待用。
1.4 甲基化特异性聚合酶链式反应
按TIANamp Genomic DNA Kit说明书提取小鼠基因组DNA。使用偏重亚硫酸钠和对苯二酚对基因组DNA进行处理,使未发生甲基化的胞嘧啶转化成尿嘧啶,甲基化的胞嘧啶则未发生转化。采用在线软件(www.mspprimer.org/cgi-mspprimer/design.cgi)分析时钟基因Per1/2、Cry1/2、Clock、Npas2、Bmal1/2的启动子序列,并用该软件设计每个时钟基因的甲基化引物和非甲基化引物各一套[11]。DNA启动子区域出现部分甲基化以“PM”表示,未出现甲基化以“U”表示。
1.5 统计学分析
数据处理采用SPSS 16.0软件。采用Fisher确切概率法对各组不同部位8种时钟基因的甲基化频率分别进行比较。显著性水平α=0.05。
2 结果
2.1 纹状体
青年组Cry1、Cry2启动子甲基化,老年组Cry1启动子甲基化。老年组Cry1和Cry2甲基化率与青年组相比无显著性差异(P>0.05)。见表1。
2.2 脾
青年组各时钟基因启动子均无甲基化,老年组Cry1、Bmal2和Npas2启动子区甲基化率比青年组升高(P<0.05)。见表2。
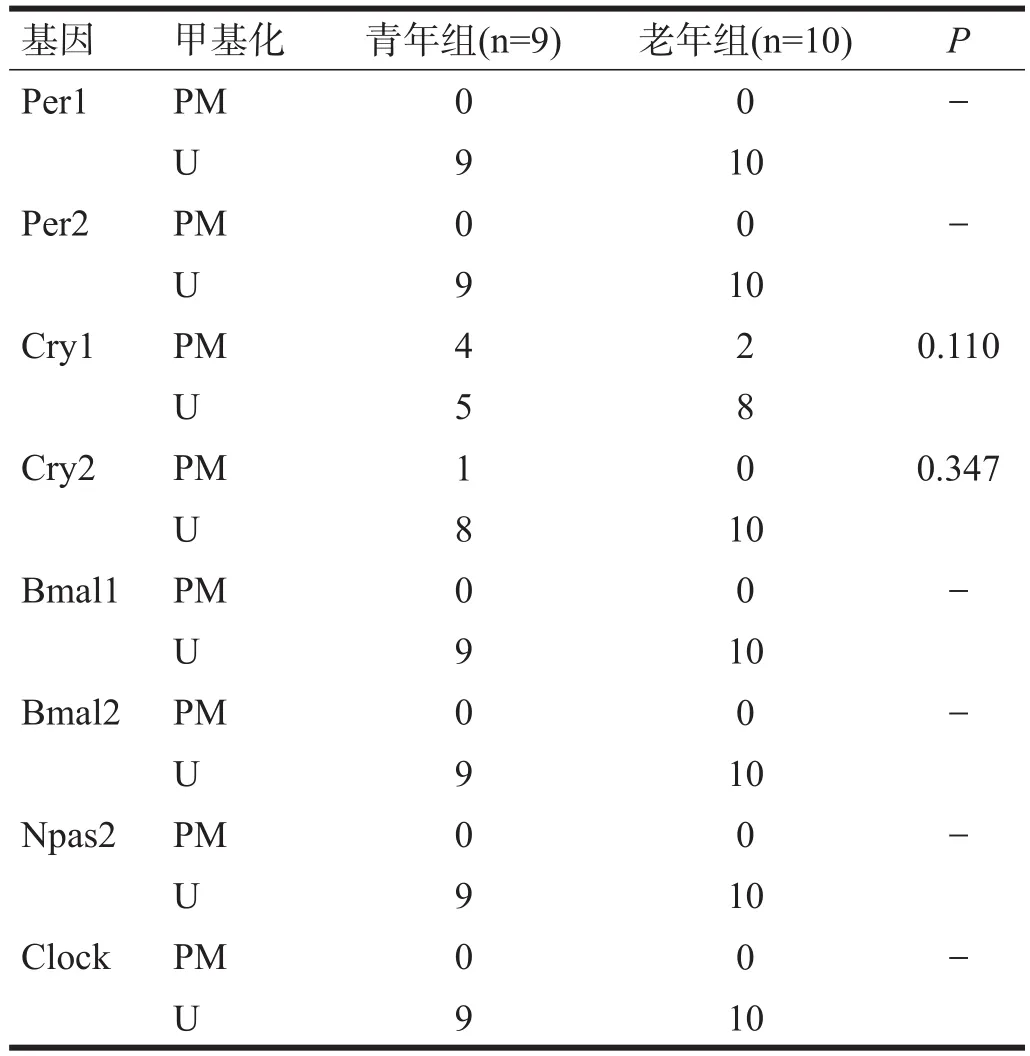
表1 两组小鼠纹状体时钟基因启动子区甲基化水平(n)
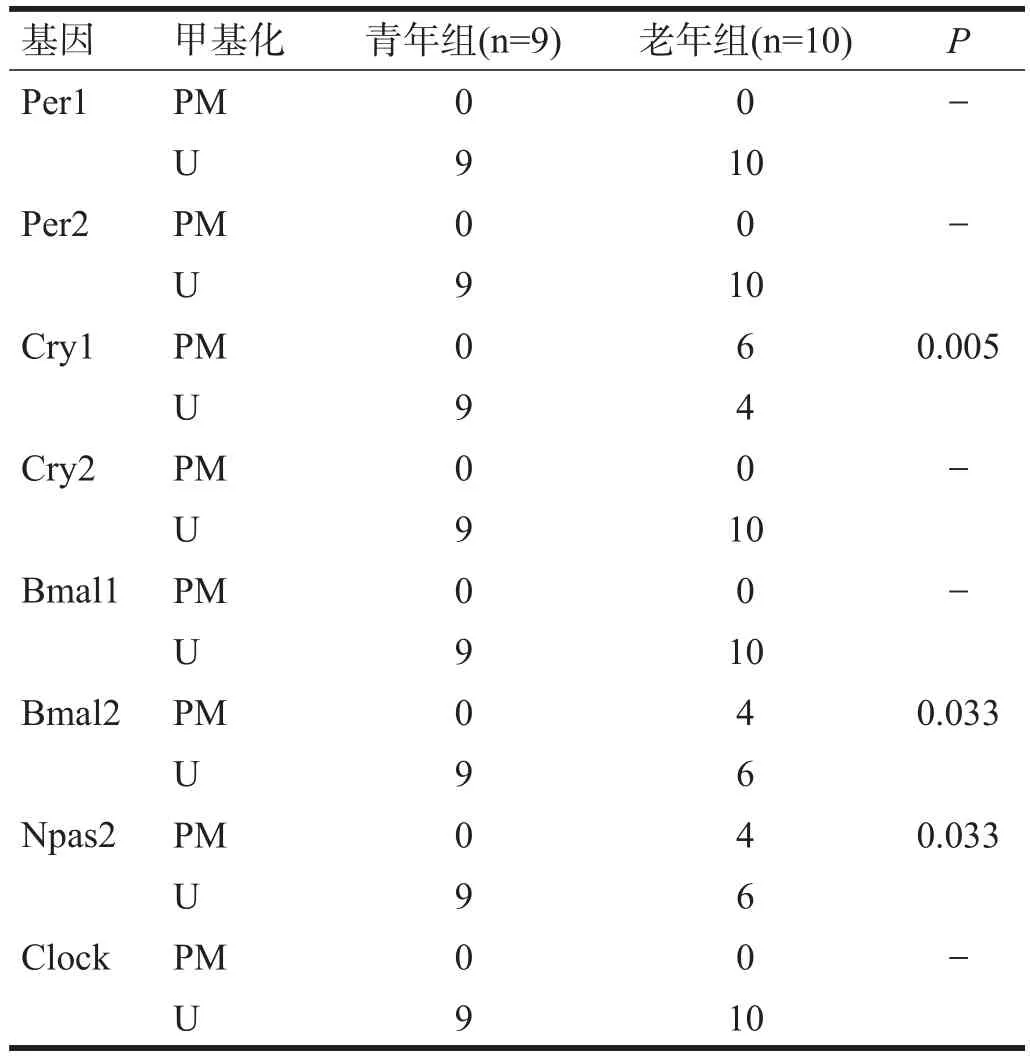
表2 两组小鼠脾组织时钟基因启动子区甲基化水平(n)
2.3 胃
青年组和老年组Per1、Cry1和Bmal1启动子均有甲基化。老年组Per1启动子甲基化率降低(P<0.05),而Cry1和Bmal1启动子甲基化率与青年组相比无显著
性差异(P>0.05)。见表3。
2.4 血管
青年组Bmal1、Bmal2启动子甲基化,老年组Cry1、Cry2、Bmal1启动子甲基化,老年组Bmal1甲基化率比青年组升高(P<0.05)。见表4。
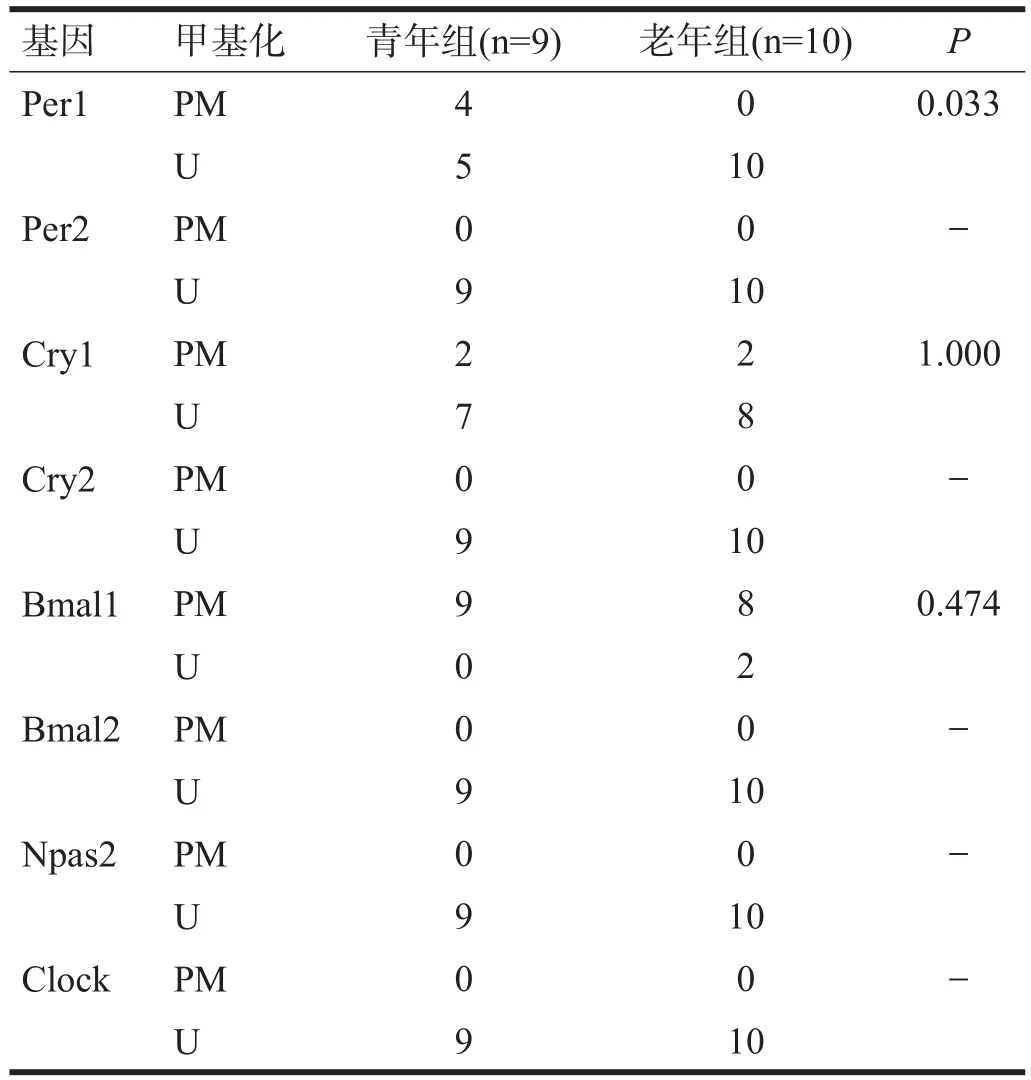
表3 两组小鼠胃组织时钟基因启动子区甲基化水平(n)
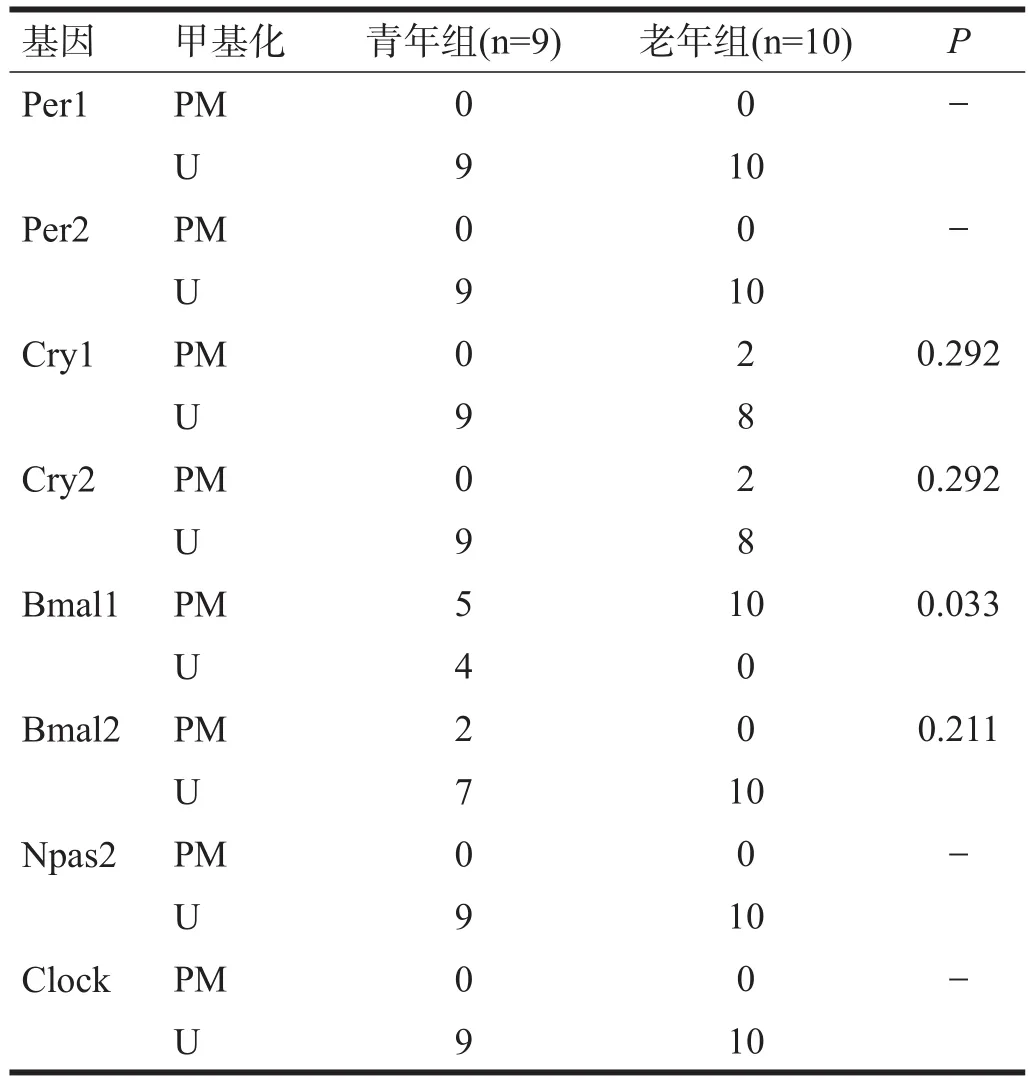
表4 两组小鼠血管组织时钟基因启动子区甲基化水平(n)
2.5 肾
青年组Cry1和Bmal2启动子甲基化,老年组Cry1启动子甲基化,两组各基因启动子甲基化率均无显著性差异(P>0.05)。见表5。
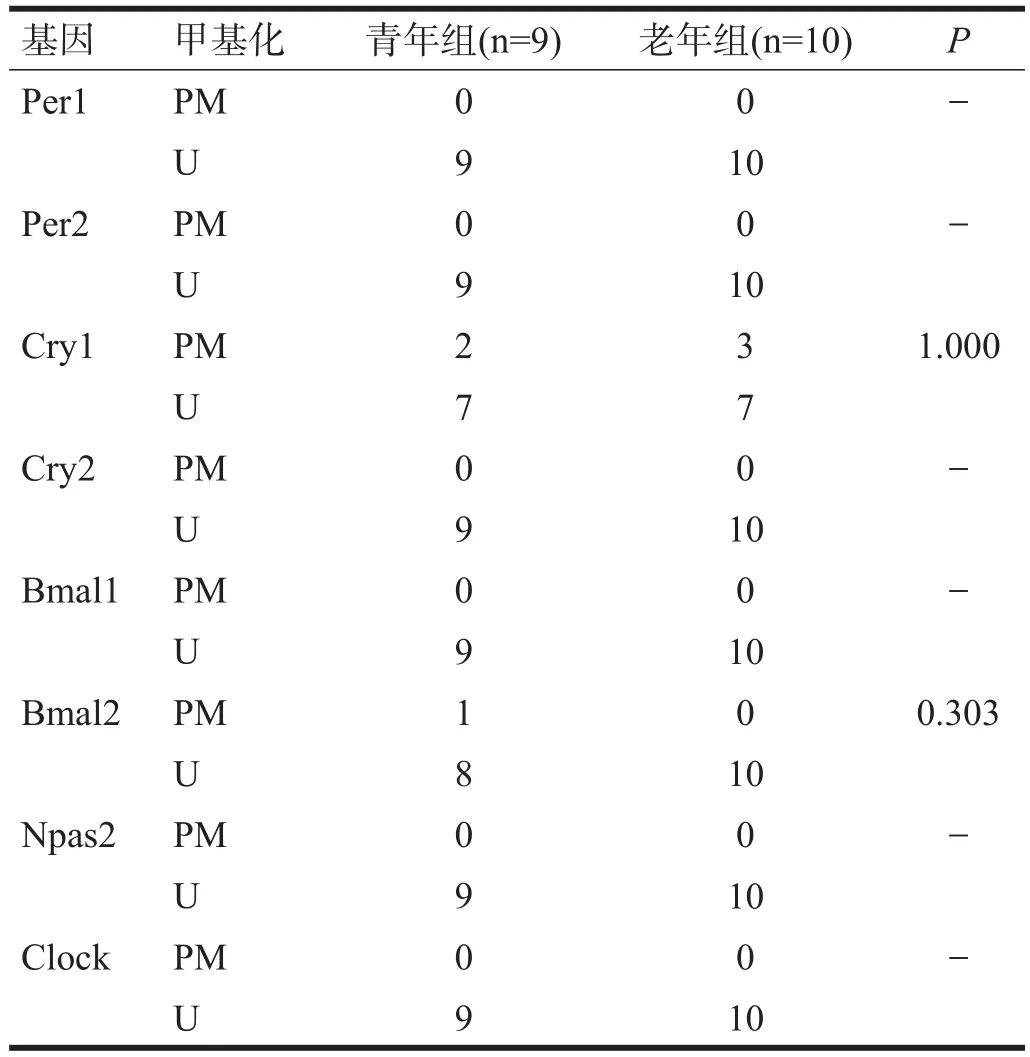
表5 两组小鼠肾组织时钟基因启动子区甲基化水平(n)
3 讨论
近年研究发现,衰老个体及衰老相关疾病患者体内出现昼夜节律的异常[12]。昼夜节律由多种时钟基因调控[4],其DNA启动子CpG岛区域甲基化是基因转录的表观遗传主要调控方法之一[13]。检测时钟基因的RNA水平是研究基因表达水平较直接的手段,但由于RNA检测对于样本提取的要求较高,导致该法的应用较为局限。已有文献证实,DNA甲基化水平增高能够抑制基因表达[7],因此,本研究采用甲基化特异性聚合酶链式反应(methylation-specific polymerase chain reaction,MSP)检测DNA甲基化水平,间接反映基因表达的变化。该法对样本要求较低,操作快速简单,具有更高的使用价值。由于MSP为定性检测,我们通过比较样本中甲基化的发生频率,检测DNA启动子CpG岛区域甲基化水平差异。
Cry基因是生物钟基因负反馈环的主要成员[14]。Cry基因所表达的隐花色素(Cryptochrome)是一种感光受体,能够调节植物的生长和发育,以及动植物的生物节律[15]。以往研究发现,衰老果蝇Cry基因mRNA和蛋白表达均显著减少[16]。Cry1和Cry2缺陷小鼠作为衰老模型,与野生型小鼠相比不仅认知功能降低,而且睡眠周期紊乱[17]。本研究显示,Cry1启动子甲基化在老年组中枢神经组织和外周组织中均出现,尤其在衰老小鼠脾中,Cry1启动子甲基化频率比青年组增
高。已有证据显示,DNA的甲基化能够导致不可逆的启动子沉默,从而下调基因表达[7]。有研究证实,Cry1和Cry2的减少能够导致脾细胞中肿瘤坏死因子-α和活化的CD3+/CD69+T细胞增多[18]。脾组织Cry1启动子甲基化增高,下调Cry1表达,可能加速免疫系统的衰老进程。
Bmal1在时钟基因转录-翻译反馈环路中起正向调节作用,它与视交叉上核以及外周时钟细胞的生物节律高度相关[19]。已有研究指出,Bmal1功能障碍会导致生物钟紊乱,且Bmal1缺失(Bmal1-/-)小鼠寿命减少,过早表现出衰老相关的表型[20-21]。研究证实,Bmal1基因缺失能在衰老过程中轻度影响血管促凝和抗凝途径,随着衰老进程,内皮功能障碍增加,血栓形成风险增加[22]。Bmal1启动子甲基化在血管组织中增加,下调Bmal1基因表达,可能引起衰老相关血管疾病。
作为Bmal1的旁系同源物,Bmal2同样被证实与衰老相关。近期一项研究显示,Bmal2的基因多态性与中国人对阿尔茨海默病的易感性相关[23]。Bmal2在帕金森病患者特定时间的白细胞中表达水平降低,提示Bmal2与衰老或疾病引起的免疫细胞功能异常相关[24]。本研究显示,Bmal2启动子甲基化频率在老年小鼠脾组织中明显升高,导致Bmal2在脾组织中表达降低,可能加速脾组织衰老进程。有待进一步探究。
Npas2最初在哺乳动物前脑中发现,但已被证明在外周组织中同样表达[25]。它作为生物节律转录因子,与Bmal1形成二聚体,激活其他核心时钟基因[26]。研究证实,Npas2与衰老存在联系,Npas2与Clock基因共同减少能够导致衰老相关的神经退行性病变[27]。有研究指出,风湿性关节炎患者体内Npas2的表达延迟,影响白细胞介素的节律性生产,在诸多时钟基因中,它是与人体免疫炎症状态最相关的基因之一[28]。Npas2在衰老脾组织中甲基化频率增加,下调脾中Npas2的表达,可能导致免疫系统老化,从而引起免疫相关疾病。
Per1是时钟基因负反馈调控的主要转录因子之一,它与Cry基因相互作用后抑制Clock/Bmal1二聚体的转录活性[29]。Per1基因不仅是主要的时钟基因,其表达存在节律性并且与衰老高度相关[30-31]。目前针对Per1作用于衰老的研究较少。本研究显示,衰老小鼠胃组织中Per1基因启动子甲基化频率低于青年组,表明衰老小鼠胃组织Per1表达增加,可能引起衰老所致的胃功能减退。
我们的研究显示,衰老小鼠脾、胃和血管组织中均出现时钟基因启动子甲基化频率的改变,特别是在衰老小鼠脾组织中,Cry1、Bmal2、Npas2的甲基化频率均显著减少,提示时钟基因甲基化改变可能与免疫系统的老化相关性较高。此外,衰老小鼠胃组织Per1启动子甲基化频率降低,血管组织Bmal1启动子甲基化频率升高,而中枢神经组织纹状体中并未出现甲基化频率的改变。基于以上结果,我们的研究提示,时钟基因启动子在衰老小鼠不同组织中甲基化频率的改变存在差异,时钟基因启动子甲基化的增龄性改变具有组织特异性。
纹状体作为中枢神经组织,其时钟基因甲基化水平与外周的脾、胃和血管组织存在明显差异。衰老小鼠模型中枢组织时钟基因启动子甲基化发生率较低,而外周组织时钟基因甲基化发生率较高。虽然有研究发现,衰老小鼠、大鼠以及阿尔茨海默病患者脑组织整体基因组DNA甲基化水平有所降低[32],但目前尚无针对衰老个体中枢组织时钟基因启动子CpG岛甲基化的研究报道。我们认为,衰老小鼠中枢组织时钟基因启动子CpG岛甲基化可能不是导致其昼夜节律改变的主要因素。
综上所述,衰老小鼠时钟基因Cry1、Per1、Bmal1、Bmal2、Npas2启动子CpG区域甲基化频率与青年小鼠相比有显著性差异,这种差异存在明显的组织特异性,提示时钟基因启动子甲基化对生物钟的调节在衰老小鼠不同组织中的作用可能不同。时钟基因Cry1、Per1、Bmal1/2、Npas2启动子区域甲基化与衰老相关,可能作为抗衰老药物研究的新靶点。
[1]Tranah GJ,Blackwell T,Ancoli-Israel S,et al.Circadian activity rhythms and mortality:the study of osteoporotic fractures[J].JAm Geriatr Soc,2010,58(2):282-291.
[2]Tranah GJ,Blackwell T,Stone KL,et al.Circadian activity rhythms and risk of incident dementia and mild cognitive impairment in older women[J].Ann Neurol,2011,70(5): 722-732.
[3]Yu EA,Weaver DR.Disrupting the circadian clock:gene-specific effects on aging,cancer,and other phenotypes[J].Aging (Albany NY),2011,3(5):479-493.
[4]Fu L,Kettner NM.The circadian clock in cancer development and therapy[J].Prog Mol Biol Transl Sci,2013,119:221-282.
[5]Arellanes-Licea E,Caldelas I,De Ita-Perez D,et al.The circadian timing system:a recent addition in the physiological mecha-
nisms underlying pathological and aging processes[J].Aging Dis,2014,5(6):406-418.
[6]Reppert SM,Weaver DR.Coordination of circadian timing in mammals[J].Nature,2002,418(6901):935-941.
[7]Klose RJ,Bird AP.Genomic DNA methylation:the mark and its mediators[J].Trends Biochem Sci,2006,31(2):89-97.
[8]Lim AS,Srivastava GP,Yu L,et al.24-hour rhythms of DNA methylation and their relation with rhythms of RNA expression in the human dorsolateral prefrontal cortex[J].PLoS Genet, 2014,10(11):e1004792.
[9]Lin Q,Ding H,Zheng Z,et al.Promoter methylation analysis of seven clock genes in Parkinson's disease[J].Neurosci Lett, 2012,507(2):147-150.
[10]Ji Y,Qin Y,Shu H,et al.Methylation analyses on promoters of mPer1,mPer2,and mCry1 during perinatal development[J]. Biochem Biophys Res Commun,2010,391(4):1742-1747.
[11]林庆玲,蔡彦宁,袁艳鹏,等.小鼠外周组织时钟基因启动子区甲基化分析[J].基础医学与临床,2012,32(10):1118-1125.
[12]Landry GJ,Liu-Ambrose T.Buying time:a rationale for examining the use of circadian rhythm and sleep interventions to delay progression of mild cognitive impairment to Alzheimer's disease[J].FrontAging Neurosci,2014,6:325.
[13]Ndlovu MN,Denis H,Fuks F.Exposing the DNA methylome iceberg[J].Trends Biochem Sci,2011,36(7):381-387.
[14]Destici E,Jacobs EH,Tamanini F,et al.Altered phase-relationship between peripheral oscillators and environmental time in Cry1 or Cry2 deficient mouse models for early and late chronotypes[J].PLoS One,2013,8(12):e83602.
[15]Yu X,Liu H,Klejnot J,et al.The Cryptochrome Blue Light Receptors[J].TheArabidopsis Book,2010,8:e135.
[16]Rakshit K,Giebultowicz JM.Cryptochrome restores dampened circadian rhythms and promotes healthspan in aging Drosophila[J].Aging Cell,2013,12(5):752-762.
[17]Van der Zee EA,Havekes R,Barf RP,et al.Circadian time-place learning in mice depends on Cry genes[J].Curr Biol,2008,18(11):844-848.
[18]Hashiramoto A,Yamane T,Tsumiyama K,et al.Mammalian clock gene Cryptochrome regulates arthritis via proinflammatorycytokine TNF-alpha[J].JImmunol,2010,184(3): 1560-1565.
[19]Bunger MK,Wilsbacher LD,Moran SM,et al.Mop3 is an essential component of the master circadian pacemaker in mammals[J].Cell,2000,103(7):1009-1017.
[20]Kondratov RV,Kondratova AA,Gorbacheva VY,et al.Early aging and age-related pathologies in mice deficient in BMAL1, the core componentof the circadian clock[J].Genes Dev,2006, 20(14):1868-1873.
[21]Khapre RV,Kondratova AA,Patel S,et al.BMAL1-dependent regulation of the mTOR signaling pathway delays aging[J].Aging(Albany NY),2014,6(1):48-57.
[22]Hemmeryckx B,Van Hove CE,Fransen P,et al.Progression of the prothrombotic state in aging Bmal1-deficient mice[J]. Arterioscler Thromb Vasc Biol,2011,31(11):2552-2559.
[23]Qing-Xiu L,Chang-Quan H,Qian C,et al.The polymorphism of ARNTL2(BMAL2)gene rs2306074 C>T is associated with susceptibility of Alzheimer disease in Chinese population[J]. Neurol Sci,2014,35(11):1743-1747.
[24]Ding H,Liu S,Yuan Y,et al.Decreased expression of Bmal2 in patients with Parkinson's disease[J].Neurosci Lett,2011, 499(3):186-188.
[25]Ptitsyn AA,Zvonic S,Conrad SA,et al.Circadian clocks are resounding in peripheral tissues[J].PLoS Comput Biol,2006,2 (3):e16.
[26]Crumbley C,Wang Y,Kojetin DJ,et al.Characterization of thecoremammalianclockcomponent,NPAS2,asa REV-ERBα/RORα target gene[J].J Biol Chem,2010,285 (46):35386-35392.
[27]Musiek ES,Lim MM,Yang G,et al.Circadian clock proteins regulateneuronalredoxhomeostasisandneurodegeneration[J].J Clin Invest,2013,123(12):5389-5400.
[28]Kouri VP,Olkkonen J,Kaivosoja E,et al.Circadian timekeeping is disturbed in rheumatoid arthritis at molecular level[J]. PLoS One,2013,8(1):e54049.
[29]Richards J,All S,Skopis G,et al.Opposing actions of Per1 and Cry2 in the regulation of Per1 target gene expression in the liver and kidney[J].Am J Physiol Regul Integr Comp Physiol, 2013,305(7):R735-R747.
[30]Wongchitrat P,Govitrapong P,Phansuwan-Pujito P.The expression of Per1 and Aa-nat genes in the pineal gland of postnatal rats[J].J MedAssoc Thai,2012,95(Suppl 12):S69-S75.
[31]Olbrich D,Dittmar M.The cortisol awakening response is related with PERIOD1 clock gene expression in older women[J].Exp Gerontol,2012,47(7):527-533.
[32]Tong Z,Han C,Qiang M,et al.Age-related formaldehyde interferes with DNA methyltransferase function,causing memory loss in Alzheimer's disease[J].Neurobiol Aging,2015,36 (1):100-110.
Tissue-specific Changes of Clock DNAPromoter Methylation withAging
ZHU Yan-qiu1a,LU Lu1a,LI Lin1a,CAI Yan-ning1b,ZHANG Lan1a
1.a.Department of Pharmacology,b.Department of Neurobiology,Xuanwu Hospital,Capital Medical University, Beijing 100053,China
Objective To investigate the role of the clock gene promoter methylation in aging.Methods C57BL mice of 4-(young,n=9) and 20-(old,n=10)month-old were determined the promoter methylation level of clock genes(Per1/2,Bmal1/2,Cry1/2,Clock,Npas2)in the stomach,spleen,vascular,kidney and striatum with methylation-specific polymerase chain reaction(MSP).Results The incidence of promoter methylation of Cry1,Bmal2 and Npas2 in spleen increased in old mice(P<0.05),while the promoter methylation of Per1 in stomach decreased(P<0.05),and the promoter methylation of Bmal1 in vascular increased(P<0.05).Conclusion Promoter methylation of some clock genes is involved in process of aging in a tissue-specific way.
aging;circadian rhythm;clock genes;promoter methylation
10.3969/j.issn.1006-9771.2015.05.005
R339.3
A
1006-9771(2015)05-0514-05
2015-02-27
2015-04-07)
1.国家自然科学基金项目(No.81473373);2.北京市自然科学基金项目(No.7132110);3.北京市中医管理局重点项目(No. KJTS2011-04);4.北京市新世纪百千万人才工程项目(No.008-0014);5.首都卫生发展科研专项项目(No.首发2011-1001-05);6.北京市教委新医药学科群项目(No.XK100270569)。
1.首都医科大学宣武医院,a.药物研究室;b.神经生物室,北京市100053。作者简介:祝艳秋(1990-),女,汉族,江苏泰州市人,硕士研究生,主要研究方向:神经药理学,抗衰老药理学。通讯作者:张兰(1972-),女,北京市人,博士,教授,研究员,硕士研究生导师,主要研究方向:神经药理学、中药药理学、抗衰老药理学。E-mail:lanizhg@hotmail.com。
