2型单纯疱疹病毒对HaCaT细胞分泌IL-17和IL-23 mRNA的影响
2015-12-13张杰邵勇于波
张 杰 邵 勇 于 波
2型单纯疱疹病毒对HaCaT细胞分泌IL-17和IL-23 mRNA的影响
张 杰 邵 勇 于 波
目的: 检测2型单纯疱疹病毒(HSV-2)感染后HaCaT细胞分泌IL-17、IL-23 mRNA的水平变化,明确IL-17和IL-23与角质形成细胞(KC)是否参与了HSV-2病毒感染初期的免疫防御机制。方法: 用HSV-2病毒感染HaCaT细胞,采用荧光实时定量PCR检测感染后24 h、48 h、72 h及空白对照组IL-17、IL-23mRNA的表达。结果: HSV-2病毒感染后72 h HaCaT细胞分泌IL-17mRNA的表达量低于对照组,而IL-23 mRNA表达量高于对照组(P<0.05)。结论: 在HSV-2感染KC初期,IL-17和IL-23可能参与早期免疫防御反应。
2型单纯疱疹病毒; 角质形成细胞; 白介素-17; 白介素-23
近年来研究发现KC不仅具有机械性屏障功能作用还具有分泌多种细胞因子的免疫防御能力,在原发性生殖器疱疹感染过程初期,KC起到了第一道防御屏障的作用。在前期的研究中我们发现在生殖器疱疹病毒感染早期,KC能直接分泌IFNα1、α2、β1对HSV进行天然免疫作用。1本文对HSV-2感染KC早期KC分泌IL-17、IL-23进行检测,以探讨KC在HSV-2感染早期免疫调节作用。
1 材料与方法
1.1 材料
1.1.1 细胞 人永生化表皮细胞株HaCaT细胞购自美国标准生物品收藏中心(ATCC)。非洲绿猴肾细胞株VERO细胞、人单纯疱疹病毒II型:均由中国疾病预防控制中心病毒病预防控制所段书敏教授提供。
1.1.2 主要试剂 RPMI1640和DMEM干粉、胎牛血清、胰蛋白酶和细胞培养用青霉素-链霉素:GIBCO公司。Trizol、SYBR Green:Invitrogen公司。cDNA反转录试剂盒(RevertAidTMFirst Strand cDNA Synthesis Kit)、tag酶、dNTP:Fermentas。WST1试剂盒:Takara公司。PCR引物:上海生工,引物序列,见表1。
1.1.3 仪器及器材 CO2孵箱(美国热电3111型),倒置相差显微镜(日本Olympus CKX41型),普通PCR仪(Bio-RAD),荧光定量 PCR仪(Bio-RAD Chromo4),DNA凝胶分析系统(美国Wealltec),酶标仪(Bio-RAD Model 680型)。
1.2 实验方法
1.2.1 细胞培养 HaCaT细胞与 VERO细胞均在DMEM培养液中培养,另加10%胎牛血清,100 U/mL青霉素和50 U/m L链霉素。细胞在37℃、5%CO2条件下培养。细胞达到70%密度时进行传代,传代时去除培养液,使用DPBS润洗细胞1次,加入0.25%胰蛋白酶,37℃、5%CO2条件下消化5 min,消化后按照1∶10比例传代。
1.2.2 HSV-2病毒扩增 将VERO细胞培养至90%密度,换用无血清的 DMEM培养基,将病毒液以1∶100体积比加入细胞培养基中,37℃、5%CO2条件下培养24~48 h,观察细胞形态,当达到70%细胞发生破碎后,收集全部细胞和培养基,冻存于-80℃。将
冻存病毒液于室温融化,再次复冻于-80℃。反复3次,使全部VERO细胞破裂,释放病毒。将病毒液于室温12 000 g离心15 min,保存上清,用做病毒计数和感染使用。
1.2.3 HSV-2病毒计数 制备1%琼脂糖培养基,方法如下:将0.2克琼脂糖加入2 mL DPBS中,高温高压灭菌15 min。灭菌后加入含有10%胎牛血清和青霉素-链霉素的DMEM培养基18 mL,混匀,40℃水浴保存。将VERO细胞以5×105/孔接种于6孔板,接种8 h后按照10-2到10-7等级稀释比例接种病毒液。病毒感染后1 h,去除培养基,加入1%琼脂糖培养基2 mL/孔,室温凝固,于37℃、5%CO2条件下孵育。连续观察7~10 d,进行空洞计数,计算病毒浓度。
1.2.4 HSV-2病毒感染HaCaT细胞 将3×106个HaCaT细胞接种于100 mm培养皿,细胞贴附后加入病毒液,终浓度为0.1PFU。对照组为同体积灭活病毒液(将病毒液于56℃水浴孵育2 h灭活)。病毒感染后3 h,更换为新鲜培养基。从加入病毒开始计时,分别培养细胞24 h、48 h、72 h。
1.2.5 总RNA提取和反转录获得cDNA 在不同时间点取感染后的HaCaT细胞,吸取培养液-80℃保存,细胞层中加入1 m L Trizol试剂,室温孵育5 min,吸取Trizol细胞裂解液,加入0.2 m L氯仿,混匀,室温孵育2 min,12 000 g于4℃离心15 min,离心后将上层无色水相层吸出保留,加入0.5 mL异丙醇,混匀,室温孵育10 min,12 000 g于4℃离心10 min。去除上清,使用70%乙醇清洗沉淀,7500 g于4℃离心5 min,去除上清,空气干燥10 min。加入DEPC水溶解RNA,测量RNA浓度。取1 g RNA进行cDNA反转录,方法根据RevertAidTMFirst Strand cDNA Synthesis Kit试剂盒说明书进行。获得cDNA后使用GAPDH引物进行PCR扩增,检测cDNA质量。PCR扩增条件如下:95℃预变性5min,继之进行30个循环,包括95℃ 30 s,60℃ 30 s,72℃ 30 s,最后72℃延伸10 min。将5μL扩增产物于质量分数为2%琼脂糖凝胶电泳,DNA凝胶分析系统观察照相。
1.2.6 荧光实时定量PCR PCR反应体系中加入SYBR Green染料以及不同引物,进行荧光实时定量PCR。PCR扩增条件如下:95℃预变性5 min,继之进行35个循环,包括95℃ 30 s,60℃ 30 s,72℃ 30 s。
1.2.7 实验4~6步重复3次。
1.2.8 统计学方法 采用t检验,用SPSS 13.0统计软件进行处理,P<0.05为差异有统计学意义。
2 结果
2.1 HSV-2病毒浓度计数结果 HSV-2经接种孵育后,连续观察7~10 d,进行空洞计数,本实验中病毒液滴度计数结果为1×107PFU/mL。
2.2 HSV-2感染HaCaT细胞IL-17的表达 经荧光实时定量PCR检测,IL-17 mRNA表达量比对照组显著降低(表1,图1),差异有统计学意义(P<0.05)。

表1 HSV-2对HaCaT细胞分泌IL-17的影响

图1 HSV-2对HaCaT细胞分泌IL-17的影响
2.3 HSV-2感染HaCaT细胞IL-23的表达 经荧光实时定量PCR检测,IL-23 mRNA表达量比对照组显著升高(表2,图2),差异有统计学意义(P<0.05)。
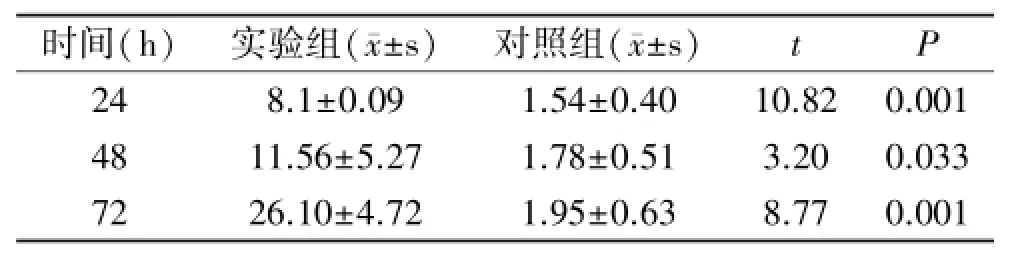
表2 HSV-2对HaCaT细胞分泌IL-23的影响

图2 HSV-2对HaCaT细胞分泌IL-23的影响
3 讨论
HSV-2病毒是一种有包膜的DNA病毒,主要通过直接接触皮肤及黏膜引起感染,对于防范HSV-2病毒感染的第一道屏障-KC逐渐成为研究热点。表皮不仅是机体对外界环境的机械屏障,它还是一个活跃的免疫器官,其中作用之一是在炎症反应中起主要作用的细胞因子产生,且与机体总的反应相一致。机体接触HSV-2病毒感染后首先在角质形成细胞中大量复制并扩散感染其他细胞,引起表皮炎症和坏死,因此研究生殖器疱疹感染初期作为第一道屏障的角质形成细胞的免疫状态具有重要的意义。
IL-17主要由Th17细胞分泌,还可以由巨噬细胞、树突状细胞以及自然杀伤细胞产生。2本研究证实IL-17亦可以由KC产生。既往研究认为IL-17参与了机体抗感染免疫过程,包括真菌感染、3细菌感染、寄生虫感染及病毒感染。4在抗病毒方面,大多数研究表明在急性病毒感染期IL-17表达上升,部分研究证实IL-17可诱导人表皮细胞内皮细胞和成纤维细胞分泌IL-6、IL-8、粒细胞集落刺激因子(G-CSF)和细胞间黏附分子(ICAM-1),加强局部炎症反应。IL-17也参与中性粒细胞的增殖、成熟和趋化,对T细胞的活化起协同刺激作用,并能促进树突状细胞的成熟,还可促进NK细胞形成和IFN-γ的产生,以此来发挥其抗病毒作用。5在本研究中HaCaT细胞被HSV-2感染后24 h、48 h、72 h IL-17 mRNA表达量比对照组显著降低,推测HSV-2感染KC后对KC产生了破坏效应,使细胞形态改变,细胞功能部分破坏,导致IL-17表达减少,以此增加HSV-2感染的侵袭性。但同时我们发现在HaCaT细胞被HSV-2感染后24 h、48 h、72 h IL-23mRNA表达量比对照组显著升高,尤其以48 h后分泌水平大幅上升。以往研究认为IL-23是由树突状细胞和其它抗原提呈细胞产生,IL-23能诱导Th17的分化,且IL-23是分泌IL-17的效应细胞发育的必需条件,在体内对于维持Th17细胞的稳定及增殖有重要影响。6本研究证实KC也可以分泌IL-23,并且在HSV-2感染时呈反应性上升以促进真皮Th17细胞分化并诱导IL-17产生,参与抗病毒作用。但在KC中是否存在IL-17/IL-23调节机制仍需进一步研究。
本研究表明在HSV-2感染KC早期,KC具有一定天然免疫防御作用,KC可通过分泌IL-17、IL-23等细胞因子来实现抗病毒的免疫调节,调控或诱导机体免疫细胞及细胞因子网络,实现病毒感染早期天然免疫作用,从而对生殖器疱疹的早期防治提供理论基础。
1张杰,钟绮丽,朱亦男,等.2型单纯疱疹病毒对HaCaT细胞分泌I型干扰素的影响.中国麻风皮肤病杂志,2010,26(1): 20-22.
2Kom T,Bettelli E,Oukka M,et al.IL-17 and Th17 cells.Annu Rev Immunol,2009,27:485-517.
3 Zelante T,De luca A,Bonifazi P,et al.IL-23 and the Th17 pathway promote inflammation and impair antifungal immune resistance.Eur J Immunol,2007,37(10):2695-2706.
4 Lafdil F,MiUer AM,Ki SH,et al.Th17 cells and their associated cytokines in liver diseases.Cell Mol Immunol,2010,7(4): 250-254.
5 Bhave NS,Carson WE 3rd.Immunemodulation with interleukin-21.Ann N Y Acad Sci,2009,1182:39-46.
6Stockinger B,Veldhoen M.Differentiation and function of Th17 T cells.Curt OpinImmunol,2007,l9(3):281-286.
(收稿:2014-09-28 修回:2014-10-29)
Influence of HSV-2 on them RNA expression of IL-17 and IL-23m RNA secreated by HaCaT cell
ZHANG Jie,SHAO Yong,YU Bo.Department of Dermatology,Peking University Shenzhen Hospital,Shenzhen,518036
Objective:To detect the changes of IL-17 and IL-23mRNA levels in HaCaT cells after infected by HSV-2,in order to determine whether or not the IL-17 and IL-23 are involved in the defense immune mechanism to HSV-2 infection.M ethods:The levels of IL-17 and IL-23mRNA in HaCaT cellswere detected by Real-time PCR after 24 h,48 h and 72 h after infected by HSV-2.Results:The level of IL-23 mRNA was higher than that in the control group after 72 h infected by HSV-2(P<0.05),while the level of IL-17 mRNA was lower than that in the control group(P<0.05).Conclusion:IL-17 and IL-23 may play an important role in the defense immunemechanism of KC to HSV-2 in the early stage of the infection.
HSV-2;Keratinocyte;IL-17;IL-23
北京大学深圳医院皮肤科,深圳,518036
