分子分型基础上治疗老年舒张性心力衰竭的临床观察
2015-12-11隋小芳王淑秋黄佳滨
隋小芳 王淑秋 黄佳滨 杨 泽
舒张性心力衰竭(diastolic heart failure,DHF)是一组以具有心力衰竭的症状和体征,左心室射血分数正常、心室壁增厚而舒张功能异常为特征的临床综合征[1]。其发病率约占全部心力衰竭患者的30%~50%[2]。随着人口老龄化程度日趋严重,DHF 的发病率和死亡率呈不断上升的趋势,是一个值得严重关切的临床问题[3,4]。DHF 常发生于收缩性心力衰竭之前,故对其早期诊断和积极防治可减少全心衰竭的发病率。
美托洛尔作为选择性β1受体阻滞剂的代表药物,可以通过多种机制改善左室舒张功能,并已广泛应用于临床,但临床应用时发现该药物的疗效和不良反应的个体差异极大。随着循证医学的发展,临床用药模式正从诊断导向型转向在基因分子分型基础上的模式,研究证明,β1受体基因ADRB1 和药物代谢酶CY P2D6* 10 两种基因多态性是导致美托洛尔药物代谢个体的最主要因素[5],而前者决定了受体对药物的敏感性,后者反应了药物在肝脏的代谢类型。研究已经实ADRB1 基因的突变型纯和子Arg/Arg(对应基因型CC)和杂合子Arg/Gly(对应基因型GC)对β 受体阻滞剂是有反应的,而野生型纯和子Gly/Gly(对应基因型GG)却反应低下。而且相关显示,尽管国内携带ADRB1 389 位携带Arg 等位基因(对应基因型CC 和GC)的比例高达80%以上,但ADRB1 阻滞剂的临床疗效却并不理想,其中一个重要的原因就是代谢酶CYP2D6* 10 的基因多态性影响β1受体阻滞剂在肝脏的代谢,进一步导致了疗效个体的差异。因此可以根据CYP2D6* 10 基因分型结果针对性地对ADRB1 基因型为CC和GC 药物反应者前瞻性地给药,即在基因分子分型基础上的个体化治疗来提高药物的疗效,减少其副作用。目前国内外关于美托洛尔在基因分子分型基础上治疗主要用于原发性高血压,而且多是单基因分子分型基础上治疗,尚未见美托洛尔双基因分子分型基础上治疗在老年DHF 中应用的报道,故本研究旨在探讨根据ADRB1 和CY P2D6* 10 基因变异在老年舒张性心力衰竭(DHF)患者中进行美托洛尔在基因分子分型基础上治疗的临床疗效及安全性。
1 材料与方法
1.1 材料 选取我院老年病科、心内科门诊及住院处诊治的老年DHF 患者120 例,所有患者诊断符合《欧洲心脏病学会慢性心力衰竭诊断和治疗指南》DHF 的诊断标准,并征得知情同意。随机选30 例作为对照组,从其余90 例中筛出ADRB1 基因型为GC 和CC 的患者71 例为观察组,对照组男性15 例,女性15 例,平均年龄65.6 ±8.7 岁,其中冠心病14例,高血压7 例,心律失常的9 例,心功能参照NYHA 心功能分级标准,心功能Ⅱ级18 例,Ⅲ级12 例。对照组男性34 例,女性37 例,平均年龄67.5 ±6.7 岁,其中冠心病36 例,高血压19 例,心律失常16 例,心功能参照NYHA 心功能分级标准,心功能Ⅱ级47 例,Ⅲ级24 例。两组在年龄、性别、病程及心功能分级上具有可比性(P >0.05),无统计学差异。除外左心室射血分数(LVEF)≤45%,严重肝、肾功能不全,重症感染、栓塞、结缔组织病、内分泌疾病、心包填塞、心房颤动、心瓣膜疾病和肥厚性心肌病,并排除β 受体阻滞剂禁忌证的患者。
1.2 基因型检测方法 观察组90 例均采用原位杂交荧光染色法的基因检测方法检测ADRB1 和CY P2D6* 10 的基因型,用已知的荧光标记单链核酸为探针,按照碱基互补的原则,与待检材料中未知的单链核酸进行异性结合,形成可被检测的杂交双链核酸。通过利用探针荧光信号的变化实时检测杂交反应中每一个循环荧光信号的变化,通过Ct 值和标准曲线的分析对基因型定性分析。采集患者2ml 上肢静脉血,取150μl 新鲜全血加入含有1000μl 氯化铵溶液的Eppendorf 管中,颠倒混匀后室温放置5 分钟,3000r/min(700g)离心5 分钟,用移液器吸出上清液。在富集了白细胞的管中加入100μl耀金保,震荡混匀,室温放置20~30 分钟。吸取本液1.0~1.5μl 加入待测基因对应的耀金分试剂中,漩涡混匀,瞬时离心,上机检测;检测条件:95℃预变性600 秒;95℃变性30 秒,62℃复性75 秒,45 或50 个循环。在样品检测的同时,加测3种不同基因型的质控品作为对照。检测2 个位点,代谢分型如下:①药物代谢酶:CYP2D6* 10,分为CC 型:快代谢型;CT型:中代谢型;TT 型:慢代谢型。②药物作用受体ADRB1(β-受体1),分为GG 型;不敏感型;GC;中间敏感性;CC:敏感性。
根据基因型检测结果ADRB1 基因型可以分为GG(不敏感型)19 例、GC(中间敏感型)42 例和CC(敏感型)29 例,CY P2D6* 10 基因型可以分为CC(快代谢型)22 例、CT(中间代谢型)31 例和TT(慢代谢型)37 例。排除ADRB1 基因型GG(不敏感型)19 例,余71 例均根据代谢及敏感型分组后入组观察治疗。
1.3 临床干预方法 两组心衰患者除心功能Ⅱ级外,心功能Ⅱ级以上均在使用洋地黄或利尿药、舒张血管等药物治疗基础上应用美托洛尔缓释片治疗24 周。对照组实施美托洛尔常规治疗,均先小剂量应用,11.875mg (1/4 片)起始,每日1 次;每2 周可将剂量增加1 倍,目标靶剂量为95mg 或达到最大耐受剂量。观察组实施在基因分子分型基础上治疗,经荧光染色原位杂交进行基因分型检测后按不同基因型给予个体化治疗用量如表1 所示。若在应用药物治疗期间出现严重房室传导阻滞、低血压休克、心率<50 次/分或重度急性心衰等β 受体阻滞剂禁忌证情况时,则停用此药,列为退出试验的标准。

表1 在基因分型基础上,给予美托洛尔用药剂量的个体化治疗方案
1.4 观察指标 两组治疗患者分别于治疗前及治疗后测定两组患者超声心动图反应左室舒张功能的指标,其中包括:等容舒张末时间(IVRT)二尖瓣舒张早期充盈时间E 和舒张晚期充盈时间A 及二者的比值(E/A)。定期随访观察患者体力活动表现及心功能不全体征,测量血压和心率。
1.5 临床疗效及安全性评定 根据NYHA 心功能分级标准对心功能进行评定。患者治疗后心功能改善2 个级别或者心功能恢复到Ⅰ级,为显效;患者治疗后心功能改善1 个级别,为有效;心功能没有改善或者加重或者心功能改善不足1个级别为无效。根据患者使用β1 受体阻滞剂常见不良事件(如严重窦性心动过缓、头痛、乏力等)的发生率来评估药物的安全性。
1.6 统计学方法 统计分析软件采用SPSS 17.0,计量资料符合正态分布的采用均数±标准差()方式表示,两组间比较符合正态分布采用独立样本t 检验,组内治疗前后采用配对t 检验,多组间比较采用方差分析;计数资料以百分率表示,P <0.05 为有显著性差异,计数资料率或构成比的比较采用χ2检验或Fisher 确切概率法。
2.结果
2.1 两组一般情况的比较 两组在年龄、性别、病程及心功能分级上具有可比性(P >0.05),无统计学差异。

表2 两组患者一般情况比较
2.2 观察组的基因检测结果 见表3。

表3 观察组基因检测结果
2.3 临床疗效的比较 两组患者临床疗效观察,治疗后观察组总有效率明显高于对照组(P <0.05),且观察组各亚组与对照组比较差异亦有显著性(P <0.01),见表4。

表4 两组患者心功能改善的临床疗效比较(例,%)
2.4 左室舒张功能临床指标比较 对观察组及各亚组和对照组各自治疗前后超声心动图各项指标比较发现治疗后IVRT、E 峰、A 峰和E/A 比值均较治疗前改善(P <0.05),但观察组及亚组的改善程度明显高于对照组,差异有统计学意义(P <0.01)。见表5。
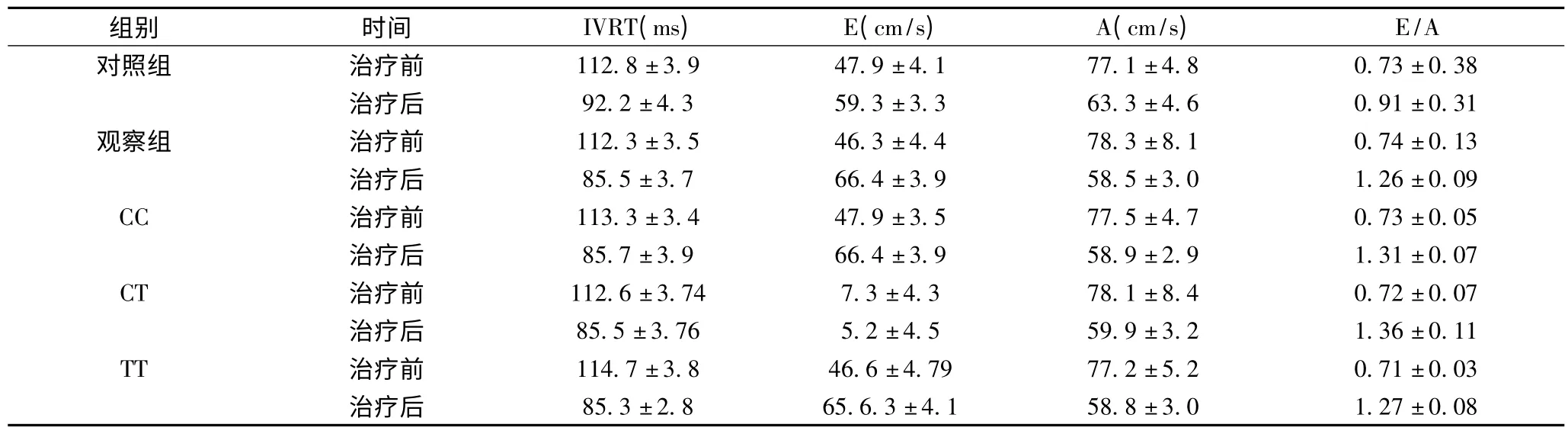
表5 两组患者治疗前后左室舒张功能临床指标比较
2.5 药物安全性的比较 进入临床试验共101 例,其中常规治疗对照组30 例,出现不良反应10 例(33.3%),在基因分子分型基础上,个体化用药治疗观察组71 例,出现不良反应6 例(8.45%),以上药物不良反应除窦缓停药退组外,其余均为轻度短暂,无需特殊处理,未影响继续治疗。观察组及各亚组和对照组之间的不良反应发生率比较,观察组高于对照组,差异有统计学意义(P <0.05)。见表6。
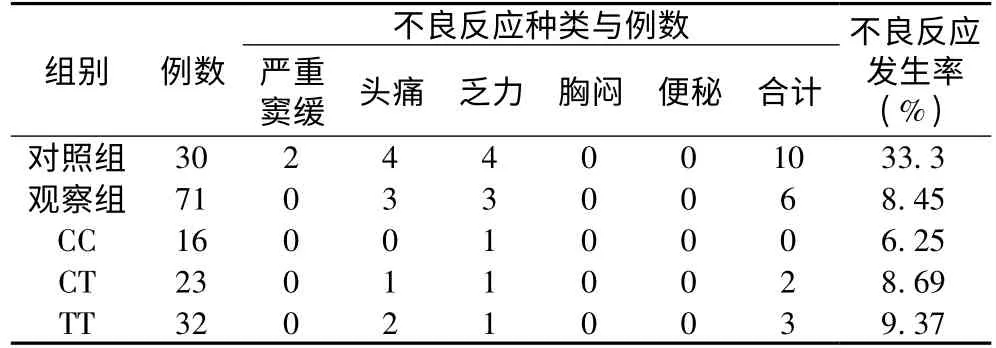
表6 两组患者治疗后不良反应情况比较
3.讨论
由于人口的老龄化,近年来老年DHF 的发病率逐年增高,因对其认识不够,其再住院率和病死率呈不断上升趋势,因此探讨有效的规范化治疗方案已成为当前的研究热点。美托洛尔缓释片是高度选择性β 受体阻滞剂,因能显著降低心肌梗死和慢性心力衰竭患者的猝死和总病死率[6],且不良反应少,极有可能改善患者的远期预后。近几年来,MERIT-HF、CI-BlS Ⅱ等[7~9]几个大型的临床试验研究证实β 受体阻滞长期用于DHF 的治疗,能明显地减轻或缓解DHF 的临床症状,改善心脏功能,提高生活质量,降低病死率,能改善或治疗舒张功能不全。其机制为:阻止儿茶酚胺介导的心脏毒性,使心肌免于直接损伤;阻止儿茶酚胺介导争受体密度下调,使β1受体密度上调后对儿茶酚胺的敏感性增强;减慢心室率,延长舒张期充盈时间,增加冠脉充盈及其负性肌力作用,从而减少心肌耗氧量;防止交感神经系统兴奋所致的心律失常。它降低高血压、减轻心肌肥厚的作用也对舒张功能改善有重要的作用,特别是在冠心病、高血压和心律失常时。因此,β 受体阻滞剂的代表药物美托洛尔广泛应用在DHF 的治疗中,但药物治疗中一个突出的问题就是药物的疗效及不良反应不稳定,存在明显的个体差异。
随着药物基因组学的发展,发现美托洛尔的个体差异代谢特点主要受ADRB1 和CY P2D6* 10 基因多态性的控制,ADRB1 是心脏的主要β 受体,在介导心脏交感神经-肾上腺系统信号传导中发挥着重要的作用。Bengtsson 和Liu J 的研究[10]发现ADRB1 阻滞剂的疗效与ADRB1 389 位的变异显著相关,即突变型纯和子Arg/Arg(对应基因型CC)和杂合子Arg/Gly(对应基因型GC)对β 受体阻滞剂是有反应的,而野生型纯和子Gly/Gly(对应基因型GG)却表现为亲和力显著下降,被视为反应低下。尽管国内携带ADRB1 389 位携带Arg 等位基因的比例高达80%以上,但ADRB1 阻滞剂的降压疗效却并不理想,这除了年龄、性别、身体状况等因素的影响外,还有一个重要的原因就是其在肝脏的代谢酶CYP2D6*10 的基因多态性影响β1受体阻滞剂的代谢,从而导致了疗效的个体差异。CYP2D6 是细胞色素药物代谢酶中较为重要的一种,也是第一个被确定由单基因控制的P450 酶,LIU Jie和LIU Zhaoqian 等[11]发现,CYP2D6* 10 基因型对美托洛尔浓度影响显著相关,并呈基因剂量效应。目前国内根据药物代谢相关基因的在基因分子分型基础上给药观察其疗效和不良反应的研究有限,且主要集中于原发性高血压领域,而且多是单基因分子分型基础上治疗,而未见美托洛尔双基因分子分型基础上治疗在老年DHF 中应用的报道。因此,研究DHF的药物在基因分子分型基础上治疗,采取个体化治疗方案,提高DHF 临床治疗效果并更好地改善患者预后,降低不良反应,进而使患者有更好的依从性。实现“在基因分子分型基础上”的个体化药物治疗是当今临床药物治疗学的发展方向。
本研究结果表明,治疗后观察组总有效率明显高于对照组,差异有显著性(91.5% vs.40.0%,P <0.05),各亚组的总有效率也显著高于对照组,差别亦有统计学差异(P <0.01);观察组及各代谢亚组分别与对照组治疗前后等容舒张时间(IVRT)、E 峰、A 峰和E/A 比值指标比较,前者改变的程度较后者明显,差异亦有显著性(P <0.05);而观察组及各亚组不良事件的发生率也明显低于对照组,且差异有显著性(P <0.05)。说明先根据ADRB1 基因型筛出药物反应患者,再进行CYP2D6* 10 基因型导向的个体化治疗,不仅可以明显改善老年DHF 的现有的疲乏、肺淤血等临床症状,改善患者心功能,而且还可改善左室舒张功能,延长舒张期充盈时间,增加冠脉充盈及其负性肌力作用,减少心肌耗氧量,可以改善疾病预后,而且应用在基因分子分型基础上的个体化治疗,可以明显减少药物的不良反应,使患者有更好的依从性。但由于本研究周期较短,对于美托洛尔在基因分子分型基础上治疗老年DHF 患者的远期疗效以及对终点事件的影响和远期安全性尚缺乏深入了解,且药物的代谢差异除遗传因素以外,环境因素也起着不可忽视的作用,有望以后进行遗传和环境因素的综合分析。总之,根据ADRB1 和CY P2D6* 10 的遗传多态性进行“在基因分子分型基础上的个体化治疗”的临床模式较传统的常规治疗模式有更好的疗效,且药物的不良反应发生率低,值得在临床应用中借鉴。
1 中华医学会心血管病学分会.慢性心力衰竭诊断治疗指南[J].中华心血管病杂志,2007,35(12):1076-1095.
2 Gary R,Davis L.Diastolic heart failure[J].Heart Lung,2008,37(6):405-416.
3 NakamuraY,ShimadaK,Fukuda D,et al.11llPlieations of Plasmaeoneentrations of Adi Poneetinin Patients with eoronaryartery disease[J].Heart (BritishCardiaeSoeiety),2004,90(5):528,533.
4 Haugen E,Furukawa Y,Isic A,et al.Increased adiponectin level in parallel with increased NT-pro BNP in patients with severe heart failure in the elderly:A hospital cohort study[J].Int J Cardiol,2008,125(2):216-219.
5 Liu J,Liu ZQ,Yu BN,et a1.Beta(1)-adrenergic receptor polymorphisms influence the response to metoprolol monotherapy in patients with essentiaI hypertension[J].clin Pharmacol Ther,2006,80(1):23-32.
6 兰永乔,曾朝荣.慢性心力衰竭的抗凝治疗及心律失常处理[J].中国心血管杂志,2006,2:153-154.
7 吴学思.β 受体阻滞剂在心力衰竭治疗中的地位及应用要点[J].心血管病学进展,2006,27(3):126.
8 李振魁.不同剂量美托洛尔对慢性心力衰竭患者左室重塑和心血管事件的影响[J].中华心血管病杂志,2004,32(10):892.
9 The beat-blocker evaluation of survive trialinvestigators.A trial of the beat-blocker bueindoiol in patients with advanced chronic heart failure[J].N Eng J Med,2001,344(22):1659.
10 Bengtsson K,Melander O,Orho-Melander M,el a1.Polymorphism in the beta(1)-adronergic receptor gene and hypertension[J].Circulation,2001,104(2):187-190.
11 LIU Jie,LIU Zhaoqian,LIU Yingzi,et a1.Effects of β-adrenergic receptor and CYP2D6 genetic polymorphism on metoprolol pharmacokinetics and pharmacodynamics in antihypertension therapy[J].Chin J Clin Pharmacol Ther,2007,12(10):1130-1137.
