不同时期鲳鱼冷藏期间优势腐败菌的多样性变化
2015-12-10蓝蔚青张琛杰
蓝蔚青,谢 晶*,周 会,张琛杰
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201 306)
不同时期鲳鱼冷藏期间优势腐败菌的多样性变化
蓝蔚青,谢 晶*,周 会,张琛杰
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201 306)
目的:比较分析不同时期冷藏鲳鱼(Pampus argenteus)贮藏期间的感官品质、pH值、微生物指标与主要微生物菌群的变化规律。方法:冷藏(4±1) ℃条件下,以感官评定、pH值与菌落总数为品质评价指标,采用聚合酶链式反应(polymerase chain reaction,PCR)扩增结合生理生化鉴定法分别对冬、春两个时期的鲳鱼进行优势腐败菌的变化规律研究。将经细菌培养与分离纯化得到单菌落按其形态特征进行分类,再通过生理生化鉴定与革兰氏染色,初步得到菌落种类,对单菌落进行DNA提取与PCR扩增并测序。结果:冬季样品获得12 种菌株,春季样品获得9 种菌株。贮藏末期时,冬季样品中优势腐败菌的种类与比例分别为嗜冷杆菌(Psychrobacter spp.)21.51%、草莓假单胞菌(Pseudomonas fragi)16.13%、荧光假单胞菌(Pseudomonas fluorescens)52.68%与热杀索丝菌(Brochothrix thermosphacta)9.68%;春季样品为草莓假单胞菌(Pseudomonas fragi)8.62%、荧光假单胞菌(Pseudomonas fluorescens)64.66%与腐败希瓦氏菌(Shewanella putrefaciens)26.72%。结论:冬、春时期中冷藏鲳鱼贮藏期间优势腐败菌的种类基本一致,以革兰氏阴性菌为主,但在细菌种类与比例上存在差异,冬季样品的微生物种类较春季丰富。贮藏期间,随着荧光假单胞菌所占比例的增加,使腐败希瓦氏菌的生长受到明显抑制。
鲳鱼;不同时期;冷藏;优势腐败菌;微生物多样性
鲳鱼(Pampus argenteus)属鲈形目鲳科,主要分布于我国东海与南海区域,是季节性洄游的近海中下层鱼类之一,为我国重要的鱼类资源。鲳鱼体内含有8 种人体所必需的氨基酸与不饱和脂肪酸,蛋白质含量达16.8%,且富含维生素(VA、VD、VB1、VPP)和矿物质,营养丰富[1]。
水产品由于受到温度、酶、微生物、机械损伤与化学污染等多种因素的影响,在冷藏流通过程中鲜度极易下降,从而产生不可逆的腐败变质现象。其中,微生物是导致多数水产品腐败变质的主要原因。现有研究发现,腐败过程中,只有极少种类的特定腐败菌参与这一过程并产生不可接受的异味[2],引起pH值变化、品质下降与产品腐败,有毒有害物质随之产生。这些适合生存、繁殖并产生腐败臭味代谢产物的菌群就是该产品的特定腐败菌[3]。特定腐败菌的生长速度快于其他微生物,且腐败活性强[4]。贮藏初期,其数量和种类并不占明显优势,但在贮藏期间,这些微生物易适应环境变化而大量繁殖,引起腐败,在数量与比重上占绝对优势,其他菌种所占比例明显减少或不再繁殖。因此,如何延缓水产品的品质劣变,延长其贮藏货架期,抑制由于微生物作用而引起的腐败变质,现已成为科研工作者普遍关注的热点。
近年来,国内外学者对引起水产食品腐败变质的微生物开展了相关研究工作。崔正翠等[5-6]对大菱鲆在不同温度贮藏过程中的细菌菌相进行定性和定量分析,并研究其细菌组成变化和优势腐败菌,结果得出大菱鲆在0~10 ℃冷藏过程中的优势腐败菌是腐败希瓦氏菌,其次是假单胞菌。曹荣等[7-8]以养殖南美白对虾、海捕鹰爪虾与太平洋牡蛎为研究对象,对其贮藏过程中细菌总数和菌相变化进行研究,其中发现虾类与牡蛎中的优势腐败菌也以假单胞菌为主。郭全友等[9-10]研究了冷藏罗非鱼和养殖大黄鱼的细菌组成、优势腐败菌及特征。张小伟等[11]对鲤鱼冷藏过程中的鲜度和菌相进行了分析。杨宪时等[12]对冷藏罗非鱼的细菌种群变化开展了研究。许钟等[13]建立了罗非鱼的特点腐败菌生长动力学模型,并对其货架期进行了预测。郭红[14]、王凌燕[15]等分别对南美白对虾在冰温条件下的菌相变化和腐败微生物开展了分析。王庆丽等[16]对养殖大黄鱼和海水鲈鱼冷藏过程中特定腐败菌进行研究。以上研究结果也为本课题在后期开展鲳鱼冷藏期间的优势腐败菌多样性分析提供了基础数据。本实验主要以冬、春两个时期的鲳鱼作为原料,在进行感官评定、pH值与菌落总数比较分析的同时,同时采用聚合酶链式反应(polymerase chain reaction,PCR)扩增结合生理生化鉴定法,研究不同时期鲳鱼冷藏期间优势腐败菌的变化规律,为生鲜水产品的贮藏保鲜提供参考依据。
1 材料与方法
1.1 材料、试剂与仪器
鲳鱼(Pampus argenteus)购自上海芦潮港海鲜批发市场,条质量0.25~0.50 kg。其中,冬季样品(winter samples,WS):采样时间为2013年12月,春季样品(spring samples,SS):采样时间为2014年3月。选择这2 个时期分别进行样品采集,并开展实验研究。
胰蛋白胨大豆琼脂培养基、胰蛋白胨大豆肉汤上海市疾病预防控制中心;革兰氏染液与微生物生理生化微量鉴定管 杭州天和生物制剂有限公司;dNTP Mixture、10×PCR Buffer、TaqDNA酶 日本TaKaRa Bio株式会社;引物27f、1 492r、TAE电泳缓冲液(50×TAE)、Biospin细菌基因组DNA提取盒、6×Loading Buffer、Marker:λDNA /HindⅢ、100 bp DNA Ladder 生工生物工程(上海)有限公司。
DK-8D型电热恒温水槽、隔水式恒温培养箱、DHG-9053A型电热鼓风干燥箱 上海一恒科技有限公司;MLS-3750高压灭菌锅 上海赛默科技生物发展有限公司;LDZX-75KBS 立式压力蒸汽灭菌器 上海申安医疗器械厂;VS-1300L-U型标准超净工作台苏州安泰空气技术有限公司;THZ-82A型气浴恒温振荡器 江苏金坛市环宇科学仪器厂;MiniSpan Plue微型高速离心机 杭州奥盛仪器有限公司;Disrupter genie DNA混匀器、TC-24/H(b)型基因扩增仪 杭州博日科技有限公司;DYY-6C型电泳仪 北京市六一仪器厂;凝胶成像系统、ZEISS Scope A1. AXIO电子显微镜上海永傲精密仪器有限公司。
1.2 方法
1.2.1 原料处理
选择体型较大,色泽光亮,肉质较硬,无异味的新鲜鲳鱼,鱼样捕捞上岸后即置于碎冰中,30 min内运至实验室进行实验。2 个采样期内分别随机选取新鲜鲳鱼10 条,将样品经“三去”(去头、去尾、去内脏)处理,用冰水清洗后切块,每份鱼样约质量40 g,分别置于保鲜袋中,在(4±1)℃冰箱中贮藏,隔天取样后进行指标测定与微生物多样性分析。
1.2.2 感官评定
根据鲜、冻鲳鱼标准[17]采用5 分制评分法,由5 名专业人士组成的感官评定小组,分别从样品的色泽、气味、组织形态和弹性结构4 个方面综合评分,结果取平均值。评分标准见表1,当样品的评定综合指标在3 分以下时,视为其初期腐败的开始。

表 1 鲳鱼感官评定表Table 1 Criteria for sensory evaluation of pomfret fi llets
1.2.3 pH值测定
取绞碎的鱼肉5.00 g置于烧杯中,加入新鲜煮沸后已冷却的蒸馏水,定容至50 mL,搅拌均匀,静置30 min后过滤,测定滤液的pH值,平行测定3 次。
1.2.4 菌落总数测定
参照食品微生物学检验:菌落总数测定[18]的方法进行。选3 个合适的稀释度,每个稀释度3 组平行。样品鲜度分类:一级鲜度:菌落总数≤104;二级鲜度:104≤菌落总数≤107。
1.2.5 菌株分离鉴定
通过纯培养方法得到多个不同形态的单菌菌落,根据菌落外观与菌体镜检形态对细菌初步分类,计算同一类型的菌落数量。
1.2.5.1 菌落与细胞形态观察
对分离纯化得到的单菌菌落进行菌落形态观察与菌落计数,并结合革兰氏染色与芽孢染色,观察细胞形状,对细菌进行初步分类,计算不同时期与贮藏时间的同一种类菌落数。选取菌落数在30~300 个的计数平板,随机挑取不同种类的50 个典型单菌落,以平板划线法分离纯化3 次,得到的纯菌株保存于试管斜面培养基上,以备鉴定。
1.2.5.2 分类保存
根据菌落特点与形态学特征,将在不同时期与贮藏时间挑选出的菌株依次作好标记,分组归类,再进行纯培养,重复以上比较。随后将特征差异明显的菌株重新分类标记,再予以纯培养,重复操作3 次,分离得到纯菌株,每一种纯菌株作2 组平行,记录其形态特征。
1.2.6 单细菌DNA提取与纯化
将分离筛选后的纯菌株分别接种到TSB中,在37 ℃、170 r/min的摇床中将其培养至对数生长期,然后吸取10 mL细菌培养液,4 ℃、10 000 r/min离心15 min,弃上清液,将细菌—20 ℃保存,用于下一步提取DNA[19]。采用细菌基因组DNA提取试剂盒提取纯化菌株的DNA,同时增加溶菌酶破壁。提取出的DNA分别编号后在—20 ℃的冰箱中保存备用。
1.2.7 16S rDNA片段的PCR扩增
以提取的细菌基因组DNA为模板,选用细菌通用引物。正向引物:27f:5’-GAGAGTTTGATCCTGGCTCAG-3’;反向引物:1492r:5’-CTACGGCTACCTTGTTACGA-3’。PCR扩增反应体系如表2所示。

表 2 PCR扩增反应体系Table 2 PCR Reaction system
反应步骤为:1)94 ℃热启动5 min;2)94 ℃预变性5 min;3)94 ℃变性1 min;4)57 ℃退火1 min;5)72 ℃复性2 min;6)72 ℃延伸10 min;重复步骤3)、4)、5)25 次[20]。通过1.0%的琼脂糖凝胶电泳检验PCR扩增产物,产物片段约为1 500 bp。使用DNA纯化试剂盒对PCR产物进行纯化,获得的纯化产物送生工生物工程(上海)有限公司测序。
1.2.8 系统发育树分析
将测序得到菌株部分长度约1 460 bp的16S rDNA序列登录至NCBI网站(http://www. ncbi. nlm.nih.gov/ blast/),获得各自在GenBank数据库中的临时登录号。通过BLAST程序与GenBank中的核酸序列进行同源性分析比对,选出相似性较高的序列,应用Chromas Version 1.62和DNAMAN Version 6.0软件进行多重比较后构建系统发育树。
1.2.9 生理生化鉴定分析
参照文献[21-22]对分类筛选后的纯菌株进行生理生化鉴定,并结合蔗糖、山梨醇、乳糖、麦芽糖、甘露糖、甘露醇、木糖、尿素等进行糖醇类发酵利用实验,由培养后的颜色反应进一步判断细菌种类。
2 结果与分析

图 1 不同时期鲳鱼冷藏期间的感官分值变化Fig.1 Changes in sensory evaluation scores of pomfret fi llets during chilled storage
2.1 感官评定由图1可知,不同时期鲳鱼样品冷藏期间的感官分值呈总体下降趋势,且变化规律基本相同,表明在同等流通环境下,样品的感官品质变化与捕捞时期无关。新鲜鲳鱼切面色泽正常,富有光泽,味道清新,肌肉组织肌理清晰,弹性良好。随着贮藏时间的延长,鱼体表面色泽逐渐暗淡,失去原有光泽,色泽变黄、发黏、软且无弹性,有部分汁液流出,散发腥臭,纹理模糊,品质明显下降,逐渐趋于腐败。
2.2 pH值

图 2 不同时期鲳鱼冷藏期间的pH值变化Fig.2 Changes in pH of pomfret fi llets during chilled storage
由图2可见,两个时期鲳鱼样品贮藏期间的pH值呈先降后升的“V”形变化趋势,主要由于是样品捕捞上岸后,先后经历了初期的生理生化变化、死后僵硬、解僵、自溶与腐败的过程,pH值下降是由于水产品僵直过程中糖原的酵解和ATP分解产生乳酸、丙酮酸、磷酸等酸性物质。随着鱼体内蛋白酶分解释放出氨及胺类物质,pH值开始上升。僵硬期间,样品的pH值略有下降,自溶腐败期间pH值持续升高[23]。pH值越高,说明样品的腐败程度相对越严重,鲜度和品质也随之降低。通过对两个时期样品pH值变化情况的比较分析,可发现冬季样品pH值的增长速度较缓。可能由于冬季时期的环境温度较春季略低,使样品死后各个时期的生理生化变化适当延后,从而延缓了鲳鱼的腐败进程。
2.3 菌落总数

图 3 不同时期鲳鱼冷藏期间的菌落总数变化Fig.3 Changes in TVC in pomfret fi llets during chilled storage
由图3可知,两个时期鲳鱼样品的菌落总数与感官分值的变化趋势基本一致。鱼样均在冷藏的第4天超过国标规定的二级鲜度。贮藏的第6天,其菌落总数的对数值分别达到8.17±0.15和8.40±0.20。此时的鱼肉色泽灰暗,光泽不再,流出汁液,有腥臭味散出,纹理不再清晰,鱼体变软,失去弹性,表明样品已进入腐败阶段。到第8天时,样品已完全腐败。
2.4 细菌菌落形态分析
采用稀释平板分离法和划线分离法,经过3 次以上的比较分组与归类计数,一共从2 个时期的鲳鱼样品冷藏期间分离出12 种典型菌,分别命名为X1、X2……X12,其菌落与细菌的基本特征见表3。

表 3 不同时期鲳鱼冷藏期间的细菌菌落特征分析Table 3 Characteristics of bacterial colonies in pomfret fi llets during chilled storage
注:X1、X2……X12分别为12 株菌。2.5 菌株的16S rDNA基因序列分析
用正向引物27f和反向引物1 492r对两组样品中的优势菌进行16S全长序列的PCR扩增,对产物进行电泳检测,得到条带稳定且重复性好,杂带不明显,片段长度约为1 500 bp,电泳图谱如图4所示。

图 4 菌株的16S rDNA电泳图谱Fig.4 Electrophoretic analysis of PCR amplifi cation products of 16S rDNA gene fragments
2.6 系统发育树分析
将12 株分离细菌所获得的16S rDNA序列提交NCBI,获得其在GenBank数据库中的临时登录号。通过BLAST软件与GenBank中已发表的16S rDNA序列进行同源性比较分析,选取同源性多数在99%以上的8 个菌株进行比较,并构建系统发育树,根据亲缘关系远近判断细菌种类。其中,分别对主要优势菌X3与X4绘制系统发育树(图5)。

图 5 基于16S rDNA序列同源性的XX3与XX4菌株的系统发育树Fig.5 Phylogenetic tree of strains X3and X4based on 16S rDNA sequences
2.7 菌株的生理生化鉴定分析
不同时期的鲳鱼样品在冷藏货架期结束时,菌相逐渐趋于简单。其中冬季样品贮藏末期的主要优势菌为X1、X2、X3与X10,春季样品贮藏末期的主要优势菌为X2、X3与X4。通过对12 种主要优势菌株的生理生化特征鉴定分析,其各项生理生化指标结果如表4所示。

表 4 不同时期鲳鱼冷藏期间主要优势菌的生理生化特征Table 4 Physiological and biochemical characteristics of dominant bacteria in pomfret fillets during chilled storage
通过在GenBank进行基因序列的相似性比对,结合菌株的生理生化特征分析,可判断出X1为嗜冷杆菌属(Psychrobacter spp.)中的一种,X2与X3分别为假单胞菌属(Pseudomonas spp.)细菌,X4为希瓦氏菌属(Shewanella spp.)中的一种,其余8 种菌均在PCR扩增测序结果比对的基础上,结合生理生化鉴定与系统进化树分析加以鉴别得出其各自属种,可得X1为嗜冷杆菌(Psychrobacter spp.),X2为草莓假单胞菌(Pseudomonas fragi),X3为荧光假单胞菌(Pseudomonas fluorescens),X4为腐败希瓦氏菌(Shewanella putrefaciens),X5为成团肠杆菌(Enterobacter agglomerans),X6为腐生葡萄球菌(Staphylococcus saprophyticus),X7为松鼠葡萄球菌(Staphylococcus sciuri),X8为微杆菌(Microbacterium esteraromaticum),X9为嗜根库克菌(Kocuria rhizophila),X10为热杀索丝菌(Brochot hrix thermosphacta),X11为蜡样芽孢杆菌(Bacillus cereus),X12为金黄色葡萄杆菌(Chryseobacterium spp.)。
2.8 不同时期鲳鱼冷藏过程中的菌相组成变化
根据对不同时期鲳鱼冷藏期间的菌株进行反复分离纯化并鉴定分析,将不同时间的鲳鱼样品经反复分离纯化与比较分类,并对典型菌株进行计数,计算其各自所占比例,结果如表5所示。
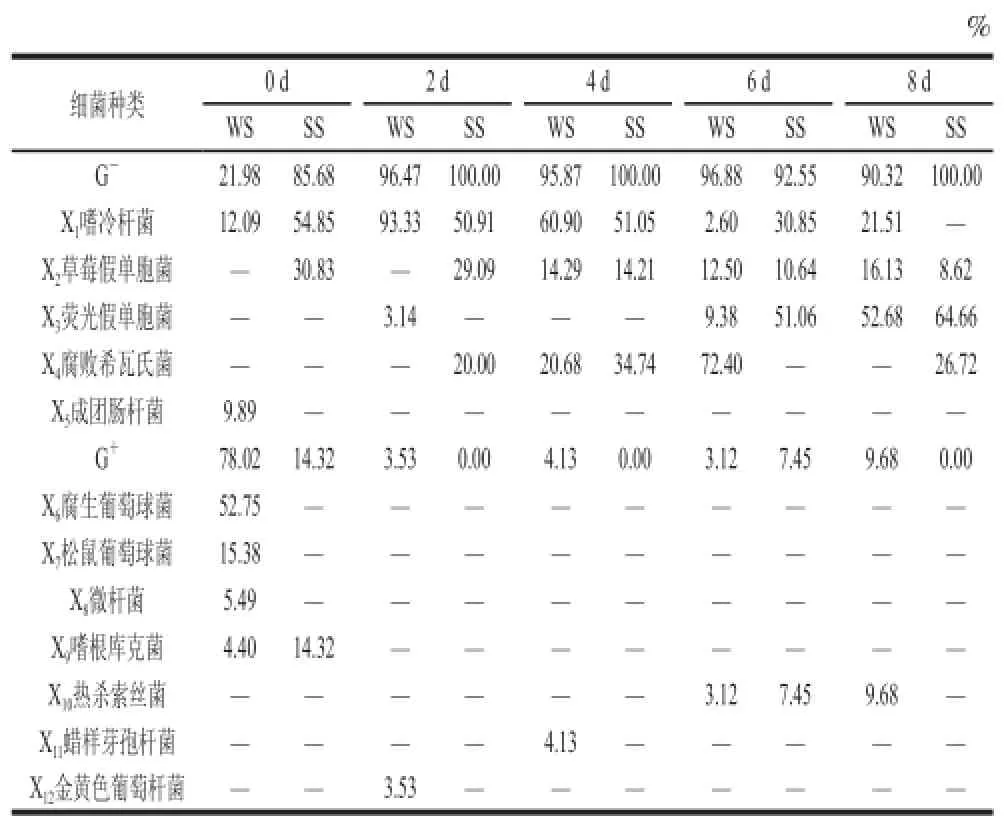
表 5 鲳鱼在不同时期冷藏过程中的细菌组成与变化分析Table 5 Changes in bacterial proportion and composition of pomfret fillets during chilled storage
由表5可得,贮藏末期冬季样品中优势腐败菌的比例为嗜冷杆菌(Psychrobacter spp.)21.51%、草莓假单胞菌(Pseudomonas fragi)16.13%、荧光假单胞菌(Pseudomonas fluorescens)52.68%与热杀索丝菌(Brochothrix thermosphacta)9.68%;春季样品为草莓假单胞菌(Pseudomonas fragi)8.62%、荧光假单胞菌(Pseudomonas fluorescens)64.66%与腐败希瓦氏菌(Shewanella putrefaciens)26.72%,这与国内外部分学者的研究结果相一致。郭全友等[24]对养殖大黄鱼的菌相分析结果表明腐败希瓦氏菌和假单胞菌是低温贮藏大黄鱼的优势腐败菌。Gill等[25]认为假单胞菌属和希瓦氏菌属是冷链流通中高水分蛋白食品的特定腐败菌。荧光假单胞菌(Pseudomonas fluorescens)是水产品的主要条件致病菌与腐败菌,当鱼体因捕捞、贮运等过程中的人为操作不当或机械损伤等原因,鱼体易被该菌侵入引起发病致腐[26]。胥亚夫等[27]研究证明水产品中常见的腐败菌假单胞菌属细菌主要为荧光假单胞菌、腐臭假单胞菌和边缘假单胞菌。此外,课题组于贮藏末期在冬季样品中未检出腐败希瓦氏菌,而在春季样品中检出少量。可能是由于较高浓度的荧光假单胞菌对腐败希瓦氏菌的正常生长产生抑制[28]。
3 结 论
1) 2 个时期鲳鱼的冷藏货架期均为4 d,其中冬季样品的初始新鲜度略优于春季样品,这可能同样品自身品质、季节洄游性特点与环境温度条件直接相关;2)鲳鱼的优势腐败菌主要为革兰氏阴性菌,其中嗜冷杆菌(Psychrobacter spp.)、 假单胞菌(Pseudomonas spp.)与腐败希瓦氏菌(Shewanella putrefacie ns)为主要优势菌;革兰氏阳性菌则以葡萄球菌(Staphylococcus spp.)与热杀索丝菌(Brochothrix thermosphacta)为主;较高浓度的荧光假单胞菌对腐败希瓦氏菌的正常生长产生抑制;3)冬季样品组:初始阶段中革兰氏阴性菌所占比例明显高于革兰氏阳性菌,随着贮藏时间的延长,革兰氏阴性菌所占比例逐渐升高,并占绝对优势,其主要由嗜冷杆菌(Psychrobacter spp.)、假单胞菌(Pseudomonas spp.)与热杀索丝菌(Brochothrix thermosphacta)组成,其他菌群数量则随之减少。说明不同微生物之间的相互作用可影响其生长和新陈代谢[2]。微生物间的相互作用使优势菌的种类比例在腐败期间不断改变;4)春季样品组:从初始至完全腐败的过程中,革兰氏阴性菌始终占有绝对比重。其中0 d的细菌组成比例与冬季样品组有明显区别,说明了在不同时期里,由于样品自身品质、觅食条件与生活环境差异等原因,对鲳鱼样品的主要微生物种群分布产生影响。主要优势菌为假单胞菌(Pseudomonas spp.)与腐败希瓦氏菌(Shewanella putrefaciens)。两个季节中主要腐败菌的类型基本一致,但微生物种类与比例明显不同,存在着不同微生物间相互影响的现象。
[1] 庄桂东, 韩荣伟, 安桂香, 等. 低值鲳鱼制取风味鱼脯的研究[J]. 食品研究与开发, 2004, 25(2): 91-93.
[2] 姜兴为, 杨宪时. 水产品腐败菌与保鲜技术研究进展[J]. 湖南农业科学, 2010(15): 100-103.
[3] GRAM L, HUSS H H. Fresh and processed fish and shellfish [M]//LUND B M, BAIRD-PARKER T C, GOULD G W. The Microbiological safety and quality of food. Gaithersburg Maryland, USA: Aspen Publishers Inc, 2000: 472-506.
[4] JOS H J, HUIS I V. Microbial and biochemical spoilage of foods: an overview[J]. International Journal of Food Microbiology, 1996, 33(2): 1-18.
[5] 崔正翠, 许钟, 杨宪时, 等. 冷藏大菱鲆细菌组成变化和优势腐败菌[J].食品科学, 2011, 32(13): 184-187.
[6] 崔正翠, 许钟, 杨宪时, 等. 大菱鲆腐败菌生长动力学研究和货架期预测[J]. 海洋渔业, 2010, 32(4): 454-460.
[7] 曹荣, 刘淇, 殷邦忠. 对虾冷藏过程中细菌菌相变化的研究[J]. 保鲜与加工, 2011(1): 17-20.
[8] 曹荣, 薛长湖. 太平洋牡蛎在-3℃微冻贮藏过程中的品质和细菌菌相变化[J]. 南方水产, 2010(1): 49-53.
[9] 郭全友, 杨宪时, 许钟. 冷藏罗非鱼优势腐败菌的鉴定及其特征[J].食品与机械, 2009(3): 87-90.
[10] 郭全友, 许钟, 杨宪时. 养殖大黄鱼加工和冰藏过程中鲜度和细菌类型的变化[J]. 海洋渔业, 2008, 30(3): 261-267.
[11] 张小伟, 许钟, 杨宪时, 等. 鲤鱼冷藏中的鲜度变化与货架期[J]. 海洋渔业, 2010, 32(2): 211-217.
[12] 杨宪时, 郭全友, 许钟. 罗非鱼冷藏过程细菌种群的变化[J]. 中国水产科学, 2008, 5(6): 50-55.
[13] 许钟, 肖琳琳, 杨宪时. 罗非鱼特定腐败菌生长动力学模型和货架期预测[J]. 水产学报, 2005, 29(4): 540-546.
[14] 郭红, 董士远, 刘尊英, 等. 南美白对虾冰温下菌相变化[J]. 中国海洋大学学报: 自然科学版, 2010(6): 77-80.
[15] 王凌燕. 南美白对虾腐败微生物分析与防黑变保鲜技术研究[D].青岛: 青岛大学, 2012: 16-25.
[16] 王庆丽. 养殖大黄鱼和海水鲈鱼冷藏过程中特定腐败菌的鉴别[D].杭州: 浙江工商大学, 2012: 39-52.
[17] 中国水产科学研究院东海水产研究所. SC/T 3103—2010 鲜、冻鲳鱼[S]. 北京: 中国农业出版社, 2011.
[18] 卫生部. GB 4789.2—2010 食品微生物学检验: 菌落总数测定[S]. 北京: 中国标准出版社, 2010.
[19] 王亮, 曾名湧, 董士远, 等. 不同包装方式的凡纳滨对虾冰温贮藏过程中腐败微生物的变化规律[J]. 食品与发酵工业, 2010, 36(3): 196-201.
[20] 蓝蔚青, 谢晶. 传统生理生化鉴定技术结合PCR法分析复合保鲜剂对冷藏带鱼菌相变化的影响[J]. 食品工业科技, 2012, 33(10): 330-335.
[21] 希坎南 R E. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社, 1989.
[22] 东秀珠, 蔡妙英, 王宝玲, 等. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[23] 沈月新. 水产食品学[M]. 北京: 中国农业出版社, 2001.
[24] 郭全友, 许钟, 杨宪时. 冷藏养殖大黄鱼品质变化特征及细菌相分析[J]. 上海水产大学学报, 2006, 15(6): 216-221.
[25] GILL C O, BADONI M, JONES T. Hygienic effects of trimming and washing operations in a beef carcass dressing process[J]. Journal of Food Protection, 1996, 59: 666-669.
[26] 邓显文, 谢芝勋, 刘加波, 等. 罗非鱼荧光假单胞菌的分离鉴定[J].广西农业科学, 2010, 41(6): 612-615.
[27] 胥亚夫, 林洪, 张茜, 等. 冷藏牙鲆中主要腐败菌卵黄抗体的抑菌性能[J]. 食品科学, 2010, 31(23): 109-113.
[28] GRAM L, MECHIORSEN J. Interaction between fi sh spoilage bacteria Pseudomonas spp. and Shewanella putrefaciens in fi sh extracts and on fi sh tissue[J]. Journal of Applied Bacteriology, 1996, 80(15): 589-595.
Diversity of Dominant Spoilage Bacteria in Pomfret (Pampus argenteus) from Different Growing Seasons during Chilled Storage
LAN Weiqing, XIE Jing*, ZHOU Hui, ZHANG Chenjie
(Shanghai Engineering Research Center of Aquatic Product Processing and Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
Objective: Changes in the sensory and microbial quality, pH and dominant microflora of pomfret (Pampus argenteus) from different growing seasons (winter and spring)were investigated during chilled storage. Methods: Based on the results of sensory evaluation, pH and total viable count (TVC), the diversity of dominant spoilage bacteria in pomfret were monitored by the combination of PCR amplifi cation with physiological and biochemical identifi cation. After separation and purification of dominant spoilage bacteria in pomfret, the single colony types of bacteria were classified according to their morphological features, physio-biochemical identification, Gram staining, DNA extraction, PCR amplifi cation and sequencing. Results: Totally 12 strains of bacteria were obtained in winter samples (WS) and 9 strains of bacteria in spring samples (SS). The dominant spoilage bacteria in WS included 21.51% Psychrobacter spp., 16.13% Pseudomonas fragi, 52.68% Pseudomonas fluorescens and 9.68% Brochothrix thermosphacta, while those in dominant spoilage bacteria in spring samples (SS) included 8.62% Pseudomonas fragi, 64.66% Pseudomonas fl uorescens and 26.72% Shewanella putrefaciens. Conclusion: The species of dominant spoilage bacteria in pomfrets from both seasons during chilled storage were mainly composed of Gram-negative bacteria, the species and proportion of bacteria were different between the two seasons. Microbial species were more abundant in winter than those in spring. With the high proportion of Pseudomonas fl uorescens, the growth of Shewanella putrefaciens was inhibited obviously during chilled storage.
Pampus argenteus; different growing seasons; chilled storage; dominant spoilage bacteria; microbial diversity
TS254.4
A
1002-6630(2015)02-0226-06
10.7506/spkx1002-6630-201502044
2014-07-05
“十二五”国家科技支撑计划项目(2012BAD38B09);上海市科技兴农项目(沪农科攻字2013第3-4号);
上海海洋大学科技发展专项
蓝蔚青(1977—),男,高级工程师,博士,研究方向为水产品低温保鲜技术。E-mail:wqlan@shou.edu.cn
*通信作者:谢晶(1968—),女,教授,博士,研究方向为水产品低温保鲜技术。E-mail:jxie@shou.edu.cn
