双色荧光定量检测大米中的汞
2015-12-10王联芝向东山
翟 琨,王联芝,向东山,*
(1.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;2.湖北民族学院化学与环境工程学院,湖北 恩施 445000)
双色荧光定量检测大米中的汞
翟 琨1,2,王联芝2,向东山1,2,*
(1.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;2.湖北民族学院化学与环境工程学院,湖北 恩施 445000)
利用两条部分互补的富含胸腺嘧啶(T碱基)的单链核酸,结合氧化石墨烯及核酸染料SYBR GreenⅠ,采用同步荧光分析法,建立一种高灵敏度、高选择性的汞离子(Hg2+)双色荧光定量检测方法。在优化条件下,Hg2+浓度在5×10—10~500×10—10mol/L之间时,SYBR GreenⅠ及Carboxy-X-rhodamine(ROX)总的荧光强度(ΔIT)与Hg2+浓度(C)之间具有良好的线性关系,其拟合的回归方程为∆IT= 2.121 3C+10.536 0,方法检出限(3σ)为2×10—10mol/L。该方法操作简单、检测速度快、选择性好、灵敏度高、重复性好、检出限低。将该方法应用于大米中汞的检测,获得了满意的结果。
汞;定量检测;双色荧光;大米
汞是一种对人体健康有严重危害的金属元素,在人体中具有累积效应[1-2]。汞摄入量过多会影响人体的生殖和发育,有致畸、致癌、致突变作用,严重的还会产生精神异常,极大地危害人体健康[3-7]。因此,汞的定量检测在食品领域中具有十分重要的意义。
目前,汞常用的定量检测方法有紫外-可见光分光光度法[8]、原子发射光谱法[9]、原子吸收分光光度法[10]、原子荧光法[11]、高效液相色谱法[12]及电感耦合等离子体质谱法[13]等。在这些分析方法中,紫外-可见光分光光度法实验设备简单、检测方便且具有较高的检测灵敏度,但该方法显色反应时间长,汞离子显色剂的特异性不高,样品中存在与汞离子化学性质相近的重金属离子时误差较大;原子发射光谱法具有较好的选择性,较低的检出限、极小的基体效应、较高的精密度及广泛的测量范围等特点,但对仪器和精度要求较高,设备造价昂贵,而且不能进行即时测量;原子吸收分光光度法是目前最常用的汞的检测方法,特别是冷原子吸收法现已成为国家标准方法,但该方法对样品制备要求较高,所用时间长,对设备要求较高;原子荧光法具有谱线简单、灵敏度高、干扰少、检出限低等优点,但检测时产生汞蒸气,对操作人员的健康具有一定的威胁;高效液相色谱法及电感耦合等离子体质谱法具有灵敏度高、选择性好的特点,但所需仪器价格昂贵,在多数实验室中的推广应用受到限制。
氧化石墨烯是一种性能优异的新型碳材料,比表面积较大,且表面具有丰富的官能团[14-16]。研究表明,氧化石墨烯对单链核酸具有很强的吸附能力,但对双链核酸的吸附能力很弱[17-18]。另外,氧化石墨烯对荧光染料具有极高的猝灭作用,且猝灭范围很广[19-20]。
核酸染料SYBR GreenⅠ是一种不对称的菁类核酸染料,它本身的荧光信号很弱,与单链DNA也几乎不发生作用,但它与双链DNA有很强的亲和性,且与双链DNA结合后,其荧光强度会增加800~1 000 倍,是目前所发现的最灵敏的核酸染料之一[21]。
基于此,本实验利用T碱基与Hg2+能特异性结合形成稳定“T-Hg2+-T”结构的特点[22],设计了两条部分互补的富含T碱基的单链DNA(其中一条用荧光染料Carboxy-X-rhodamine(ROX)标记),并结合氧化石墨烯及核酸染料SYBR GreenⅠ,建立了一种高灵敏的Hg2+双色荧光定量检测方法,并将其应用于大米分析中。
与以前报道的分析方法相比,这种方法不仅具有很高的选择性,而且可以显著地提高检测的灵敏度,降低Hg2+的检出限。该方法操作简单、检测速度快、选择性好、灵敏度高、重复性好、检出限低。将该方法应用于大米中汞的检测,获得了满意的结果。
1 材料与方法
1.1 材料与试剂
大米 益海粮油工业有限公司。
氧化石墨烯 中科碳纳米科技有限公司;SYBR Green Ⅰ购于上海瑞安生物技术有限公司,原始溶液为无水二甲基亚砜制备的10 000倍浓缩液,工作液是浓缩液用超纯水1∶10 000稀释得到;Hg(NO3)2及其他所有化学试剂均为分析纯均购自美国Sigma公司和国药集团化学试剂有限公司;Tris-HCl缓冲溶液由0.1 mol/L Tris通过0.1 mol/L HCl调节得到。两种单链核酸均由上海生工生物工程技术服务有限公司(中国)合成并用高效液相色谱法进行纯化,其核苷酸序列如下:核酸序列Ⅰ(P1):5’- CTG CTT GCT C -3’;核酸序列Ⅱ(C1):5’-GAG CTT GCT G-(CH2)6-ROX-3’。
1.2 仪器与设备
RF-5301PC型荧光光谱仪、PB-21型pH计 日本Shimadzu公司;AFS-922型原子荧光光度计 北京吉天仪器有限公司;Ethos Plus型微波消解系统 意大利Milestone公司。
1.3 方法
1.3.1 样品制备
将两种富含T碱基的单链核酸分别溶解在Tris-HCl缓冲溶液中,并配制成5×10—7mol/L的溶液。取50 μL 5×10—7mol/L的P1溶液加入到50 μL 5× 10—7mol/L的C1溶液中并混合均匀,再加入50 μL不同浓度的Hg(NO3)2溶液,并加入缓冲溶液至总体积达到390 μL,在35 ℃孵育10 min后,冷却至室温,加入100 μL SYBR GreenⅠ工作液并在室温条件下反应10 min后,再加入10 μL 0.5 mg/mL的氧化石墨烯,孵育3 min,最后对ROX及SYBR GreenⅠ的荧光信号进行检测。在条件优化时,两种单链核酸的浓度均为5× 10—8mol/L,Hg2+的浓度为5×10—8mol/L,两种单链DNA与Hg2+孵育温度为35 ℃,孵育时间为10 min。
大米样品的消化条件:准确称取0.50 g样品,置于聚四氟乙烯的消解罐中,加人6 mL硝酸和4 mL双氧水(H2O2),密封后将消解罐放入微波中加热,升温程序为100 ℃保持30 min,140 ℃保持25 min,180 ℃保持25 min,样品消解完全后自然冷至室温。将样品消解液转移至100 mL容量瓶中,用1%的硝酸溶液定容,摇匀待测。
1.3.2 Hg2+的检测
Hg2+的测定通过对ROX及SYBR GreenⅠ荧光信号的检测实现。SYBR GreenⅠ最大激发波长为499 nm,最大发射波长为523 nm,波长间隔(Δλ)为24 nm;ROX的最大激发波长为588 nm,最大发射波长为610 nm,Δλ为22 nm。这两种染料的波长间隔较小,但很接近,为了消除反射及瑞利散射对荧光信号的干扰,采用同步扫描荧光光谱法进行分析。该实验中同步扫描的波长间隔设置为23 nm,荧光分光光度计的激发及发射狭缝宽度均设置为10 nm。
2 结果与分析
2.1 检测原理
利用两条部分互补的富含T碱基的单链DNA(其中一条用荧光染料ROX标记)、氧化石墨烯(graphene oxide,GO)及核酸染料SYBR GreenⅠ对Hg2+检测的原理如图1所示。在没有Hg2+时,两条单链核酸中有多个T-T错配碱基,不能形成双螺旋结构,核酸染料SYBR GreenⅠ与核酸的作用很微弱,其荧光信号很弱。当加入氧化石墨烯时,两种单链DNA均被氧化石墨烯吸附,荧光染料ROX的荧光被猝灭,荧光信号也很弱。在有Hg2+时,两条单链核酸通过“T-Hg2+-T”特异性结合形成双螺旋结构,与SYBR GreenⅠ的作用增强,SYBR GreenⅠ的荧光信号显著增强;当加入氧化石墨烯时,双链核酸不能被氧化石墨烯吸附,ROX的荧光不能被猝灭,因此其荧光信号也会显著增强。利用Hg2+存在时,SYBR GreenⅠ及ROX的荧光信号都显著增强的原理,即可实现Hg2+的双色荧光定量检测。
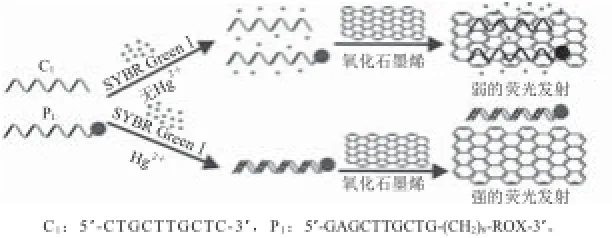
图 1 检测原理图Fig.1 Mechanism for mercury detection
2.2 方法可行性分析
Hg2+浓度不同时SYBR GreenⅠ及ROX所对应的同步扫描荧光光谱见图2。在没有Hg2+存在时,SYBR GreenⅠ及ROX的荧光信号都很弱(图2a);当溶液中加入Hg2+后,SYBR GreenⅠ及ROX的荧光信号都显著增强,且Hg2+浓度不同时,它们所对应的荧光信号都有显著的区别(图2b、c)。由此说明,利用上述原理对Hg2+的双色定量检测是可行的。
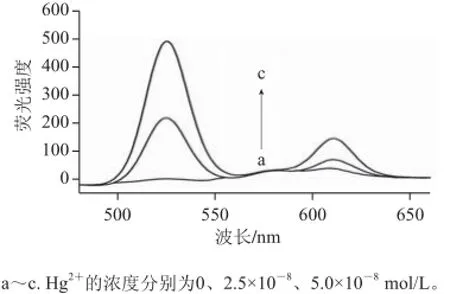
图 2 Hg 2 Hg2+浓度不同时SYBR GreenⅠ(左)及ROX(右)X对应的同步扫描光谱图Fig.2 Synchronous scanning fluorescence spectra of SYBR GreenⅠ(left) and ROX (right) for different concentrations of Hg2+
2.3 pH值对测定结果的影响
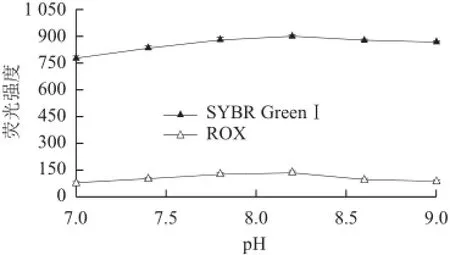
图 3 pH值对荧光强度的影响Fig.3 Effect of pH on the fl uorescence intensity
缓冲溶液的pH值可以影响两种单链DNA与Hg2+形成双螺旋结构,也可以直接影响核酸染料SYBR GreenⅠ及荧光染料ROX的荧光强度。本实验以Tris-HCl作为缓冲溶液,考察不同pH值的Tris-HCl缓冲溶液对测定结果的影响。结果(图3)表明,在pH值为7.0~9.0的范围内,两种荧光染料的荧光强度都是先增加,然后又降低。在pH值等于8.2时效果最好,因此本实验选择缓冲溶液的pH值为8.2。
2.4 反应温度对测定结果的影响
反应温度是影响两种单链DNA与Hg2+形成双螺旋结构的重要因素之一,温度太低,反应速度慢,而反应温度超过双链的解旋温度,双螺旋结构则不能形成。本实验对不同的反应温度进行考察。结果(图4)表明,反应温度在25~35 ℃之间时,SYBR GreenⅠ及ROX的荧光强度都随着温度的升高而增加;当温度超过35 ℃后,两种染料的荧光强度均快速下降。这主要是因为本实验所设计的两种单链与Hg2+形成的双链解旋温度在38 ℃左右,当温度超过35 ℃后,有部分双链发生解旋形成单链所造成的。因此,本实验选择的最佳反应温度为35 ℃。
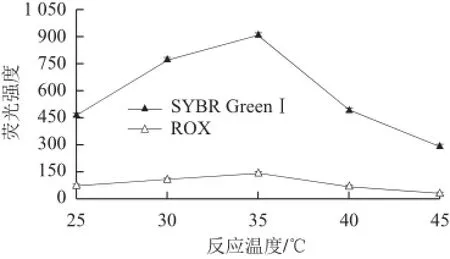
图 4 反应温度对荧光强度的影响Fig.4 Effect of reaction temperature on the fl uorescence intensity
2.5 反应时间对测定结果的影响
反应时间也是影响两种单链DNA与Hg2+形成双螺旋结构的重要因素之一,本实验对不同的反应时间进行考察。结果(图5)表明,反应时间在2~10 min内,SYBR GreenⅠ及ROX的荧光强度均随着反应时间的延长而增加,当反应时间超过10 min时,荧光强度趋于稳定,说明反应在10 min内即可完成。因此,本实验选择的反应时间为10 min。
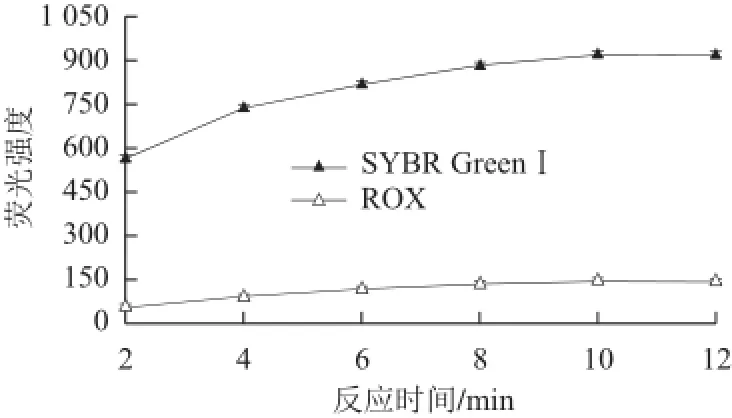
图 5 反应时间对荧光强度的影响Fig.5 Effect of reaction time on the fl uorescence intensity
2.6 离子强度对测定结果的影响
离子具有稳定双链DNA的作用。本实验通过加入不同浓度的NaCl考察离子强度对荧光强度的影响。结果(图6)表明,NaCl浓度在0~20 mmol/L之间时,SYBR GreenⅠ及ROX的荧光强度均随着NaCl浓度的增加而增加。当NaCl浓度达到20 mmol/L后,其荧光强度趋于稳定。本实验选择NaCl浓度为20 mmol/L。2.7 工作曲线及检出限
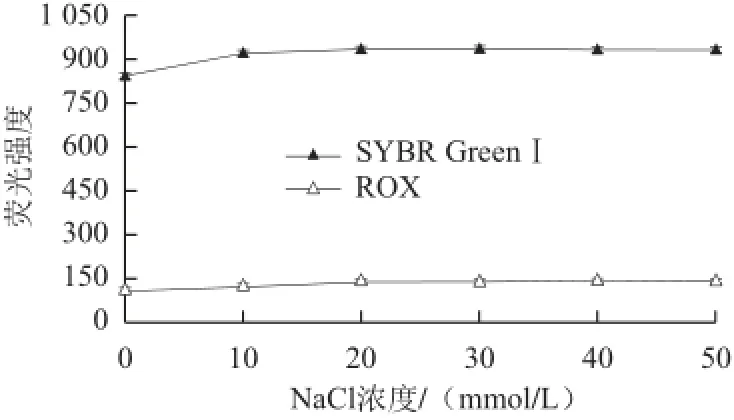
图 6 离子强度对荧光强度的影响Fig.6 Effect of ionic strength on the fl uorescence intensity
在最优实验条件下,对Hg2+的浓度与相应SYBR GreenⅠ及ROX的荧光强度之间的关系进行考察。结果(图7)表明,在Hg2+浓度为5×10—10~500× 10—10mol/L之间时,SYBR GreenⅠ及ROX总的荧光强度∆IT(ΔIT=ΔI1+ΔI2,I1为SYBR GreenⅠ的荧光强度,I2为ROX的荧光强度;ΔI = I—I0,I0和I分别表示有Hg2+和没有Hg2+时的荧光强度)与Hg2+浓度(C)之间具有良好的线性关系。其拟合的回归方程为ΔIT= 2.121 3C+ 10.536 0(R2= 0.998 6)。对9 个浓度为5×10—9mol/L 的平行样品分别进行检测以评价方法的精密度,9个检测结果的相对标准偏差为4.43%,说明方法具有良好的精密度。用空白试剂标准偏差(n=11)的3倍除以回归方程的斜率得方法的检出限为2×10—10mol/L。
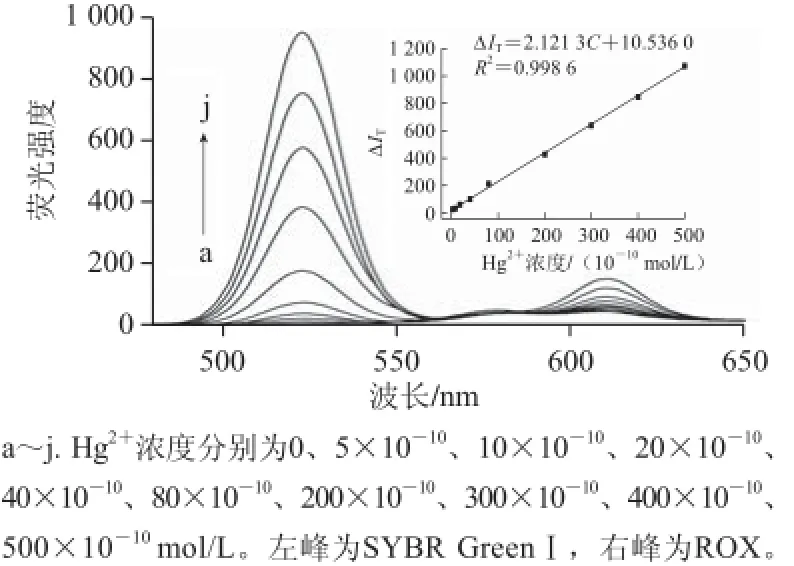
图 7 工作曲线Fig.7 Calibration curve
2.8 干扰实验
按照检测Hg2+的实验方法,考察大米中常见的金属离子Ca(Ⅱ)、Mg(Ⅱ)、Pb(Ⅱ)、Fe(Ⅱ)、Fe(Ⅲ)、Mn(Ⅱ)、Cu(Ⅱ)、Al(Ⅲ)、K(Ⅰ)、Na(Ⅰ)、Ni(Ⅱ)、Cd(Ⅱ)及Cr(Ⅲ)对Hg2+测定的干扰。结果(图8)表明,在其他金属离子浓度为Hg2+浓度100倍的情况下(Hg2+的浓度为5×10—8mol/L,其他金属离子的浓度为5×10—6mol/L),Hg2+所对应的两种荧光染料的荧光强度还是远大于其他金属离子,这表明该方法对大米中Hg2+的检测具有很高的选择性。2.9 与原子荧光法测定结果的比较及其应用
在不含Hg2+的大米中加入已知量的Hg(NO3)2,样品经消化后分别用本方法和原子荧光法测定Hg2+的含量,结果如表1所示。可以看出,2 种方法测定结果基本相同。本方法应用于加入大米中Hg(NO3)2的检测,结果如表2所示。由表2可知,在本实验所使用的大米中未检测出Hg2+,该检测方法用于加入大米Hg(NO3)2的检测可获得较为满意的结果。
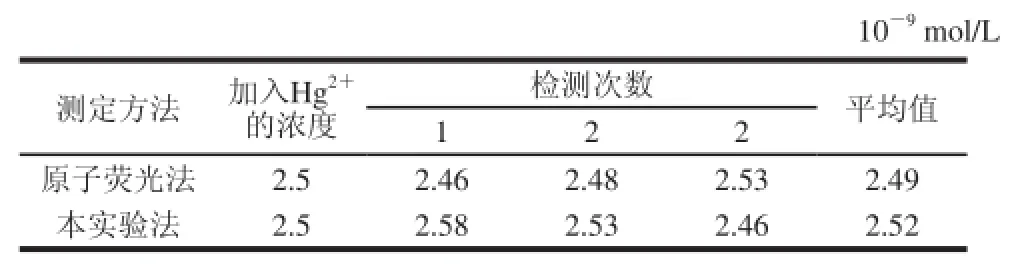
表 1 不同测定方法实验结果Table 1 Results obtained with different methods

表 2 加入大米中Hg(NO 的检测结果Table 2 Recoveries from rice samples spiked with Hg(NO3)2
3 结 论
本实验利用含有T碱基错配部分互补的两条单链核酸,结合氧化石墨烯及核酸染料SYBR GreenⅠ,建立了一种大米中Hg2+的定量检测方法。这种分析方法简单快速、选择性好、灵敏度高、检出限低。将这种分析方法应用于大米中Hg2+的检测,获得了满意的结果。
[1] PROKOPOWICZ A, PAWLAS N, OCHOTA P, et al. Blood levels of lead, cadmium, and mercury in healthy women in their 50 s in an u rban area of Poland: a pilot study[J]. Polish Journal of Environmental Studies, 2014, 23(1): 167-175.
[2] AL-SALEH I, SHINWARI N, MASHHOUR A, et al. Heavy metals (lead, cadmium and mercury) in maternal, cord blood and placenta of healthy women[J]. International Journal of Environmental Health Research, 2011, 214(2): 79-101.
[3] LIU Yurong, ZHENG Yuanming, ZHANG Limei, et al. Effects of mercury on reproduction, avoidance, and heat shock protein gene expression of the soil springtail Folsomia Candida[J]. Environmental Toxicology and Chemistry, 2011, 30(7): 1729-1730.
[4] PANEBIANCO S, SIDA J L, GOUTTE H, et al. Role of deformed shell effects on the mass asymmetry in nuclear fission of mercury isotopes[J]. Physical Review C, 2012, 86(6): 45-53.
[5] PATEL U B, BLOMQVIST L K, TAYLOR F, et al. MRI after treatment of locally advanced rectal cancer: how to report tumor respo nse-the mercury experience[J]. American Journal of Roentgenology, 2012, 199(4): 486-495.
[6] RUANO A. Mercury and cancer: usefulness of cohort studies[J]. Gaceta Sanitaria, 2007, 21(3): 218.
[7] PATEL U B, TAYLOR F, BLOMQVIST L, et al. Magnetic resonance imaging-detected tumor response for locally advanced rectal can cer predicts survival outcomes: mercury experience[J]. Journal of Clinical Oncology, 2011, 29(28): 3753-3760.
[8] COULOMB B, THERAULAZ F, CERDA V, et al. Fast and simultaneous complexometric determination of copper (Ⅱ), iron (Ⅱ) and me rcury (Ⅱ) in natural waters and effl uents using a robust UV-visible spectral deconvolution[J]. Quimica Analitica, 1999, 18(3): 255-262.
[9] SHEKHAR R. Improvement of sensitivity of electrolyte cathode discharge atomic emission spectrometry (ELCAD-AES) for mercury using acetic acid medium[J]. Talanta, 2012, 93: 32-36.
[10] LEMOS V A, DOS SANTOS L O. A new method for preconcentration and determination of mercury in fish, shellfish and saliva by cold vapour atomic absorption spectrometry[J]. Food Chemistry, 2014, 149: 203-207.
[11] CAMPANELLA B, ONOR M, D'ULIVO A, et al. Impact of protein concentration on the determination of thiolic groups of ovalbumi n: a size exclusion chromatography-chemical vapor generation-atomic fluorescence spectrometry study via mercury labeling[J]. Analytical Chemistry, 2014, 86(4): 2251-2256.
[12] HAYASHI K, OHSAKO J, NAKAJIMA T, et al. Fractional determination of mercury species in biological samples by use of HPLC a nd cold vapor atomic fl uorescence spectrometry[J]. Bunseki Kagaku, 2012, 61(12): 1073-1077.
[13] MONTERO-ALVAREZ A, de la CAMPA M D F, SANZ-MEDEL A. Mercury speciation in cuban commercial edible fi sh by HPLC-ICP-MS usin g the double spike isotope dilution analysis strategy[J]. International Journal of Environmental Health Research, 2014, 94(1): 36-47.
[14] WU M, KEMPAIAH R, HUANG P J J, et al. Adsorption and desorption of DNA on graphene oxide studied by fl uorescently labeled oligonucleotides[J]. Langmuir, 2011, 27(6): 2731-2738.
[15] HUANG P J J, LIU J W. DNA-length-dependent fluorescence signaling on graphene oxide surface[J]. Small, 2012, 8(7): 977-983.
[16] WANG Xue, ZHONG Shuhua, HE Yu, et al. A graphene oxiderhodamine 6G nanocomposite as turn-on fluorescence probe for selective detection of DNA[J]. Analytical Methods, 2012, 4(2): 360-362.
[17] LI Feng, FENG Yan, ZHAO Can, et al. A sensitive graphene oxide-DNA based sensing platform for fl uorescence “turn-on” detection of bleomycin[J]. Chemical Communications, 2012, 48(1): 127-129.
[18] SUN W L, SHI S, YAO T M. Graphene oxide-Ru complex for label-free assay of DNA sequence and potassium ions via fl uorescence resonance energy transfer[J]. Analytical Methods, 2011, 3(11): 2472-2474.
[19] LIU X Q, AIZRN R, FREEMAN R, et al. Multiplexed aptasensors and amplifi ed DNA sensors using functionalized graphene oxide: application for logic gate operations[J]. ACS Nano, 2012, 6(4): 3553-3563.
[20] MAO Shun, YU Kehan, LU Ganhua, et al. Highly sensitive protein sensor based on thermally-reduced graphene oxide field-effect transistor[J]. Nano Research, 2011, 4(10): 921-930.
[21] SINGER V L, LAWLOR T E, YUE S. Comparison of SYBR (R) green Ⅰ nucleic acid gel stain mutagenicity and ethidium bromide mutagenicity in the salmonella/mammalian microsome reverse mutation assay (ames test)[J]. Mutation Research, 1999, 439: 37-47.
[22] ZHANG Xiaoru, LI Ying, SU Haoran, et al. Highly sensitive and selective detection of Hg2+using mismatched DNA and a molecul ar light switch complex in aqueous solution[J]. Biosensors and Bioelectronics, 2010, 25(6): 1338-1343.
Dual Color Fluorescence Quantitative Detection of Mercury in Rice
ZHAI Kun1,2, WANG Lianzhi2,XIANG Dongshan1,2,*
(1. Key Laboratory of Biologic Resources Protection and Utilization of Hubei Province, Hubei Minzu University, Enshi 445000, China; 2. School of Chemical and Environmental Engineering, Hubei Minzu University, Enshi 445000, China)
A highly sensitive and selective dual color fl uorescence quantitative detection method for mercury (Hg2+) in rice was developed by synchronous scanning fluorescence spectrometry. In this method, two complementary single-stranded nucleic acids with T-T mismatches, SYBR GreenⅠ and graphene oxide were employed. Under the optimum conditions, the total fl uorescence intensity of SYBR GreenⅠ and carboxy-X-rhodamine (ROX) exhibited good linear dependence on the quantity of Hg2+in the range of 5 × 10-10–500 × 10-10mol/L. The fi tted regression equation was ∆IT= 2.121 3 C + 10.536 0 with a detection limit of 2 × 10-10mol/L (3σ). The proposed method displayed a good precision, high selection, simple operation, fast detection, low detection limit and high sensitivity. This method has been applied with satisfactory results.
mercury; quantitative detection; dual color fl uorescence; rice
S132
A
1002-6630(2015)02-0179-05
10.7506/spkx1002-6630-201502034
2014-04-08
国家自然科学基金地区科学基金项目(21465010;31460172);湖北省教育厅重点项目(D20131905;D20131906);
生物资源保护与利用湖北省重点实验室开放基金项目(PKLHB1316);湖北省林学一级学科资助项目
翟琨(1978—),女,副教授,硕士,研究方向为土壤化学与环境。E-mail:zk3100@sina.com
*通信作者:向东山(1974—),男,副教授,博士,研究方向为分析化学。E-mail:zk3100@sohu.com
