大鼠血浆中枸杞多糖荧光标记物定量分析方法的建立
2015-12-10唐华丽王少康杨立刚孙桂菊
陈 忱,唐华丽,马 月,王少康,杨立刚,彭 景,孙桂菊,*
(1.东南大学公共卫生学院营养与食品卫生学系,教育部环境医学工程重点实验室,江苏 南京 210009;2.无锡工艺职业技术学院,江苏 无锡 214200;3.重庆三峡学院 生命科学与工程学院,重庆 404000;4.扬州大学旅游烹饪学院,江苏 扬州 225000)
大鼠血浆中枸杞多糖荧光标记物定量分析方法的建立
陈 忱1,2,唐华丽1,3,马 月1,王少康1,杨立刚1,彭 景4,孙桂菊1,*
(1.东南大学公共卫生学院营养与食品卫生学系,教育部环境医学工程重点实验室,江苏 南京 210009;2.无锡工艺职业技术学院,江苏 无锡 214200;3.重庆三峡学院 生命科学与工程学院,重庆 404000;4.扬州大学旅游烹饪学院,江苏 扬州 225000)
建立大鼠血浆中异硫氰酸荧光素标记的枸杞多糖(fluorescein isothiocyanate labeled Lycium barbarum polysaccharides,LBP-FITC)的荧光定量分析方法,线性方程为y=1 378.7x—14.98(R2=0.998 9),血浆中LBP-FITC质量浓度在0.05~10 μg/mL范围内与荧光强度呈良好的线性关系。方法的精密度、回收率以及稳定性考察分析证明该方法符合生物样品体内定量分析的要求。单次灌胃给予大鼠LBP-FITC后,以药代动力学WinNonlin软件采用非房室模型拟合大鼠单次口服LBP-FITC的经时血药质量浓度数据,计算主要的药代动力学参数为最大峰质量浓度(Cmax)(2.39±0.71) μg/mL、达峰时间(tmax)(1.17±0. 41) h;药时曲线下面积AUC0-t为(45.85±7.12)(μg•h)/mL,AUC0-∞为(127.31±39.00)(μg•h)/mL;半衰期(t1/2)为(80.32±32.70) h;清除率为(1 693.96±492.47)mL/kg;平均滞留时间为(20.64±1.36) h。
异硫氰酸荧光素标记的枸杞多糖;药代动力学;稳定性;回收率
药物代谢动力学的研究是生物活性物质研究的一项重要内容,其运用数学原理和方法阐述药物在机体内的动态规律,主要研究被测对象在生物体内的过程,包括吸收、分布、代谢和排泄[1]。枸杞多糖(Lycium barbarum polysaccharides,LBP)是枸杞发挥功效的重要成分,体内外实验证实LBP具有多种功效,例如抗氧化、调节免疫、抗衰老、降血糖、降血脂、抗动脉粥样硬化等[2-6]。但作用机理目前研究并不深入,尤其是与功效学研究相比,LBP的代谢动力学研究鲜见报道。LBP是一种蛋白多糖,易溶于水,但是其没有光吸收基团和发色基团,不能采用光谱法或色谱法进行直接检测。本实验组通过异硫氰酸荧光素(fl uorescein isothiocyanate,FITC)与LBP的共价偶联,实现对枸杞多糖的荧光标记,成功制备得到荧光探针LBP-FITC,并且标记产物具有良好的体外稳定性,因此可通过测定其荧光强度对其进行定量分析,从而克服了LBP难以进行高灵敏度检测的困难[7]。有研究发现该标记方法对多糖生物活性影响较小,对细胞不产生毒性[8-9]。
本实验建立了大鼠血浆中LBP-FITC的定量分析方法,应用已建立的定量分析方法对LBP-FITC 单次口服给药的大鼠代谢动力学进行研究,以期为多糖的功效机制研究提供良好的依据。
1 材料与方法
1.1 材料、实验动物与试剂
枸杞购自宁夏银川市场。
清洁级SD雄性大鼠(体质量200~250 g,动物许可证号:SCXK(沪)2012-0006) 上海杰思捷实验动物有限公司。
FITC 美国Sigma公司;单糖标准品为分析纯。
1.2 仪器与设备
L-550离心机 湖南离心机仪器有限公司;电子分析天平 瑞士Mettler Toledo公司;Mithras LB 940多功能酶标仪 德国Berthold公司。
1.3 方法
1.3.1 枸杞多糖的提取与荧光标记
本研究的LBP采用膜分离技术提取,Sevag法脱蛋白[10],纯化得到的多糖。紫外和红外光谱分析证明LBP是一种与蛋白结合的复合多糖,存在β-D型吡喃糖和α-异构体吡喃糖。离子色谱分析发现LBP中单糖含量最高的是葡萄糖,其次是阿拉伯糖和半乳糖。LBP荧光标记参照文献[11]报道,主要过程为将制备的LBP溶于水中,0.5 mol/mL NaHCO3溶液调节pH值至8.0,加入FITC,室温避光搅拌反应24 h。反应结束后,将反应液采用中速定性滤纸过滤,向滤液中加入无水乙醇至乙醇终体积分数为80%,沉淀析出,离心弃去上清液。沉淀加水复溶,无水乙醇再沉淀,反复3 次。再将沉淀用无水乙醇反复洗涤,直至上清液无荧光吸收后,冻干沉淀得LBP-FITC。
1.3.2 实验动物
体质量200~250 g SD雄性大鼠饲养于东南大学公共卫生学院动物实验室,期间提供标准动物饲料,自由饮水进食。符合卫生部颁布的《卫生部医学实验动物管理实施细则》和《实验动物管理条例》的规定。
1.3.3 实验设计
1.3.3.1 LBP-FITC在大鼠血浆中的定量分析方法研究
参考其他方法[12-13]对血浆中LBP-FITC进行定量分析。
LBP-FITC标准贮备液的配制:精确称取LBP-FITC样品100 mg,置于100 mL容量瓶中,加入磷酸盐缓冲溶液稀释至刻度,配制成1 mg/mL的LBP-FITC标准贮备液,于4 ℃条件下保存。
LBP-FITC标准系列溶液的配制:临用时精密量取贮备液适量,用磷酸盐缓冲溶液配制成质量浓度0.25、0.5、1、2.5、5、10、25、50 μg/mL的LBP-FITC标准系列溶液。
1.3.3.2 实验动物处理
实验前大鼠自由摄食和饮水,在适应环境3 d后进行实验。通过股动脉取血,血样放入EDTA处理过的管中,在4 ℃、3 000 r/min离心10 min,取上清液获得空白血浆,置于EP管中可立即使用或置于—70 ℃冰箱中保存备用。
1.3.3.3 样品测定LBP-FITC的测定
采用多功能酶标仪,在荧光激发波长495 nm、发射波长520 nm条件下测定其荧光强度。取大鼠血浆150 μL至黑色酶标板中测定荧光强度。
1.3.3.4 标准曲线的绘制
取大鼠空白血浆120 μL,精密加入30 μL不同质量浓度的LBP-FITC标准系列溶液,配制成相当于质量浓度分别为0.05、0.1、0.2、0.5、1、2、5、10 μg/mL的血浆样品,同时制备同体积的磷酸缓冲液代替LBP-FITC标准溶液用以测定空白血浆样品,之后按照1.3.3.3节操作。以血浆中待测样品LBP-FITC的质量浓度为横坐标,测定的荧光强度扣除空白血浆的荧光强度为纵坐标,用加权最小二乘法进行回归运算,所得的直线回归方程即为标准曲线。
1.3.3.5 方法的精密度考察
取大鼠空白血浆120 μL,精密加入不同质量浓度LBP-FITC标准溶液,分别制备低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)3 个质量浓度的质量控制(quality control,QC)样品,每一质量浓度进行5 样本分析。按照1.3.3.3节操作,将扣除空白血浆荧光强度后的值代入当天相应的标准曲线,分别计算QC样品测得的质量浓度,与配制的质量浓度进行对照求得方法的精密度。在同一天内重复测定5 次,连续测定5 d,以计算日内和日间相对标准偏差(relative standard deviation,RSD)。
1.3.3.6 方法的回收率考察
取大鼠空白血浆120 μL,精密加入不同质量浓度LBP-FITC标准溶液,分别制备低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)3 个质量浓度的QC样品,每一质量浓度进行5 样本分析。按照1.3.3.3节操作,每个样品测定5 次,将扣除空白血浆荧光强度后的值代入当天相应的标准曲线,分别计算QC样品测得的质量浓度,与配制的质量浓度对照求得方法的回收率。相对回收率的计算见以下公式:

1.3.3.7 方法的稳定性考察
取大鼠空白血浆120 μL,精密加入不同质量浓度LBP-FITC标准溶液,分别制备低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)3 个质量浓度的QC样品,反复冻融3 次(—20~25 ℃),每一质量浓度进行5 样本分析,按照1.3.3.3节操作,每个样品测定5 次,将扣除空白血浆荧光强度后的值代入当天相应的标准曲线,分别计算QC样品测得的质量浓度,计算RSD,考察样品在反复冻融3 次后的稳定性。
另取大鼠空白血浆120 μL,精密加入不同质量浓度LBP-FITC标准溶液,分别制备低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)3 个质量浓度的QC样品,每一质量浓度进行5 样本分析,于室温(25 ℃)条件下放置24 h,按照1.3.3.3节操作,每个样品测定5 次,将扣除空白血浆荧光强度后的值代入当天相应的标准曲线,分别计算QC样品测得的质量浓度,计算RSD,考察样品在室温(25 ℃)情况下放置24 h后的稳定性。
取大鼠空白血浆120 μL,精密加入不同质量浓度LBP-FITC标准溶液,分别制备低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)3 个质量浓度的QC样品,每一质量浓度进行5 样本分析,于—20 ℃条件下贮存15 d后取样,迅速融化,按照1.3.3.3节操作,每个样品测定5 次,将扣除空白血浆荧光强度后的值代入当天相应的标准曲线,分别计算QC样品测得的质量浓度,计算RSD,考察样品在—20 ℃冷冻条件下贮存半个月后的稳定性。
1.3.3.8 单次口服LBP-FITC的大鼠代谢动力学研究
健康雄性SD大鼠(200~250 g)6 只,在适应环境3 d后进行实验。给药前禁食12 h,自由饮水,经口服灌胃给予LBP-FITC,给药剂量200 mg/kg(以体质量计),给药容量1 mL/100 g。分别于灌胃给药前及给药后0.5、1、2、3、4、6、8、12、24、48 h尾静脉取血0.5 mL。将血样采集到抗凝离心管中,3 000 r/min离心10 min,取上清液得到血浆,按1.3.3.3节条件测定荧光强度。
1.4 数据处理
利用药代动力学WinNonlin软件,采用非房室模型拟合大鼠单次口服LBP-FITC的经时血药质量浓度数据,最大峰质量浓度(Cmax)及达峰时间(tmax)为实测值;药时曲线下面积(area under the curve,AUC)、半衰期(t1/2)、总清除率(clearance,CL)、表观分布容积(Vd)、平均滞留时间(mean residence time,MRT)等用统计矩参数。AUC反映药物进入血循环的总量;t1/2表示药物在体内分布达到平衡后,血浆药物质量浓度消除一半所需的时间,是表达药物在体内消除快慢的重要参数;CL表示单位时间内有多少分布容积中的药物被清除,是估算药物从体内消除速度的参数;MRT是指药物分子滞留在体内的平均时间;Vd值表征药物在体内被组织摄取的能力,表观容积大的药物体内存留时间较长。
2 结果与分析
2.1 血药质量浓度标准曲线
所得线性回归方程为y=1 378.7x—14.98(R2=0.998 9),血浆中LBP-FITC质量浓度在0.05~10 μg/mL范围内与荧光强度线性关系良好,线性方程满足代谢动力学的研究要求。
2.2 血浆精密度
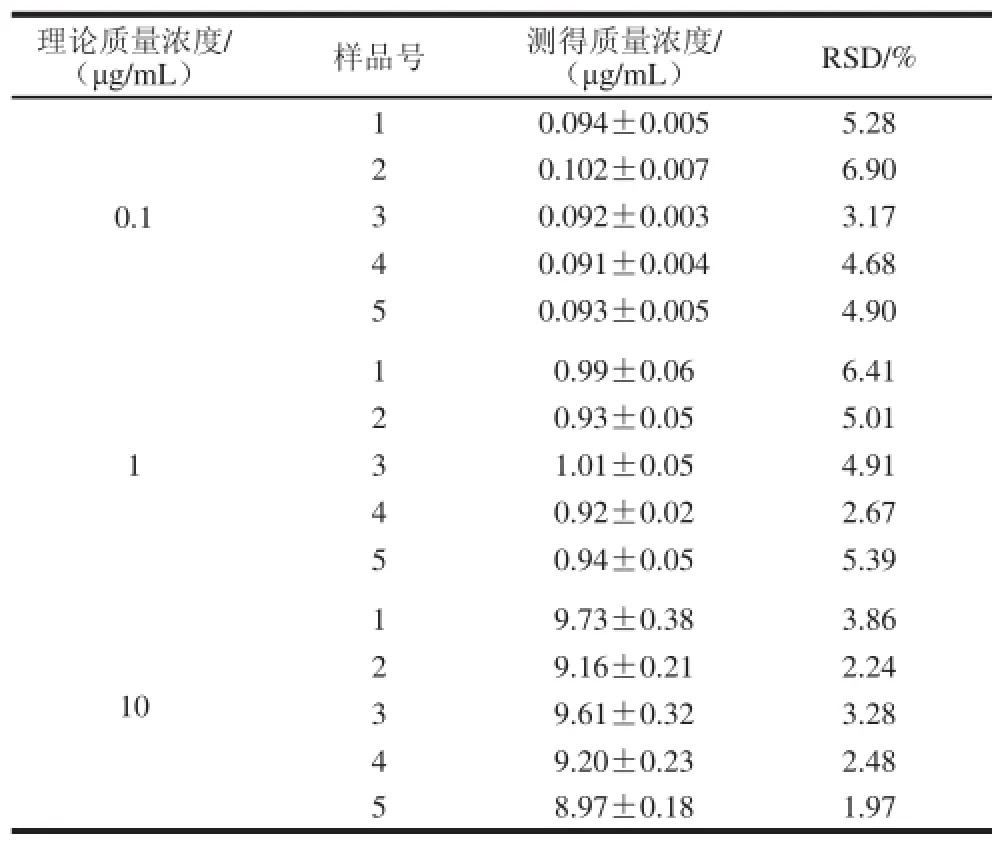
表 1 大鼠血浆中LBP-FITC测定方法的日内精密度(n=5)Table 1 Inter-day precision of LBP-FITC in blank rat plasma ( n= 5)

表 2 大鼠血浆中LBP-FITC测定方法的日间精密度(n=5)Table 2 Intra-day precision of LBP-FITC in blank rat plasma (n= 5)
由表1、2可知,大鼠血浆中LBP-FITC质量浓度为0.1 μg/mL的5 个样品日内RSD分别为5.28%、6.90%、3.17%、4.68%、4.90%,日间RSD为4.15%;质量浓度为1 μg/mL的日内RSD分别为6.41%、5.01%、4.91%、2.67%、5.39%;日间RSD为3.13%;质量浓度为10 μg/mL的日内RSD分别为3.86%、2.24%、3.28%、 2.48%、1.97%,日间RSD为2.62%。组内和组间的RSD都较小,证明该方法具有较好的精密度。
2.3 血浆回收率
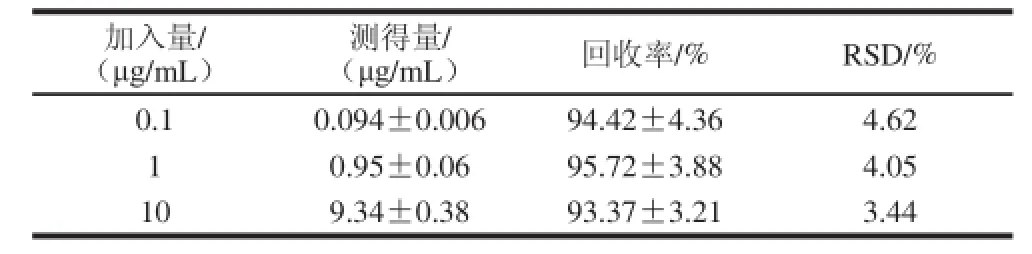
表 3 大鼠血浆中LBP-FITC测定方法的回收率(n=5)Table 3 Recovery of LBP-FITC in rat plasma (n=5)
由表3可知,回收率在93.37%~95.72%之间,RSD分别为3.44%~4.62%,表明该方法具有良好回收率。
2.4 血浆稳定性
样品在室温放置24 h、反复冻融3 次和冻存15 d后的稳定性测定结果见表4,显示RSD均较小,不大于5%,故含药血浆在室温条件下存放24 h、反复冻融3 次以及—20 ℃条件下贮存15 d的稳定性均良好。
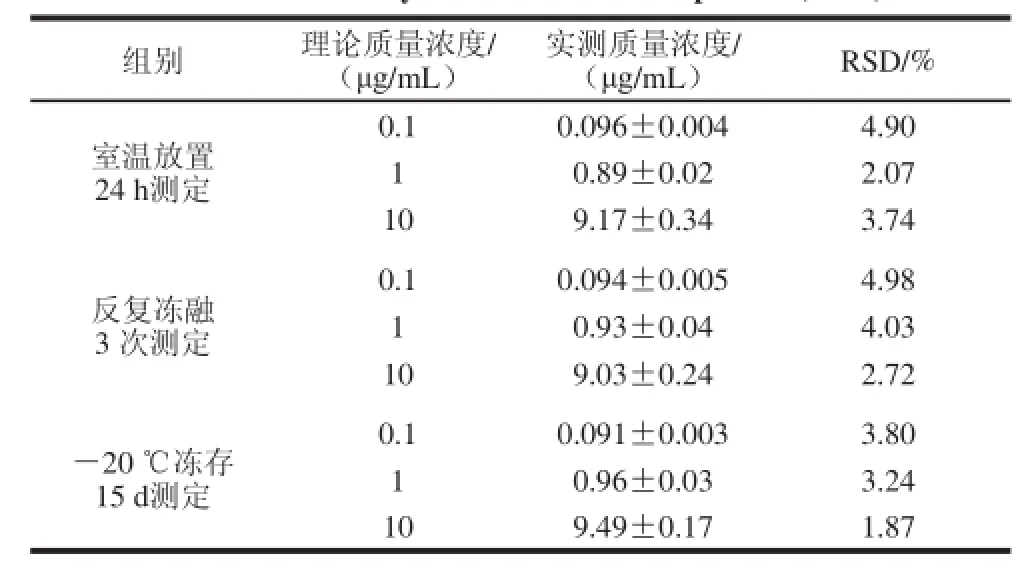
表 4 大鼠血浆中LBP-FITC测定方法的稳定性结果(n=5)Table 4 Stability of LBP-FITC in rat plasma (n = 5)
2.5 大鼠单次口服LBP-FITC血药质量浓度-时间曲线
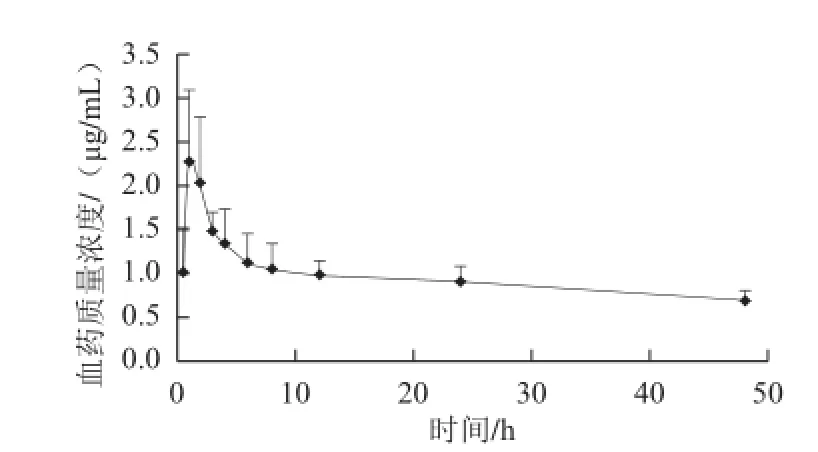
图 1 大鼠单次口服LBP-FITC的血药质量浓度-时间曲线Fig.1 Plasma concentration-time profi le of LBP-FITC after oral administration
大鼠单次灌胃给予200 mg/kg LBP-FITC后,以测定的血浆药物质量浓度对所对应的采血点作图,获得血药质量浓度-时间曲线图,见图1。结果发现在灌胃后0.5 h就可在大鼠血浆中检测出一定的荧光强度,表明0.5 h时LBP已吸收进入血液,1~2 h达到吸收高峰,之后随着时间的延长血药质量浓度逐渐减少,且速率逐渐减缓,直至48 h时仍能在血浆中测到荧光强度。
2.6 大鼠单次口服LBP-FITC的血浆药代动力学参数
利用药代动力学WinNonlin软件,采用非房室模型拟合大鼠单次口服LBP-FITC的经时血药质量浓度数据,计算得到主要药代动力学参数见表5。

表 5 大鼠单次口服LBP-FITC的主要药代动力学参数Table 5 Non-compartmental pharmacokinetic parameters of LBP-FITC after oral administration
如表5 所示,6 只动物的最大血药质量浓度Cmax为(2.39±0.71) μg/mL;最大峰时间tmax为(1.17±0.41)h;AUC0-t为(45.85±7.12)(μg·h)/mL;AUC0-∞为(127.31±39.00)(μg·h)/mL;t1/2为(80.32±32. 70) h;CL为(1693.96±492.47) mL/kg;MRT为(20.64±1.36)h。
本研究中Cmax和t1/2值可说明LBP-FITC在大鼠体内的吸收迅速,但是消除缓慢,这可能与其高分子的性质有关。
3 讨 论
近年来,天然多糖的研究越来越受到人们的重视,但是多糖在体内的代谢过程一直是人们所面临的困惑。研究表明多糖可以以大分子形式吸收,但吸收率不高,有学者推测在大肠可能有部分多糖的代谢物-寡糖类被吸收,发挥吸收作用,产生类似与多糖的药理作用,而剩余部分经大肠排泄[14]。但是多糖吸收后以何种方式存在,又是以什么形式发挥多重功效的,尚未有文章报道。代谢动力学研究可以揭示多糖在生物体内的吸收、分布、代谢及排泄的规律,并且也是阐明多糖及其代谢产物的药理和毒理作用的物质基础[15]。随着科学技术的不断发展,研究者也开始尝试将同位素标记方法运用到多糖类物质的代谢动力学研究当中。谢炳华等[16]采用氚离子束标记茯苓聚糖,并口服灌胃小鼠以研究其在体内的药代动力学。结果发现,药物质量浓度-时间曲线属于动力学双室模型,消除半衰期较长(104 h),这可能是由于其高分子的性质所决定的。O′har[17]采用同位素标记法制备3H-香菇多糖,研究其在大鼠、小鼠和狗体内的药代动力学。结果显示,3H-香菇多糖在大鼠、小鼠和狗体内的分布没有明显区别,单次静脉注射后血浆中的放射性强度逐渐减少,尿液和粪便中均能检测出放射性;在肝脏和脾脏中也能检测出放射性物质,但另一方面,肾脏和肺中的放射性强度迅速下降。陈群等[18]利用天青A与硫酸化多糖产生变色反应的特性,建立了大鼠血浆中茯苓多糖硫酸酯(pachyman sulfate,PS)的光谱检测方法,同时测定了大鼠尾静脉注射和腹腔注射PS后的血药质量浓度,计算主要药代动力学参数。结果发现PS的药代动力学复合一房室、一级消除的开放模型,生物利用度为69.12%。
多糖结构复杂,缺少可见光、紫外光和荧光等光谱特征,体外检测多是采用连接荧光检测器或者蒸发光散射检测器的高效液相色谱(high performance liquid chromatography,HPLC)方法。但是由于体液成分较为复杂,使用HPLC方法时需要先进行去蛋白处理,易破坏多糖的结构,影响检测效果,并且操作要求高,设备价格昂贵,因此同位素标记法进行多糖代谢研究结果有片面性和困难性[19]。有学者开始尝试荧光标记多糖用于多糖代谢研究中。胡锦珍等[20]采用FITC对壳聚糖进行荧光标记得到产物为FITC-CIS,采用荧光分光光度计测定和HPLC分析相结合的方法发现小鼠口服FITC-CIS后主要分布在肾脏中,并以原型形式经粪便排出,部分分解的壳聚糖则从尿液排出,但是血清中的FITC-CIS质量浓度非常低,可能是具有较高分子质量的壳聚糖很难被吸收进入血液的缘故。谢华通等[21-22]同样采用FITC标记麦冬多糖MDG-1得到F-MDG-1,采用荧光凝胶色谱法观察多糖在大鼠胃肠道内的含量变化以及排泄变化。结果显示,给予相同剂量的F-MDG-1,随着在胃内停留时间的延长,其质量分数由99.65%下降到42.45%;给予不同剂量后,1 h的测得质量分数占给药量的百分比随着给药剂量的增加而增加,考虑到胃酸的酸性pH值影响荧光响应值,将pH值调至7.2后含量并未变化,提示F-MDG-1在胃内不受环境以及蛋白酶的影响,在胃内不被分解。4 h后大肠和小肠中的测得量均有减少,数据结果表明MDG-1在肠道内分解,主要代谢部位在大肠。尿液和粪便中测定均在12 h时达到最大值,随后逐渐减少。
本实验采用荧光酶标仪测定血浆中的LBP-FITC的荧光强度以计算其中的药物质量浓度。相比较于荧光分光光度计,荧光酶标仪检测方法对生物样品需求量少,仅需100~200 μL即可进行测定,节省生物样品,且可同时测定多个样品,操作方便。
目前对于方法学的考察确证主要包括对方法的选择性、线性及范围、精密度、回收率和样品稳定性等方面的考察,要求测定5~8 个系列质量浓度的生物样品来绘制标准曲线,并且标准曲线要覆盖待测样品的质量浓度范围。另外样品从采集到分析这一过程需经过很多步骤,保证样品的稳定性是定量分析可靠的一个必要条件,因此在分析方法的建立过程中应充分了解样品在分析操作过程中的稳定性。文献[23]认为应首先考虑被测物在储存条件下的可稳定性时间,其次考虑被测物在生物样品中的稳定性,包括在室温、冷冻贮存和反复冻融条件下的稳定性。故本研究对所建立的方法进行了线性、精密度、回收率及稳定性的考察,结果表明该检测方法线性范围较宽、灵敏度高、重复性好,生物样品中的内源性杂质对测定不产生干扰,符合药代动力学研究的指导原则以及生物样品分析国际规范的相关要求,为进一步的多糖代谢动力学研究提供良好的检测方法。
一直以来,由于多糖没有准确灵敏的检测方法,所以与药效学相比,LBP等多糖类的代谢动力学研究鲜未报道。本研究利用已建立的检测方法对大鼠单次口服LBP-FITC后的血浆代谢动力学进行初步研究。结果发现,在大鼠灌胃给予LBP-FITC后0.5 h就可在血浆中的检测出一定的荧光强度,说明LBP在大鼠体内吸收较快。1~2 h达到吸收最大峰,之后随着时间的延长血药质量浓度逐渐减少,直至48 h时仍能在血浆中测到荧光强度。
本实验建立了一种准确、灵敏且快速简便的测定大鼠血浆中LBP-FITC的荧光检测法,并应用该方法对大鼠单次口服LBP-FITC的大鼠代谢动力学展开了研究,可为以后多糖的功效机制研究提供良好的依据。
[1] MAGER D E. Quantitative structure-pharxmcokinetic/ pharmacodynamic rektionships[J]. Advanced Drug Delivery Reviews, 2006, 58(12/13): 1326-1356.
[2] KE Mang, ZHANG Xianjun, HAN Zihua, et al. Extraction, purification of Lycium barbarum polysaccharides and bioactivity of purifi ed fraction[J]. Carbohydrate Polymers, 2011, 86(1): 136-141.
[3] LUO Qiong, LI Zhuoneng, YAN Jun, et al. Lycium barbarum polysaccharides induce apoptosis in human prostate cancer cells and inhibits prostate cancer growth in a xenograft mouse model of human prostate cancer[J]. Journal of Medicinal Food, 2009, 12(4): 695-703.
[4] 蔡慧珍, 刘福康, 芦慧霞, 等. 枸杞多糖对2型糖尿病病人的短期干预[J]. 食品科学, 2012, 33(13): 259-262.
[5] ZHAO R, LI Q, XIAO B. Effect of Lycium barbarum polysaccharide on the improvement of insulin resistance in NIDDM rats[J]. Yakugaku Zasshi: Journal of the Pharmaceutical Society of Japan, 2005, 125(12): 981-988.
[6] CAI Huizhen, WANG shaokang, SHENG Junli, et al. Nephroprotective effects and its mechanism of an herbal prescription on diabetic nephropathy rats[J]. Asian Journal of Chemistry, 2013, 25(2): 775-779.
[7] 陈忱, 蔡慧珍, 唐华丽, 等. 枸杞多糖提取工艺的研究进展[J]. 粮食与食品工业, 2013, 20(4): 54-57.
[8] 李福川, 耿美玉, 李英霞, 等. 海洋硫酸多糖911的荧光标记研究[J].高等学校化学学报, 2002, 23(9): 1704-1708.
[9] 唐惠玲, 陈涛, 王莹, 等. 虫草多糖荧光标记的方法学研究[J]. 药学与临床研究, 2010, 18(3): 279-281.
[10] WANG C C, CHANG S C, CHEN B H. Chromatographic determination of polysaccharides in Lycium barbarum Linnaeus[J]. Food Chemistry, 2009, 116(2): 595-603.
[11] 陈忱, 蔡慧珍, 唐华丽, 等. 枸杞多糖的组成分析及其荧光标记研究[J].时珍国医国药, 2014(10): 2312-2315.
[12] 刘萍. 抗老年痴呆寡糖类药物971临床药代动力学方法学的建立[D].青岛: 中国海洋大学, 2009.
[13] 姜鹏. 麝香保心丸代谢组学和代谢动力学研究[D]. 北京: 第二军医大学, 2012.
[14] 张恩户, 王瑞昙, 岳明, 等. 中药多糖类化合物肠内转运与代谢研究的思考[J]. 陕西中医学院学报, 2009(5): 6-7.
[15] 胡炅, 陈汇. 药物代谢动力学在药物研究中的应用与进展: 上[J]. 中国药师, 2007, 10(7): 651-653; 656.
[16] 谢炳华, 张年宝, 俞斌伟, 等. 茯苓聚糖的氚离子束标记及其在小鼠体内的药物动力学研究[J]. 核技术, 1990(11): 693-695.
[17] O'HARA Y. Fate of lentinan (antitumor polysaccharide) Ⅰ:-fate of lentinan in mice, rats, and dogs[J]. The Journal of Toxicological Sciences, 1980, 5: 59-72.
[18] 陈群, 王爱云, 焦庆才. 光谱法测定大鼠血浆中茯苓多糖硫酸酯及其药代动力学研究[J]. 中国中药杂志, 2010(22): 3052-3055.
[19] 高其品, 陈慧群, 王坤, 等. 银耳多糖在大鼠体内的吸收、分布和排除[J]. 中国药学杂志, 2002, 37(3): 47-50.
[20] 胡锦珍, 张家骊, 程沁园, 等. 壳聚糖在小鼠体内的组织分布与排泄[J].食品与生物技术学报, 2009, 28(5): 611-615.
[21] 谢华通, 王硕, 阮克峰, 等. 凝胶色谱法测定麦冬多糖MDG-1在大鼠胃肠道含量变化[J]. 中国实验方剂学杂志, 2012, 18(13): 139-145.
[22] 谢华通, 王硕, 阮克峰, 等. 荧光凝胶色谱法测定大鼠单次口服麦冬多糖MDG-1排泄变化[J]. 中国实验方剂学杂志, 2012, 18(17): 152-156.
[23] BUICK A, DOIG M, JEAL S, et al. Method validation in the bioanalytical laboratory[J]. Journal of Pharmaceutical and Biomedical Analysis, 1990, 8(8): 629-637.
Establishment of A Method for Detecting Fluorescence Labeled Lycium barbarum Polysaccharide in Rat Plasma
CHEN Chen1,2, TANG Huali1,3, MA Yue1, WANG Shaokang1, YANG Ligang1, PENG Jing4, SUN Guiju1,*
(1. Key Laboratory of Environmental Medicine and Engineering, Ministry of Education, Department of Nutrition and Food Hygiene, School of Public Health, Southeast University, Nanjing 210009, China; 2. Wuxi Institute of Arts and Technology, Wuxi 214200, China; 3. College of Life Science and Engineering, Chongqing Three Gorges University, Chongqing 404000, China; 4. Tourism Institute, Yangzhou University, Yangzhou 225000, China)
A rapid and sensitive fl uorescent method was developed to determine fl uorescein isothiocyanate-labeled Lycium barbarum polysaccharides (LBP-FITC) in rat plasma. The linear calibration curve was obtained in the range from 0.05 to 10 μg/mL in rat plasma and the linear equation was y = 1 378.7x-14.98 (R2= 0.998 9). The inter-day coefficients of variation (CVs) at 0.1, 1.0 and 10 μg/mL of LBP-FITC were between 1.97% and 6.90%, and the intraday CVs at the three concentrations were between 2.62% and 4.15%. The recovery rates of LBP-FITC in rat plasma wer e between 93.37% and 95.72%. LBP-FITC was stable in rat plasma. The established method is suitable for LBP-FITC pharmacokinetic study. After oral administration of LBP-FITC to rats, the non-compartmental model was used to calculate the main pharmacokinetic parameters by WinNonlin software. The results of pharmacokinetic parameters indicated that the peak concentration (Cmax) was (2.39 ± 0.71) μg/mL, the time to reach the peak value (tmax) was (1.17 ± 0.41) h, the area under the curve (AUC0-t) was (45.85 ± 7.12) (μg·h)/mL, the AUC0-∞was (127.31 ± 39.00) (μg·h)/mL, the t1/2was (80.32 ± 32.70) h, the clearance (CL) was (1 693.96 ± 492.47) mL/kg, and the mean retention time (MRT) was (20.64 ± 1.36) h.
fl uorescein isothiocyanate-labeled Lycium barbarum polysaccharides (LBP-FITC); pharmacokinetics; stability; recovery rate
R151.3
A
1002-6630(2015)02-0090-06
10.7506/spkx1002-6630-201502017
2014-06-20
国家自然科学基金面上项目(81273069);国家大学生创新性实验计划项目(1310286097);
江苏省高等学校大学生实践创新训练计划项目(S2014116)
陈忱(1989—),女,助教,硕士研究生,研究方向为植物化学物与食品功效。E-mail:chen_chen0214@163.com
*通信作者:孙桂菊(1963—),女,教授,博士,研究方向为植物化学物与食品功效。E-mail:gjsun@seu.edu.cn
