大叶麻竹笋多糖分离纯化工艺
2015-12-10吴金松夏雪娟阚建全
吴金松,郑 炯,夏雪娟,汪 健,阚建全,*
(1.西南大学食品科学学院,重庆 400715;2.郑州科技学院食品科学与工程学院,河南 郑州 450064;3.重庆市食品药品监督检验所,重庆 401121)
大叶麻竹笋多糖分离纯化工艺
吴金松1,2,郑 炯1,夏雪娟1,汪 健3,阚建全1,*
(1.西南大学食品科学学院,重庆 400715;2.郑州科技学院食品科学与工程学院,河南 郑州 450064;3.重庆市食品药品监督检验所,重庆 401121)
以水提醇沉法提取到的大叶麻竹笋粗多糖为原料,对其进行脱蛋白、透析脱色、DEAE-52纤维素柱层析分级、Sephadex-50葡聚糖凝胶柱分级处理,探究大叶麻竹笋多糖的分离纯化工艺。研究结果表明,木瓜蛋白酶结合Sevag法是最佳脱蛋白条件;进行DEAE-52纤维素柱分级,以纯水、0.05mol/L和0.1mol/L NaCl溶液洗脱获得了3 种主要的大叶麻竹笋多糖组分BSP1、BSP2、BSP3;再进行Sephadex-50葡聚糖凝胶分级,分别纯化得到了BSP1A、BSP2A、BSP3B 3种多糖组分,这3 种多糖组分基本不含蛋白质和核酸,且纯度均达到了95.3%以上。
大叶麻竹笋多糖;脱蛋白法;透析脱色法;分级纯化法;纯度鉴定
竹笋是禾本科(Poaceae)竹亚科(Bambusoideae)植物的新生芽,一直以来以高纤维、低脂、营养丰富的“素食第一品”著称[1];大叶麻竹(Dendrocalamus latiflorus)是中国产笋量较高的品种之一,具有较高的营养价值[2-3]。多糖是大叶麻竹笋中一种重要生物活性成分,传统水提醇沉法从大叶麻竹笋中提取得到的多糖不仅产率较低,而且粗多糖中含有蛋白质、色素等杂质,纯度较低[4]。因此,探究大叶麻竹笋多糖的最佳分离纯化工艺对于更深层次的结构分析和活性研究有着重要的意义。
活性多糖分离纯化工艺一般包括多糖除杂和多糖分级两个过程。其中多糖的除杂过程包括粗多糖的脱去蛋白、脱去色素和流水透析除去小分子化合物等[5-9];多糖的分级过程主要包括乙醇沉淀分级、季铵盐沉淀分级、金属盐沉淀法分级和DEAE-纤维素凝胶色谱分离[10-14]。通常一次分级纯化很难达到理想的分级效果。因此,本研究采取DEAE-52纤维素阴离子交换柱初次纯化和葡聚糖凝胶柱色谱再次纯化相结合的方法。由于竹亚科植物中含有的多糖一般为相对分子质量不大的水溶性多糖[15],本实验采取DEAE-52纤维素和Sephadex-50葡聚糖凝胶作为柱色谱分级的填充料,以期获得较高纯度的大叶麻竹笋多糖。
1 材料与方法
1.1 材料与试剂
大叶麻竹笋 北碚农贸市场。
无水乙醇、氯化钠、葡萄糖标品、苯酚、硫酸、无水乙醚、丙酮、葡萄糖、氯仿、三氯乙酸、正丁醇、亚磷酸、考马斯亮蓝G250(均为分析纯) 成都市科龙化工试剂厂;牛血清白蛋白(bovine serum albumin,BSA) 上海如吉生物科技有限公司;木瓜蛋白酶(酶活力50 000 U/g) 南宁东恒华道生物科技有限责任公司;MWCO.1000即用型透析袋(1 000 D) 美国Spectrum公司;DEAE-52纤维素 北京索莱宝科技有限公司;Sephadex-50、Sephadex-100葡聚糖凝胶 瑞典Pharmacia公司。
1.2 仪器与设备
玻璃层析柱(2.8 cm×50 cm和1.6 cm× 70 cm) 成都东方玻璃仪器公司;722可见光分光光度计 上海菁华科技仪器有限公司;SHZⅢ循环水式多用真空泵 郑州长城科工贸有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器有限公司;78-1磁力加热搅拌器 常州奥华仪器有限公司;BS-100A自动部分收集器、HL-2D恒流泵 上海青浦沪西仪器厂;UV-2450紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 大叶麻竹笋多糖分离纯化工艺流程
大叶麻竹笋粗多糖→脱蛋白→流水透析→乙醇沉淀→冷冻干燥→DEAE-52纤维素柱色谱分级→收集洗脱液→苯酚-硫酸法跟踪检测→490nm波长条件下作洗脱曲线→收集洗脱峰组分→Sephadex-50葡聚糖凝胶柱色谱分级→同上收集洗脱峰组分→真空浓缩→冷冻干燥→精制大叶麻竹笋多糖
1.3.2 大叶麻竹笋多糖脱蛋白工艺[16-17]
1.3.2.1 Sevag法
Sevag试剂用氯仿和正丁醇体积比4∶1配制,再按Sevag试剂与多糖溶液体积比2∶5加入Sevag试剂,混合物剧烈振摇30 min,静置2 h后,弃去底层白色蛋白乳浊液,重复操作8 次以上,直到两相界面无变性蛋白为止,取少许多糖溶液,稀释至适当的质量浓度,苯酚-硫酸法[18]和考马斯亮蓝法[19]测定多糖及蛋白含量。
1.3.2.2 正丁醇-三氯乙酸法
选取样品液与三氯乙酸-正丁醇体积比1∶2、三氯乙酸与正丁醇体积比1∶5、振摇时间30 min、静置时间3 h,进行沉淀后,离心除去胶状沉淀。重复以上的操作直至溶液不再继续混浊为止,取少许多糖溶液,稀释至适当的质量浓度,苯酚-硫酸法和考马斯亮蓝法测定多糖及蛋白含量。
1.3.2.3 三氯乙酸法
三氯乙酸是一种有机酸,使多糖提取液中的蛋白质与有机酸作用而变性沉淀。该法是在多糖水提液中滴加一定质量分数与多糖水提取液等体积的三氯乙酸,混匀静置过夜,离心除去胶状沉淀,取少许多糖溶液,稀释至适当的质量浓度,苯酚-硫酸法和考马斯亮蓝法测定多糖及蛋白含量。
1.3.2.4 酶解结合Sevag法
加0.5 mg/mL的木瓜蛋白酶,60 ℃恒温水浴条件下保持3 h,然后升温至90 ℃、10 min进行灭酶处理,后面处理方法如Sevag法所述。
1.3.3 大叶麻竹笋多糖透析脱色[20]
取脱蛋白后的水相溶液流水透析48 h,透析液浓缩至适当体积,加入3 倍无水乙醇进行沉淀,4 ℃静置4 h,4 500 r/min离心15 min后取沉淀,无水乙醇反复洗涤沉淀,经过冷冻干燥,即为粗品竹笋多糖。
1.3.4 纤维素柱色谱分级[21]
DEAE-52纤维素进行活化处理后,采用湿法装柱。取脱蛋白、透析后的粗多糖样品100 mg用纯水溶解后上柱,按照顺序用蒸馏水及0.05、0.1、0.2、0.5 mol/L NaCl溶液进行梯度洗脱,每个梯度洗脱300 mL,先经过纯水洗脱平衡除杂,自动部分收集器收集洗脱液,4 mL/管,以硫酸苯酚法[22]进行跟踪检测,测定每管洗脱液490 nm波长处吸光度,以管数为横坐标,吸光度为纵坐标绘制洗脱曲线图。
1.3.5 葡聚糖凝胶柱色谱分级[23]
1.3.5.1 Sephadex-50葡聚糖凝胶的预处理
取一定量的Sephadex-50葡聚糖凝胶加三蒸水加热煮沸3h膨化,待凝胶膨化完成后,用水反复漂洗,倾泻去除表面的杂质和不均匀的细小凝胶颗粒。
1.3.5.2 Sephadex-50葡聚糖凝胶柱层析
将经过预处理的Sephadex-50葡聚糖凝胶采用湿法装柱,分别取纤维素柱纯化过的3种多糖组分BSP1、BSP2、BSP3各30 mg溶解后上Sephadex-50葡聚糖凝胶柱(1.6 cm×70 cm),以蒸馏水做洗脱液,自动部分收集器收集洗脱液,每管约3 mL,以苯酚硫酸法跟踪检测每管洗脱液490 nm波长处的吸光度,以管数为横坐标、吸光度为纵坐标绘制洗脱曲线图。
产后产妇因妊娠期和产后内分泌紊乱,易出现精神方面症状,特别是当新生儿有畸形或性别不如意时,产妇会出现失望、情绪低落、食欲不振、睡眠不好等情况,若不进行及时的心理护理,短期会影响子宫复旧,造成大出血,远期会遗留产后抑郁症。服务人员应针对个体情况科学安慰产妇,向其讲述不良心理状态对自己身体的影响。经常了解产妇的身体状况和新生儿情况,讲解新生儿可能出现的一些生理变化,使产妇放心。同时,告诉产妇母乳喂养的好处,使产妇建立母乳喂养的信心并指导产妇采用正确的哺乳方法以及充分休息、保持心情舒畅、营养丰富的饮食,早哺乳有利于乳汁分泌。
1.3.6 大叶麻竹笋多糖纯度鉴定
1.3.6.1 凝胶过滤法[24-25]
分别取经Sephadex-50葡聚糖凝胶柱分离纯化后的不同组分,溶解后上Sephadex-100葡聚糖凝胶柱(1.6 cm×70 cm),以蒸馏水为洗脱液。自动部分收集器收集洗脱液,每管约6 mL,通过苯酚硫酸法跟踪检测每管洗脱液A490nm,以490 nm波长处吸光度对洗脱液管数做洗脱曲线图。
1.3.6.2 紫外全波段扫描法[26]
经过纯化后的3 种主要多糖组分,分别命名为BSP1A、BSP2A、BSP3B,分别取一定量的3 种多糖组分溶于纯水中,在紫外分光光度计上进行190~400 nm波长处的全波段扫描。
1.4 数据处理
使用Origin 8.6和Excel进行图表的绘制,正交软件和SPSS 19.0软件进行相关数据的处理。
2 结果与分析
2.1 大叶麻竹笋多糖脱蛋白
2.1.1 Sevag法脱蛋白
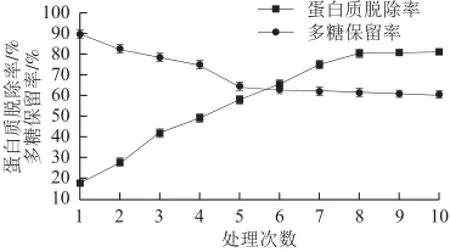
图 1 Sevag法脱蛋白结果Fig.1 Removal of protein by Sevag method
如图1所示,随着处理次数的增加,蛋白质脱除率随之增加,处理8 次以上,蛋白质脱除率可达到80%以上;但是处理次数的增加会导致多糖保留率降低,经过6 次脱蛋白处理后,多糖保留率低于60%,之后趋于平稳。由于每次沉淀蛋白质变性化合物时,同时不可避免的包含了部分多糖,此外一些糖蛋白等蛋白复合物在处理时也可能会沉淀下来,导致了部分多糖损失。Sevag法作为一种传统的脱蛋白方法,蛋白质脱除率和多糖保留率都较高,适宜竹笋粗多糖的脱蛋白处理,处理8 次以上可以达到良好的效果。
2.1.2 正丁醇-三氯乙酸法脱蛋白

图 2 正丁醇-三氯乙酸法脱蛋白结果Fig.2 Removal of protein by trichloroacetic acid-butanol method
如图2所示,经过前3 次处理后,粗多糖溶液中蛋白质脱除率就大幅提高,之后随着处理次数的增加,蛋白质脱除率虽然也随之增加,但是增加幅度趋缓,经过5 次处理后蛋白质脱除率达到85.6%。但是,由于每次的脱蛋白处理都会造成溶液中多糖保留率的下降,经过5 次处理后多糖保留率仅为率33.76%。相比于Sevag法,正丁醇-三氯乙酸法脱除蛋白质效果较佳,但是更易引起多糖的降解。因此,该方法不适宜大叶麻竹笋多糖脱蛋白。
2.1.3 三氯乙酸法脱蛋白

图 3 三氯乙酸法脱蛋白结果Fig.3 Removal of protein by trichloroacetic acid method
如图3所示,竹笋粗多糖溶液经不同质量分数三氯乙酸脱蛋白处理,三氯乙酸质量分数为12%时,蛋白质脱除率最高,达到78.2%,由于三氯乙酸具有酸性,会引起多糖的降解,导致部分多糖损失;随着三氯乙酸质量分数增加,多糖保留率逐渐降低,减少到50%以下。蛋白质脱除率在三氯乙酸质量分数达到12%后增加不显著,因此,用该方法处理,三氯乙酸质量分数采用12%较好,但是相比于Sevag法,多糖保留率较低,因此该方法不如Sevag法脱蛋白效果好。
2.1.4 木瓜蛋白酶结合Sevag法脱蛋白
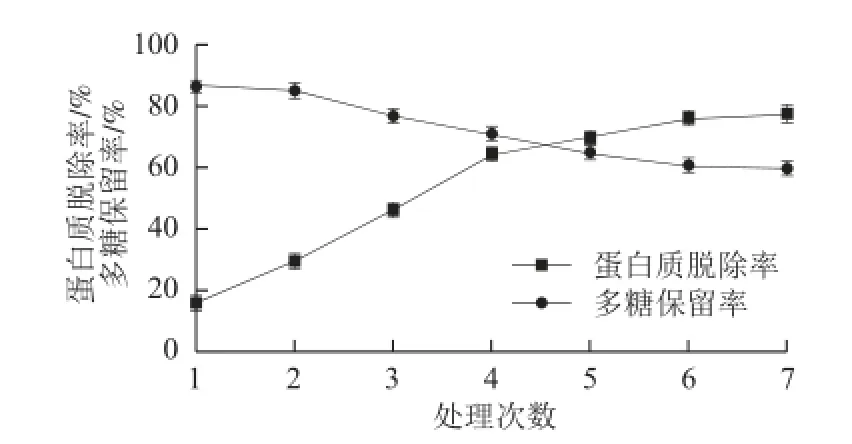
图 4 酶结合Sevag法脱蛋白结果Fig.4 Removal of protein by combined use of papain treatment and Sevag method
如图4所示,经过6 次脱蛋白处理后,蛋白质脱除率和多糖保留率趋于稳定,比较图3可知,酶结合法处理6次后可以达到Sevag法处理10 次以上的效果,这是因为木瓜蛋白酶的酶解作用,导致糖结合蛋白分离开来,进而有利于蛋白质的脱除,由于木瓜蛋白酶的作用,减少了处理次数,提高了脱蛋白效率,因此木瓜蛋白酶酶解结合Sevag法是大叶麻竹笋粗多糖脱蛋白最佳工艺。
2.2 大叶麻竹笋多糖DEAE-52纤维素阴离子交换柱色谱分级
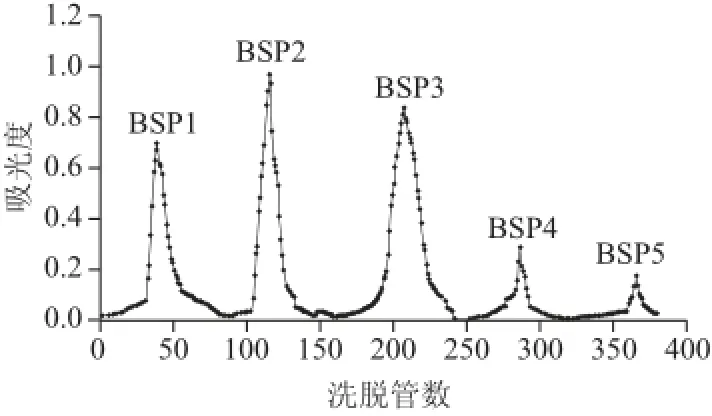
图 5 大叶麻竹笋多糖DEAE-52纤维素层析柱洗脱曲线Fig.5 Elution profi les on DEAE-cellulose 52 chromatographic column
采用DEAE-52纤维素阴离子交换层析柱对大叶麻竹笋多糖进行纯化,硫酸-苯酚法显色,结合特征吸收峰检测多糖,洗脱曲线见图5,以纯水、0.05 mol/L NaCl溶液、0.1 mol/L NaCl溶液、0.2 mol/L NaCl溶液、0.5 mol/L NaCl溶液为洗脱液,洗脱组分分别命名为BSP1、BSP2、BSP3、BSP4、BSP5。分别收集各吸收峰洗脱液,旋转蒸发浓缩,透析后冷冻干燥,计算出得率分别为19.3%、25.4%、29.6%、4.6%、2.2%。由于BSP4、BSP5得率太低,而BSP1、BSP2、BSP3得率较高,所以BSP1、BSP2、BSP3作为主要的洗脱组分。
2.3 大叶麻竹笋多糖组分Sephadex-50葡聚糖凝胶洗脱
2.3.1 大叶麻竹笋多糖组分BSP1 Sephadex-50葡聚糖凝胶洗脱曲线
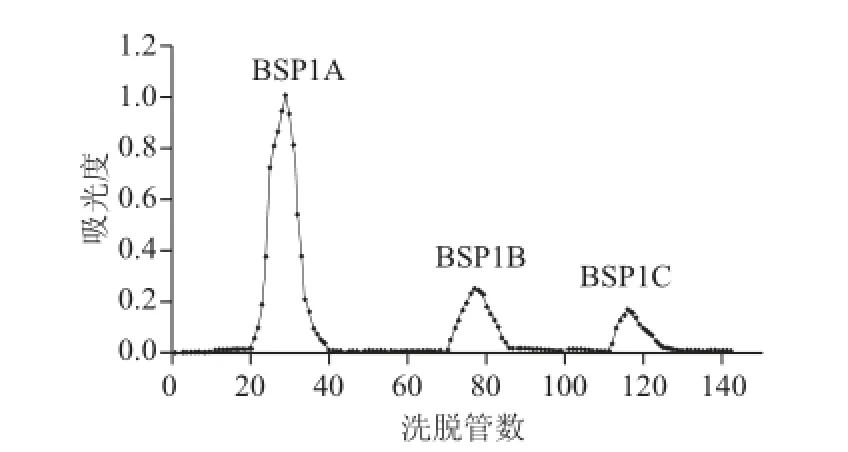
图 6 大叶麻竹笋多糖组分BSP1 Sephadex-50葡聚糖凝胶洗脱曲线Fig.6 Elution profi les of BSP1 on Sephadex-50 chromatographic column
如图6所示,经DEAE-52纤维素分级纯化后的多糖组分BSP1分别用纯水、0.05 mol/L NaCl溶液和0.1 mol/L NaCl溶液经过Sephadex-50葡聚糖凝胶洗脱,得到BSP1A、BSP1B、BSP1C 3种多糖组分,其得率分别为40.6%、8.5%、5.3%。由于BSP1B、BSP1C两种多糖组分得率太低,本研究选择得率最高的BSP1A做进一步的分析研究。
2.3.2 大叶麻竹笋多糖组分BSP2 Sephadex-50葡聚糖凝胶洗脱曲线
如图7所示,经DEAE-52纤维素分级纯化后的多糖组分BSP2过Sephadex-50葡聚糖凝胶,分别用纯水、0.05 mol/L NaCl溶液和0.1 mol/L NaCl溶液洗脱,得到BSP2A、BSP2B、BSP2C 3种多糖组分,其得率分别为47.9%、5.5%、9.8%。由于BSP2B、BSP2C两种多糖组分得率太低,本研究选择得率最高的BSP2A做进一步分析研究。
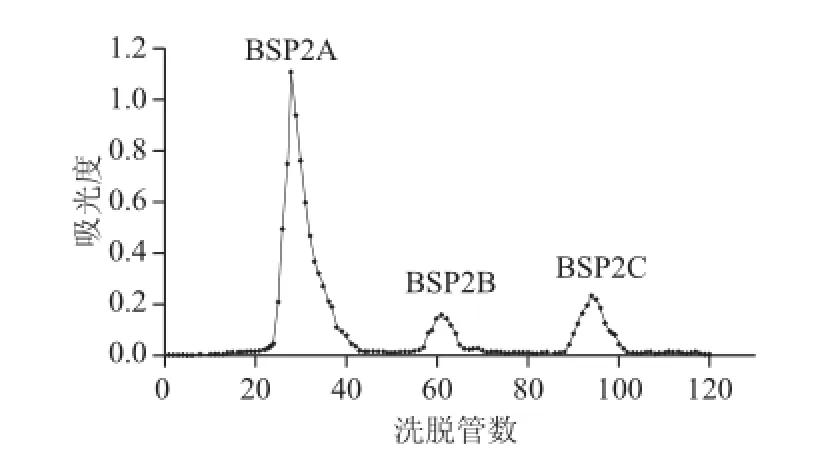
图 7 大叶麻竹笋多糖组分BSP2 Sephadex-50葡聚糖凝胶洗脱曲线Fig.7 Elution profi les of BSP2 on Sephadex-50 chromatographic column
2.3.3 大叶麻竹笋多糖组分BSP3 Sephadex-50葡聚糖凝胶洗脱曲线
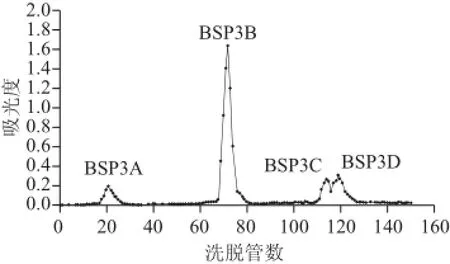
图 8 大叶麻竹笋多糖组分BSP3 Sephadex-50葡聚糖凝胶洗脱曲线Fig.8 Elution profi les of BSP3 on Sephadex-50 chromatographic column
如图8所示,经DEAE-52纤维素分级纯化后的多糖组分BSP3过Sephadex-50葡聚糖凝胶,分别用纯水、0.05 mol/L NaCl溶液和0.1mol/L NaCl溶液洗脱,得到BSP3A、BSP3B、BSP3C、BSP3D 4种多糖组分,其得率分别为4.7%、53.4%、3.8%、5.9%。由于BSP3A、BSP3C、BSP3D 3种多糖组分得率太低,且BSP3C、BSP3D两种多糖分离效果不佳,所以本研究选择得率较高的BSP3B做进一步的分析研究。
2.4 大叶麻竹笋多糖纯度鉴定
2.4.1 凝胶过滤洗脱曲线
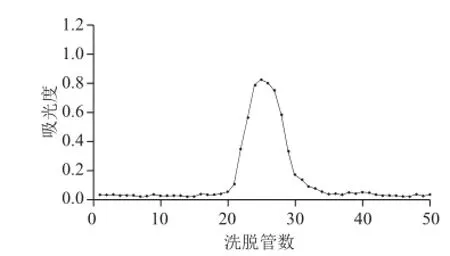
图 9 BSP1A Sephadex-100葡聚糖凝胶柱色谱洗脱曲线Fig.9 Elution prolife on Sephadex G-100 column
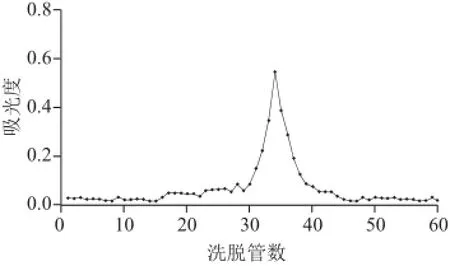
图 10 BSP2A Sephadex-100葡聚糖凝胶柱色谱洗脱曲线Fig.10 Elution profi le on Sephadex G-100 column
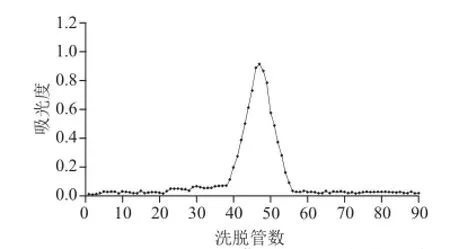
图 11 BSP3B Sephadex-100葡聚糖凝胶柱色谱洗脱曲线Fig.11 Elution profi le on Sephadex G-100 column
如图9~11所示,3种多糖组分以纯水为洗脱液,经过Sephadex-100葡聚糖凝胶柱色谱分级后,洗脱曲线为单一对称峰,说明大叶麻竹笋3种多糖组分是较纯的物质。
2.4.2 大叶麻竹笋多糖组分紫外扫描
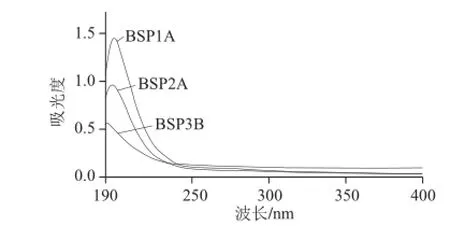
图 12 多糖组分紫外扫描图谱Fig.12 Ultraviolet spectra of purifi ed polysaccharides
如图12所示,3 种不同质量浓度的多糖组分溶液在波长190~400 nm范围内,经过紫外扫描后,BSP1A、BSP2A、BSP3B在260 nm和280 nm波长处均无明显吸收峰,说明经过葡聚糖凝胶色谱分级后,收集到的3种多糖组分较纯,基本不含有蛋白质和核酸等杂质。结合凝胶过滤法洗脱曲线,并且通过测定其多糖含量,测得其纯度为96.1%、95.3%、95.7%,因此可以判定3 种大叶麻竹笋多糖组分是较纯的物质。
3 结 论
通过比较不同的脱蛋白工艺,木瓜蛋白酶结合Sevag法是最佳的脱蛋白工艺。由于竹笋多糖溶液颜色不是很深,通过流水透析可以除去大部分色素。DEAE-52纤维素阴离子交换柱初次纯化和葡聚糖凝胶柱色谱再次纯化后,分离到了BSP1A、BSP2A、BSP3B这3 种多糖组分。凝胶过滤和紫外全波段扫描可以鉴定出3 种多糖组分是较纯的物质,且纯度均达到了95.3%以上。由于通过DEAE-52纤维素阴离子交换柱初次纯化后,多糖组分BSP1、BSP2、BSP3纯度在85.6%左右,纯度较低,需要进一步的葡聚糖凝胶柱纯化,再次纯化后,纯度较高,有利于进一步的活性分析和结构鉴定。
[1] 李安平, 谢碧霞, 钟秋平, 等. 毛竹春笋提取物抗氧化活性研究[J].食品科学, 2008, 29(5): 97-100.
[2] DEBANGANA C, JATINDRA K S, SHARMA G D. Bamboo shoot: microbiology, biochemistry and technology of fermentation: a review[J]. Indian Journal of Traditional Knowledge, 2012, 11(2): 242-249.
[3] AIDA F M N A, SHUHAIMI M, DZULKIFLY M H, et al. Prebiotic activity of polysaccharides extracted from gigantochloa levis (Buluh beting) shoots[J]. Molecules, 2012, 17(2): 1635-1651.
[4] ZHANG Zhongshan, WANG Xiaomei, YU Shuchi, et al. Isolation and antioxidant activities of polysaccharides extracted from the shoots of Phyllostachys edulis (Carr.)[J]. International Journal of Biological Macromolecules, 2011, 49(4): 454-457.
[5] LI Cong, CAI Jianping, GENG Jingshu, et al. Purification, characterization and anticancer activity of a polysaccharide from Panax ginseng[J]. International Journal of Biological Macromolecules, 2012, 51(5): 968-973.
[6] WU Yanfang, WANG Xinsheng, SHEN Biao, et al. Extraction, structure and bioactivities of the polysaccharides from Fructus corni[J]. Carbohydrate Polymers, 2003, 54(4): 419-424.
[7] MADHUKUMAR M S, MURALIKRISHMA G. Structural characterisation and determination of prebiotic activity of purified xylo-oligosaccharides obtained from Bengal gram husk (Cicer arietinum L.) and wheat bran (Triticum aestivum)[J]. Food Chemistry, 2009, 118(2): 215-223.
[8] NICOLE D, CARMEN L P. Guarana powder polysaccharides: characterisation and evaluation of the antioxidant activity of a pectic fraction[J]. Food Chemistry, 2012, 134(4): 1804-1812.
[9] WANG Zhenbin, PEI Juanjuan, MA Haile, et al. Effect of extraction media on preliminary characterizations and antioxidant activities of Phellinus linteus polysaccharides[J]. Carbohydrate Polymers, 2014, 109(4): 49-55.
[10] 许子竞, 林翠梧. 滇桂艾纳香多糖BRP的结构解析[J]. 化学学报, 2011, 69(9): 1101-1106.
[11] ZHAO Liyan, DONG Yanhong, CHEN Guitang, et al. Extraction, purifi cation, characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J]. Carbohydrate Polymers, 2010, 80(3): 783-789.
[12] YU Rongmin, WANG Lei, ZHANG Hui, et al. Isolation, purifi cation and identification of polysaccharides from cultured Cordyceps militaris[J]. Fitoterapia, 2004, 75(7/8): 662-666.
[13] MENG Fayan, NING Yuanling, QI Jia, et al. Structure and antitumor and immunomodulatory activities of a water-soluble polysaccharide from Dimocarpus longan Pulp[J]. Molecular Sciences, 2014, 15(3): 5140-5142.
[14] 韩春然, 唐娟, 马永强. 黑木耳多糖的酶法提取、纯化及性质研究[J].食品科学, 2007, 28(2): 53-55.
[15] 李义. 竹笋水溶性多糖提取工艺研究[J]. 林产化学与工业, 2008, 28(1): 99-102.
[16] 贾淑珍, 王成忠, 于功明. 香菇多糖脱蛋白工艺的研究[J]. 中国酿造, 2008, 27(5): 24-26.
[17] 黄纯, 马驰, 宋慧智, 等. 亮菌多糖提取中脱蛋白和脱色方法比较[J].药学与临床研究, 2007, 15(1): 45-46.
[18] 徐光域, 颜军, 郭晓强, 等. 硫酸-苯酚定糖法的改进与初步应用[J].食品科学, 2005, 26(8): 342-346.
[19] 邓丽莉, 潘晓倩, 生吉萍, 等. 考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J]. 食品科学, 2012, 33(24): 185-189.
[20] 李健, 李敏, 刘宁, 等. 莱菔多糖分离纯化及相对分子量初探[J]. 食品工业科技, 2010, 31(1): 151-154.
[21] CHEN Xiaoming, JIN Jing, TANG Jia, et al. Extraction, purifi cation, characterization and hypoglycemic activity of a polysaccharide isolated from the root of Ophiopogon japonicus[J]. Carbohydrate Polymers, 2011, 83(2): 749-754.
[22] 邵信儒, 孙海涛, 刘颖. 超声提取野生软枣猕猴桃多糖工艺优化[J].食品科学, 2012, 33(14): 64-67.
[23] LIANG Renjie, ZHU Ziping, BAI Yi. Isolation, chemical composition and antioxidant activities of a water-soluble polysaccharide from Rhizoma atractylodis Macrocephalae[J]. Medicinal Plants Research, 2011, 5(5): 805-810.
[24] LUO Dianhui. Identification of structure and antioxidant activity of a fraction of polysaccharide purified from Dioscorea nipponica Makino[J]. Carbohydrate Polymers, 2008, 71(4): 544-549.
[25] YANG Bao, JIANG Yueming, ZHAO Mouming, et al. Structural characterisation of polysaccharides purified from longan (Dimocarpus longan Lour.) fruit pericarp[J]. Food Chemistry, 2009, 115(2): 609-614.
[26] 肖小年, 曾海龙, 易醒, 等. 薏苡仁多糖的提取及分离纯化[J]. 食品科学, 2010, 31(22): 1-5.
Separation and Purifi cation of Polysaccharides from Ma Bamboo Shoots (Dendrocalamus latifl orus)
WU Jinsong1,2, ZHENG Jiong1, XIA Xuejuan1, WANG Jian3, KAN Jianquan1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. College of Food Science and Engineering, ZhengZhou University of Science and Technology, Zhengzhou 450064, China; 3. Chongqing Institute for Food and Drug Control, Chongqing 401121, China)
The aim of this study was to optimize the separation and purifi cation of polysaccharides from Ma bamboo shoots (Dendrocalamus latiflorus). Crude polysaccharides were extracted from bamboo shoots by hot water extraction method, deproteinized, decolorized by dialysis and fractionated by DEAE-52 cellulose and Sephadex-50 column chromatography. The results showed that papain treatment combined with Sevag method was the best deproteinization condition. Three major polysaccharide fractions were eluted from DEAE-52 cellulose with water, 0.05 mol/L NaCl and 0.1 mol/L NaCl, namely BSP1, BSP2 and BSP3, respectively. The fractions were further purifi ed by Sephadex-50 column chromatography to produce BSP1A, BSP2A and BSP3B, respectively. These further purifi ed polysaccharides were found to contain almost no protein or nucleic acid with a purity more than 95.3%.
bamboo shoot polysaccharide; deproteinization; dialysis; fractionation; purity identifi cation
TS255.1
A
1002-6630(2015)02-0080-05
10.7506/spkx1002-6630-201502015
2014-06-22
吴金松(1988—),男,硕士研究生,研究方向为食品化学与营养学。E-mail:wujinsong88@126.com
*通信作者:阚建全(1965—),男,教授,博士,研究方向为食品化学与营养学、食品质量与安全。
E-mail:ganjq1965@163.com
