正交试验优化大叶榕果实原花青素提取工艺
2015-12-10何洪洛
张 镜,何洪洛
(嘉应学院生命科学学院,广东 梅州 514015)
正交试验优化大叶榕果实原花青素提取工艺
张 镜,何洪洛
(嘉应学院生命科学学院,广东 梅州 514015)
经过溶剂种类及体积分数、提取时间、料液比、pH值、提取温度等与大叶榕果实原花青素提取效果相关的单因素试验,再经正交试验优化得大叶榕果实原花青素的最佳提取条件。提取液以正丁醇-盐酸法显色,检测546 nm波长处吸光度。研究表明大叶榕原花青素提取的优化条件是80%乙醇溶液为提取溶剂、溶液pH 3、料液比1∶15、提取时间1 h、提取温度40 ℃,各因素对原花青素提取效果的影响大小依次为:料液比>提取温度>乙醇体积分数>提取时间。以正交优化参数经5 次重复提取得到大叶榕果实原花青素含量为13.05%,提取2 次原花青素提取率为91.46%。
大叶榕;果实;原花青素;提取工艺
原花青素是一类清除自由基、抗氧化活性很强的植物天然活性产物[1-3],有抗腹泻、抗溃疡、抗疲劳、防癌抗癌、抗突变、防辐射、促进毛发生长等多重疗效,可预防自由基引起的心脏病、关节炎等80多种疾病[4-10]。原花青素以其高效、低毒、高生物利用率著称,是近年来不断研发的一种极强体内活性功能因子,在保健食品、化妆品等领域广泛应用。
原花青素由不同数量的儿茶素或表儿茶素等结合而成,最简单的原花青素是由儿茶素或表儿茶素、或儿茶素与表儿茶素形成的二聚体、三聚体、四聚体乃至十聚体。通常将二至四聚体成为低聚体,五聚体以上称为高聚体[11]。原花青素为双黄酮衍生物的天然多酚、生物类黄酮化合物[12],在酸性条件下加热可降解为红色的花青素,故称为原花青素[13-14]。20世纪50年代法国学者首先从松树皮中提取出原花青素,之后研究发现葡萄、山碴、花生、银杏、松树等植物中都含量丰富[15]。
榕树是桑科榕属无花果类植物,为热带雨林中的主要树种之一。我国榕属植物约100 种,主要分布在福建、广东、广西、海南、台湾和浙江等地。榕树叶含三萜苷、黄酮苷、酸性树脂、鞣质等,其中黄酮类和萜内酯类等有效成分对治疗冠心病、老年性痴呆、脑血栓、神经系统疾病和消除自由基、抑菌、抗癌等有显著效果,无毒副作用,并以此开发出多种药品和保健食品[16-17]。关于大叶榕树的活性物质的研究现仅见从大叶榕树叶、树须提取黄酮类物质的报道,但尚未见有大叶榕果实活性物质的报道。本研究优化大叶榕果实原花青素的提取工艺参数,为大叶榕原花青素的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
果实成熟期间从广东省梅州市采摘淡红色大叶榕成熟果实,剔出伤果、腐果,自来水洗去果面尘土,晾干果面余水,冷冻干燥,粉碎,过80 目筛,粉末物料5 ℃冰箱保存备用。
无水甲醇、无水乙醇、正丁醇(均为分析纯) 广州化学试剂厂;盐酸、硫酸铁铵(均为分析纯) 广东光华化学厂有限公司。
1.2 仪器与设备
JLL28-B低速大容量多管离心机、GL-20G-Ⅱ高速冷冻离心机 上海安亭科学仪器厂;BT2K XL冻干机美国VirTis公司;U-2800紫外-可见分光光度计 日本日立公司。
1.3 方法
1.3.1 原花青素提取效果的测定[18]
准确称取适量大叶榕果实物料,一定条件下浸提,提取液定容,取1 mL样液于比色管中,依次加入6 mL正丁醇-盐酸溶液(体积比为95∶5)和0.2 mL 2%硫酸铁铵,摇匀后沸水浴加热显色,40 min后立刻取出,冰水中冷却至室温,测反应液546 nm波长处吸光度A546nm,按公式(1)计算各处理原花青素的得率,即处理提取的原花青素占物料的质量百分比。
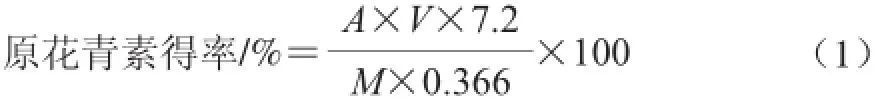
式中:A为吸光度;V为稀释倍数;M为样品质量/mg;0.366为吸收系数。
物料总原花青素含量的测定:称取物料0.500 g,以提取各因素的正交优化参数及pH 3条件下重复提取物料的原花青素5 次,合并提取液,测定提取液A546nm,按公式(2)计算得物料原花青素提取率。

式中:q为各处理原花青素的得率/%;p为物料中总原花青素的质量百分数/%。
1.3.2 提取溶剂的筛选
准确称取大叶榕果实物料0.500 g,以料液比1∶10(g/mL)分别加入70%乙醇、70%甲醇、70%丙酮、水及乙酸乙酯,30 ℃浸提1 h,4 500 r/min离心20 min,取0.2 mL上清液,定容到5 mL,同1.3.1节显色,测定A546nm。
1.3.3 单因素试验
1.3.3.1 溶剂体积分数对提取效果的影响准确称取大叶榕果实物料0.500 g,按料液比1∶10(g/mL)加入不同体积分数的乙醇水溶液,自然pH值(提取溶液未加酸、碱进行pH值调整),30 ℃浸提1 h,4 500 r/min离心20 min,取0.2 mL上清液定容到5 mL,同
1.3.1 节显色,测定A546nm。
1.3.3.2 提取时间对提取效果的影响
准确称取大叶榕果实物料0.500 g,加入体积分数为70%的乙醇,自然pH值,在料液比1∶10、温度30 ℃条件下分别浸提0.5、1、1.5、2、2.5、3h,4 500 r/min离心20 min,取0.2 mL上清液定容到5 mL,同1.3.1节显色,测定A546nm。
1.3.3.3 料液比对提取效果的影响
准确称取大叶榕果实物料0.500 g,加入体积分数为70%的乙醇,料液比分别为1∶5、1∶7.5、1∶10、1∶12.5、1∶15、1∶17.5(g/mL),自然pH值,30 ℃浸提1 h,4 500 r/min离心20 min,上清液定容到5 mL,同1.3.1节显色,测定A546nm。
1.3.3.4 pH值对提取效果的影响
准确称取大叶榕果实物料0.500 g,分别加入pH值为2.0、4.0、6.0、8.0、10.0,体积分数为70%的乙醇,在料液比1∶10、30℃条件下浸提1 h,4 500 r/min离心20 min,取0.2 mL上清液定容到5 mL,同1.3.1节显色,测定A546nm。
1.3.3.5 提取温度对提取效果的影响
准确称取大叶榕果实物料0.500 g,加入自然pH值的70%乙醇溶液,料液比1∶10,设定温度浸提1 h,4 500 r/min离心20 min,取0.2 mL上清液定容到5 mL,同1.3.1节显色,测定A546nm。
1.3.4 正交试验
根据单因素试验选择提取溶剂体积分数、料液比、提取温度、提取时间进行L9(34)正交试验。准确称取大叶榕果实物料0.500 g,pH 3,按正交试验因素组合浸提后,4 500 r/min离心20 min,上清液定容到5 mL,同1.3.1节显色,测定A546nm。
1.3.5 提取次数对提取效果的影响
准确称取大叶榕果实物料0.500 g,加入体积分数为70%的乙醇(pH 3)在料液比1∶10、温度30 ℃条件下,浸提1 h,4 500 r/min离心20min,取0.2 mL上清液定容到5 mL,同1.3.1节显色,测定A546nm,重复提取5 次。
1.4 数据分析
各处理均设3 次重复取平均值,以SPSS 13.0进行数据统计分析,并进行差异显著性测定,P<0.05差异显著,P<0.01差异极显著,以不同小写字母表示差异显著。
2 结果与分析
2.1 提取溶剂的筛选
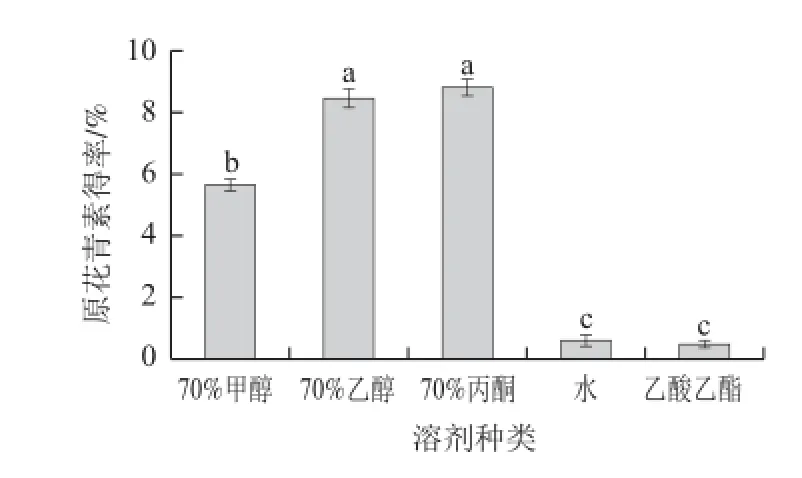
图 1 不同溶剂对大叶榕原花青素的提取效果Fig.1 Effect of solvent type on the extraction effi ciency of proanthocyanidins
由图1可知,不同溶剂对大叶榕果实原花青素的提取效果差异明显,丙酮溶液的效果最佳,甲醇、乙醇次之,乙酸乙酯的提取效果最差。丙酮的羰基氧可作为强的氢键受体,能在葡萄糖上将结合的多聚体酚类取代。因甲醇、丙酮的毒性比较高,提取物若去除不完全则存在安全性问题,而乙醇广泛应用于活性成分的提取,安全性高。另外,植物中的原花青素在花、叶、果等组织中,多以糖苷或有机酸的形式存在,而在木部坚硬组织中,则多以游离苷元形式存在。乙醇一方面易将糖苷转变为自由形式。另一方面,其极性对提取苷元结构物质十分有利。因此以乙醇为提取溶剂更适用。
2.2 乙醇体积分数对提取效果的影响

图 2 乙醇体积分数对原花青素提取效果的影响Fig.2 Effect of ethanol concentration on the extraction effi ciency of proanthocyanidins
由图2可知,以乙醇为提取溶剂,体积分数在30%~80%范围内,提取液的吸光度随着乙醇体积分数的增加而增大,80%乙醇溶液的提取效果最好。90%乙醇的提取效果比80%溶液的提取效果差,但差异不显著,无水乙醇原花青素的提取效果最差。原花青素含有多羟基,乙醇含有羟基,易于原花青素的羟基以氢键形式结合,在水溶液中两者氢键结合作用较强,80%、90%乙醇溶液的提取效果好,但无水乙醇的提取效果很差。
2.3 提取时间对提取效果的影响
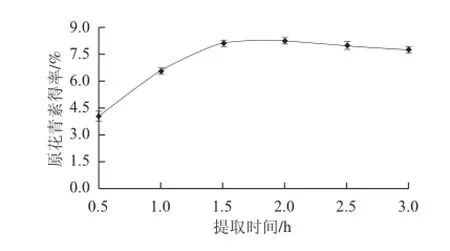
图 3 提取时间对原花青素提取效果的影响Fig.3 Effect of extraction time on the extraction effi ciency of proanthocyanidins
从图3可见,提取初期随提取时间的延长,原花青素得率逐渐增加,浸提1.5 h时大叶榕果实物料内原花青素的溶出量最大,提取效果最好,较1 h提取的效果差异极显著(P<0.01)。之后再延长提取时间,原花青素得率不仅无明显提高,反而略有下降,但差异不显著。
2.4 料液比对提取效果的影响

图 4 料液比对原花青素提取效果的影响Fig.4 Effect of solid/liquid ratio on the effi ciency of proanthocyanidins
大叶榕果实物料分别与70%乙醇溶液以不同的料液比混合,30℃提取1h。由图4可以看出,随着溶剂用量的增加,原花青素得率亦增大,当料液比达到1∶17.5时,原花青素的提取效果最好,而料液比达1∶20时,原花青素得率反而有所降低。这可能是因为溶剂用量过大溶解出了较多杂质,影响了原花青素的提取。料液比1∶15的得率8.46%,较溶剂用量较小样品差异显著(P<0.05)再提高溶剂用量原花青素的提取效果没有明显提高。溶剂用量越大提取效率越高,但溶剂的用量增大,提取液后续的溶剂回收、精制、干燥的费用增大,因此选择1∶15为最佳料液比。
2.5 pH值对提取效果的影响
由图5可以看出,在pH值为3时原花青素的提取效果最好,当pH值在3~6范围内,原花青素得率随提取pH值的升高而略有降低,在pH值大于6的条件下原花青素得率明显降低。结果表明弱酸性条件下有利于大叶榕原花青素的提取,但是酸性过强,则不利于原花青素的提取,因此适度选择酸化的乙醇有利于原花青素的提取,选择pH 3为最佳提取pH值。
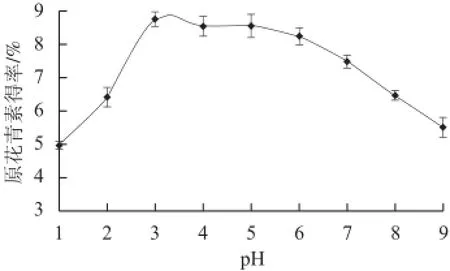
图 5 pH值对原花青素提取效果的影响Fig.5 Effect of solvent pH on the extraction effi ciency of proanthocyanidins
2.6 提取温度对原花青素提取效果的影响
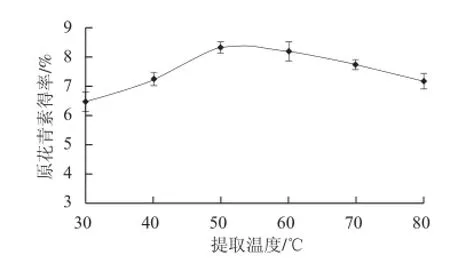
图 6 提取温度对原花青素提取效果的影响Fig.6 Effect of extraction temperature on the extraction effi ciency of proanthocyanidins
图6 为大叶榕果实物料0.500 g样品在不同温度、提取时间1 h条件下的原花青素提取结果。由图6看出,随着温度的上升,原花青素得率逐渐增大,当温度达到50 ℃时,原花青素提取效果最佳。温度高于50 ℃时,原花青素得率逐渐下降。因温度较低时原花青素与蛋白质、纤维素等结合物分离较慢,原花青素溶出量较少,提取率相对较低。在较高温度条件下,分子运动速度及渗透、扩散及溶解速度加快,原花青素的溶出量大、提取率提高;但若温度过高,原花青素容易氧化、聚合、结构易破坏,提取率降低,因此选择50 ℃为佳。
2.7 正交试验结果
根据单因素试验,对大叶榕原花青素提取的溶剂体积分数、料液比、提取时间、提取温度4 个因素进行L9(34)正交试验,因单因素试验料液比1∶15的结果最佳,且溶剂用量更小的3 个处理的提取效果均与此无显著差异(P>0.05),若再增大溶剂的用量不利于提取液后续的浓缩、干燥,故正交试验料液比的水平设置及0.500 0 g大叶榕果实物料原花青素提取的正交试验结果见表1。
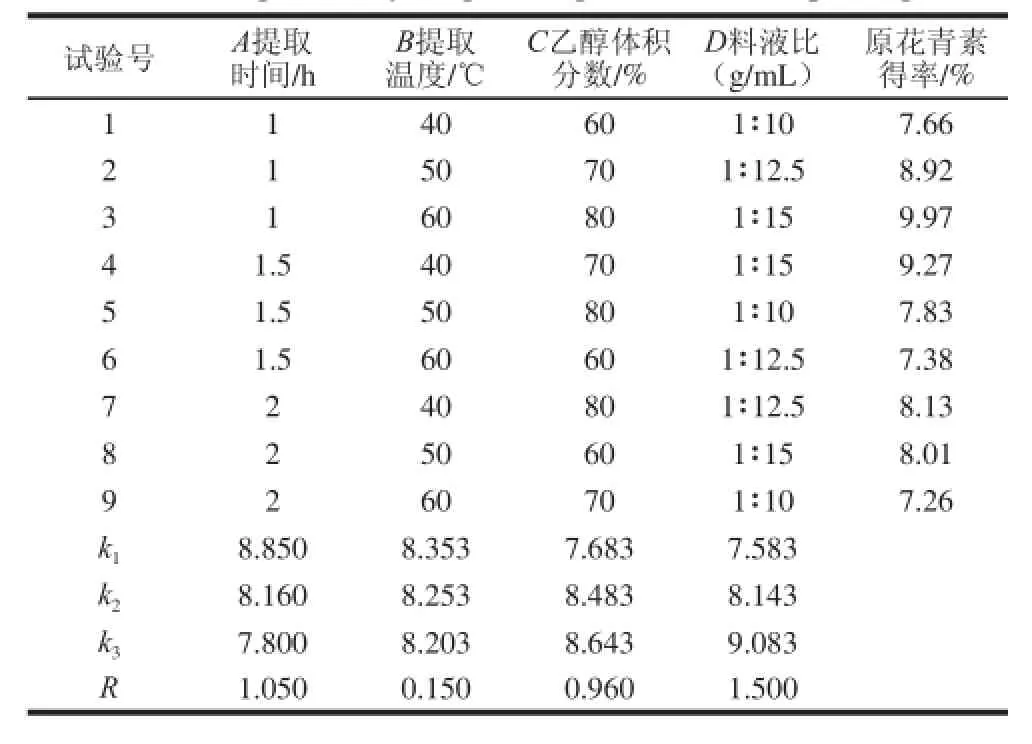
表 1 大叶榕果果实原花青素提取工艺正交试验优化设计及结果Table 1 Orthogonal array design arrangement and corresponding results
由表1可知,料液比(D)的极差最大,对物料中原花青素提取效果的影响最大,其第3水平的值最大,即料液比1∶15的效果最好。提取时间和乙醇体积分数的极差仅次于料液比,分别以第1水平和第3水平为最佳。正交试验结果表明各因素对原花青素提取效果的影响按大小排列分别为D>A>C>B,在试验范围内最好效果的提取参数为A1B1C3D3,即80%乙醇溶液为提取溶剂、料液比1∶15、提取时间1 h及提取温度40 ℃。
2.8 提取次数的确定

表 2 不同提取次数条件下原花青素的提取效果Table 2 Effects of extraction number on the extraction rate of procyanidins
由表2看出,随着提取次数的增加,原花青素的累积提取率随之提高,重复提取2 次时原花青素的累积提取率为91.46%,重复提取3 次为97.10%,仅较提取2 次的提取率高5.64%。结果表明经2 次提取原花青素大部分已从物料溶出,因此物料原花青素以正交优化的参数提取2 次即可。
3 结 论
经单因素试验与正交优化获得了大叶榕果实原80 目过筛的粉末浸取花青素的最佳工艺条件:以80%乙醇溶液提取溶剂(pH 3)、料液比1∶15、提取时间1 h、提取温度40 ℃,大叶榕果实原原花青素以优化提取参数经2次提取原花青素的提取率达到91.46%。
水果中原花青素的含量丰富,如新疆的葡萄为8.17%、欧洲李为7.61%、沙枣为6.71%、樱桃李为3.69%(均为干果)[19-20],但迄今少见有水果中原花青素的含量有超过10%的报道。而除水果外的其他植物材料中原花青素的含量更低,如高粱原花青素含量1.11%~4.10%[21]、柳树叶原花青素含量为3.17%[22]、青海蚕豆的原花青素含量约2.60%[23]。本研究对大叶榕果实原花青素经反复5 次提取的累积得率(即大叶榕果实原花青素的含量)高达13.05%,已有文献少见有植物材料中原花青素含量与此相当的报道,大叶榕不仅果实原花青素含量高,而且大叶榕树的结果量大。大叶榕树叶及树须含三萜苷、黄酮苷等多种具有医疗保健功能的生物活性物质[16-17],因而在我国大叶榕生态适宜区规模发展大叶榕树,不仅具有突出的生态效益,而且如若将废弃的果实、树叶及树须等收集开发活性物质,具有很大的经济与社会效益。
[1] 赵文恩, 韩桂花, 焦风云. 葡萄籽原花青素提取工艺研究[J]. 食品科学, 2002, 23(8): 108-110.
[2] 张镜, 刁树平. 海南蒲桃果实原花青素的体外抗氧化活性[J]. 食品科学, 2012, 33(17): 101-105.
[3] ZHU Qinyan, SCHRAMM D D, HEIDRUN G B, et al. Influence of cocoa flavanols and procyanidins on free radical-induced human erythrocyte hemolysis[J]. Clinical and Developmental Immunology, 2005, 12(1): 27-34.
[4] 国值, 徐莉. 原花青素: 具有广阔发展前景的植物药[J]. 国外医药:植物药分册, 1996, 11(5): 196-203.
[5] 林启寿. 中草药成分化学[M]. 北京: 科学出版社, 1977: 139-150.
[6] YASUDAA A, NATSUMEA M, SASAKIA K, et al. Cacao procyanidins reduce plasma cholesterol and increase fecal steroid excretion in rats fed a high-cholesterol diet[J]. BioFactors, 2008, 34(3): 211-223.
[7] ZHANG Fengjiao, YANG Jingyu, MOU Yanhua, et al. Oligomer procyanidins from grape seeds induce a paraptosis-like programmed cell death in human glioblastoma U-87 cells[J]. Pharmaceutical Biology, 2010, 48(8): 883-890.
[8] DAUGHENBAUGHA K F, HOLEDMESS J, GRAFF J C, et al. Contribution of transcript stability to a conserved procyanidin-induced cytokine response in γδ T cells[J]. Genes and Immunity, 2011, 12(5): 378-389.
[9] NEUS M M, NOEMI G A, ANNA A, et al. Procyanidins and infl ammation: molecular targets and health implications[J]. BioFactors, 2012, 38(4): 257-265.
[10] SUN C, MCINTYER K, SALEEM A, et al. The relationship between antiglycation activity and procyanidin and phenolic content in commercial grape seed products[J]. Canadian Journal of Physiology and Pharmacology, 2012, 90(2): 167-174.
[11] 张丁. 花青素与原花青素有效的纯天然抗氧化剂[J]. 科学世界, 2009(12): 28-31.
[12] 吕丽爽. 天然抗氧化剂低聚原花青素的研究进展[J]. 食品科学, 2002, 23(2): 147-150.
[13] 石壁, 狄莹. 植物多酚[M]. 北京: 科学出版社, 2000: 10-137.
[14] 王辉宪, 姜晖霞, 王仁才, 等. 葡萄子油及原花青素研究与开发利用[J].果树学报, 2005, 22(5): 542-547.
[15] 由倍安. 葡萄籽原花青素药理研究进展[J]. 国外医学: 老年医学分册, 2003, 24(3): 123-127.
[16] 黄锁义, 蒋丽芳, 刘海花, 等. 大叶榕榕树须总黄酮提取及对羟自由基清除作用[J]. 化学世界, 2006(11): 689-691.
[17] 廖莉, 刘海花, 蒋丽芳, 等. 超声波提取榕树叶(大叶)总黄酮及其鉴别[J]. 亚太传统医药, 2007(10): 46-47.
[18] 陈健, 孙爱东, 高雪娟, 等. 响应面分析法优化超声波提取槟榔原花青素工艺[J]. 食品科学, 2011, 32(4): 82-86.
[19] 刘洪, 李淼, 冯静, 等. 成都地区市售水果中原花青素含量的分析比较[J]. 陕西农业科学, 2011(4): 35-37.
[20] 秦玉玲, 车凤斌, 李疆, 等. 新疆特色果品中原花青素含量的分析比较[J]. 新疆农业科学, 2009, 46(3): 484- 487.
[21] 黄朝晖, 陆平, 孟宪军, 等. 不同产地高粱的原花青素含量测定及其抗氧化活性分析[J]. 食品工业科技, 2008, 29(9): 140-142.
[22] 陈洪玉, 迟彩霞, 王德新, 等. 柳树叶中原花青素含量测定[J]. 应用化工, 2012, 41(8): 1456-1457.
[23] 杨菁, 刘玉皎, 马晓岗. 青海不同生态区不同基因型蚕豆原花青素含量分析[J]. 北方园艺, 2010(4): 49-52.
Extraction of Procyanidins from Ficus altissima Fruits
ZHANG Jing, HE Hongluo
(School of Life Science, Jiaying University, Meizhou 514015, China)
This study was carried out with a view of determining the optimal conditions for extracting proanthocyanidins from F. altissima fruits by combined use of single factor and orthogonal array designs. The effects of solvent type and concentration, extraction time, solid/liquid ratio, pH and temperature on the extraction rate of proanthocyanidins were investigated. The extracted proanthocyanidins were assayed by colorimetry using n-butanol:hydrochloric acid at a wavelength of 546 nm. The results showed that the optimal extraction conditions were found to be extraction at 40 ℃for 1 h using 80% ethanol acidified to pH 3 with a solid/liquid ratio of 1:15, and the effect of four important variables on the extraction rate of proanthocyanidins followed the decreasing order: solid/liquid ratio > extraction temperature >ethanol concentration > extraction duration. By repeating the optimized extraction procedure five times, the content of proanthocyanidins in F. altissima fruit was measured to be 13.05% and the extraction rate of procyanidins was 91.46% after the second extraction.
Ficus altissima; fruit; proanthocyanidins; extraction
TS201.1
A
1002-6630(2015)02-0041-05
10.7506/spkx1002-6630-201502008
2014-06-28
广东省科技计划项目(2009B011300015)
张镜(1957 —),男,教授,硕士,研究方向为天然产物与应用微生物。E-mail:zhangcqf@jyu.edu.cn
