利用伯克霍尔德氏菌脂肪酶富集裂壶藻油脂中的二十二碳六烯酸
2015-12-08宋晓金谭延振徐建春冯银刚
兰 君,宋晓金,谭延振,徐建春,崔 球,4,冯银刚,*
(1.中国科学院青岛生物能源与过程研究所,青岛市单细胞油脂工程实验室,山东省能源生物遗传资源重点实验室,山东 青岛 266101;2.中国科学院大学生命科学学院,北京 100049;3.青岛琅琊台集团股份有限公司,山东 青岛 266400;4.中国科学院青岛生物能源与过程研究所,生物燃料重点实验室,山东 青岛 266101)
利用伯克霍尔德氏菌脂肪酶富集裂壶藻油脂中的二十二碳六烯酸
兰 君1,2,宋晓金1,谭延振1,徐建春3,崔 球1,4,冯银刚1,*
(1.中国科学院青岛生物能源与过程研究所,青岛市单细胞油脂工程实验室,山东省能源生物遗传资源重点实验室,山东 青岛 266101;2.中国科学院大学生命科学学院,北京 100049;3.青岛琅琊台集团股份有限公司,山东 青岛 266400;4.中国科学院青岛生物能源与过程研究所,生物燃料重点实验室,山东 青岛 266101)
目的:研究伯克霍尔德氏菌胞外脂肪酶对裂壶藻油脂中二十二碳六烯酸(docosahexaenoic acid,DHA)的富集作用。方法:用三丁酸甘油酯平板筛选法,筛选产脂肪酶的细菌;以对硝基苯月桂酸酯为底物,对筛选得到的伯克霍尔德氏菌脂肪酶的酶学性质进行研究;用该脂肪酶水解裂壶藻油脂,通过气相色谱法测定酶解后水相和有机相的脂肪酸组成来研究其对裂壶藻油脂DHA的富集作用。结果:从广州的泥土样品中分离获得一株高产胞外脂肪酶的伯克霍尔德氏菌,在产酶培养基中30 ℃、200 r/min的条件下培养40 h后,脂肪酶酶活力达到最大值70 U/mL。脂肪酶粗酶液酶活性的最适温度为45 ℃,最适pH值为8.5。该菌的脂肪酶对裂壶藻油脂中的DHA有一定的富集作用,能够使油脂中DHA占总脂肪酸的质量分数从最初的30%升高到40%。结论:筛选得到一株能够产生选择性富集DHA的脂肪酶的细菌,拓宽了可用于多不饱和脂肪酸分离纯化的脂肪酶的范围。
脂肪酶;伯克霍尔德氏菌;裂壶藻;油脂;二十二碳六烯酸富集
二十二碳六烯酸(docosahexaenoic acid,DHA)属ω-3多不饱和脂肪酸,是人体大脑和视网膜的重要组成部分[1-2]。DHA具有抗衰老、增进大脑细胞发育、改善老年痴呆等作用,并且对于癌症的治疗有明显促进作用[3],因而广泛用作婴幼儿奶粉、各种食品、饮料和保健品的添加剂,近些年来关于它的研究十分广泛[4-5]。DHA主要来源于深海鱼油和海洋微藻油[6],其中裂壶藻(Aurantiochytrium sp.)因为其脂肪酸组成相对简单,DHA含量较高等优点而越来越受到广泛的关注[7-8]。目前DHA的富集方法主要有分子蒸馏法、超临界流体萃取法、尿素包合法等[9-10],但普遍存在设备要求较高,操作成本较高,回收效率低下等缺点,而脂肪酶富集法由于具有反应条件温和、选择性高、催化活性高等优点被广泛应用于油脂的处理[11]。文献[12-14]已报道用于多不饱和脂肪酸纯化的脂肪酶主要来源于酵母和霉菌,例如皱褶假丝酵母、米黑根毛霉、白地霉等。
之所以能用脂肪酶来富集DHA,主要是因为部分脂肪酶具有独特的底物选择性[15-16]。有的脂肪酶具有甘油位置选择性,能优先水解甘油1、3位置上的饱和和单不饱和脂肪酸,从而将DHA富集到甘油三酯的2位上;有的脂肪酶对酰基碳链具有选择性,可以水解掉甘油任意位置的非ω-3多不饱和脂肪酸,从而使DHA以甘油酯形式得到富集[17-18]。不饱和脂肪酸碳链中存在碳碳双键和全顺式构型,这些结构引起了整个脂肪酸分子的弯曲,分子中靠近酯键的最末端甲基对脂肪酶的进攻形成阻碍作用,而DHA独特的6 个双键加强了这种阻碍作用,使得脂肪酶难以接触到DHA与甘油形成的酯键,而饱和和单不饱和脂肪酸不存在这种阻碍作用,很容易被水解。
Carvalho等[19]通过研究发现,用Candida cylindracea脂肪酶在35 ℃条件下催化水解巴西沙丁鱼油16 h后,能够使甘油三酯中的DHA含量增加1.2 倍;Okada等[20]分别用游离的和固定化的Candida rugosa脂肪酶水解沙丁鱼油,在经过90 min的作用后,ω-3多不饱和脂肪酸从原来的38.1%分别上升到了65.3%和64.8%,其中DHA从最初的7.2%分别上升到了15.5%和15.3%;Mbatia等[21]研究用脂肪酶法富集尼罗河鲈鱼内脏油中的多不饱和脂肪酸,在用不同来源的脂肪酶进行水解时,由于Candida rugosa脂肪酶没有位置选择性,能够水解任意甘油位置的脂肪酸,因此能够使得二十碳五烯酸(eicosapntemacnioc acid,EPA)和DHA的物质的量百分含量分别提高1 倍和1.6 倍,而Thermomyces lanuginosus脂肪酶具有1、3位置选择性,能够使DHA的物质的量百分含量提高3.2 倍。但总的来说,有关细菌来源的脂肪酶用于DHA的富集研究较少。
本实验从来自广州的泥土样品中分离得到一株高产脂肪酶的菌株,用16S rDNA法初步鉴定为伯克霍尔德氏菌(命名为Burkholderia sp. SD001)。本实验对其脂肪酶的性质做了初步研究,利用该菌株的脂肪酶粗酶液对裂壶藻油脂进行酶解发现,它对DHA有一定的富集效果,在多不饱和脂肪酸的分离纯化方面有一定的应用前景。
1 材料与方法
1.1 材料、试剂与仪器
泥土样品采于广州沿海各地,置于无菌塑料袋备用;裂壶藻SD116藻种为本实验室保藏,-80 ℃备用。
对硝基苯月桂酸酯(4-nitrophenyl laurate,p-NPL)、三丁酸甘油酯 美国Sigma公司;正己烷(色谱纯) 韩国Honeywell Burdick & Jackson公司;化学试剂无水乙醇等(分析纯) 国药集团化学试剂有限公司;pMD18-T质粒 日本TaKaRa公司。
7890 A气相色谱仪(配有450GC Solution自动进样器) 美国Agilent公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.2 方法
1.2.1 菌株的筛选
从来自广州沿海各地的泥土样品中各称取1.0 g,加入9.0 mL无菌生理盐水并混匀。取等体积悬浊液混匀后梯度稀释,涂布于筛选培养基平板,25 ℃培养48 h后,观察菌落周围的水解圈大小。水解圈与菌落圈直径比为2~4时,表示该菌产脂肪酶能力越强,挑选其中水解圈直径较大者分离纯化进行液体发酵并测定脂肪酶活力,得到脂肪酶活性最高的菌株。培养基条件参考文献[22]稍作如下改动,筛选培养基为:蛋白胨4 g/L、(NH4)2SO41.5 g/L、KH2PO42 g/L、MgSO4·7H2O 0.5 g/L、NaCl 4 g/L、琼脂20 g/L,三丁酸甘油酯乳化液(V(三丁酸甘油酯)∶V(40 g/L聚乙烯醇)= 1∶4,下同)12 mL/L,罗丹明B 1 mL/L。发酵培养基为:蛋白胨10 g/L、酵母提取物5 g/L、三丁酸甘油酯乳化液30 mL/L,NaCl 10 g/L。
1.2.2 16S rDNA的克隆与菌株鉴定
1.2.2.1 16S rDNA的克隆
基因组DNA提取按照细菌基因组DNA抽提试剂盒(生工SK8725)说明书进行。扩增引物为p27f:5′-AGAGTTTGATCCTGGCTCAG-3′和p1429r:5′-GGTTACCTTGTTACGACTT-3′。聚合酶链式反应(polymerase chain reaction,PCR)扩增程序为:94 ℃、10 min,94 ℃、30 s,55 ℃、30 s,72 ℃、1 min,30 个循环,72 ℃、5 min,4 ℃直至温度平衡结束。回收PCR产物并连接入pMD18-T质粒中,送上海桑尼测序公司测序。
1.2.2.2 分子系统发育树的构建与菌株鉴定
使用BLAST软件[23]在线分析并下载GenBank中与所得16S rDNA一致的序列。利用MEGA5软件[24]进行系统进化和遗传学分析。采用Kimura双参数模型计算遗传距离,用Neighbor-Joining法构建系统进化树,进化树各分支的置信度由Bootstrap 1 000循环检验。
1.2.3 产酶培养及酶活力的测定
1.2.3.1 脂肪酶粗酶液的制备
产酶培养基采用文献[25]中优化的配方:牛肉膏31.8 g/L、橄榄油21 mL/L、TritonX-100 36.55 mL/L、可溶性淀粉10 g/L、NaNO32 mmol/L。经30 ℃、200 r/min培养40 h后,6 800×g离心10 min后收集上清即获得脂肪酶粗酶液。
1.2.3.2 脂肪酶的纯化
脂肪酶的纯化采用双水相萃取法[26],按质量配制双水相体系(20 g)如下:异丙醇3.0 g、磷酸氢二钾3.5 g、磷酸二氢钠1.7 g、脂肪酶粗酶液11.8 g。慢慢搅拌,混合均匀后,1 700×g离心10 min使其充分分相,所得上相即为纯化所得脂肪酶。
1.2.3.3 脂肪酶酶活力的测定
脂肪酶酶活力的测定 方法参考文献[27]如下:溶液A:40 mg对硝基苯月桂酸酯溶于12 mL异丙醇;溶液B:90 mL磷酸钾缓冲液(pH 7.0,100 mmol/L)加入0.4 g TritonX-100和0.1 g阿拉伯树胶粉。
0.2 mL溶液A加入到3 mL溶液B中,振荡混匀,置于35 ℃水浴中保温5 min,然后加入0.1 mL粗酶液,对照组中加入0.1 mL无菌蒸馏水,35 ℃反应20 min,测定OD405nm。根据对硝基苯酚(p-nitrophenol,pNP)标准曲线计算pNP的量,换算成酶活力单位。一个酶活力单位(U)表示在上述条件下1 min释放1 μmol pNP所需要的酶量。
1.2.4 脂肪酶粗酶液酶学性质的研究
最适pH值及pH值稳定性:取100 μL的脂肪酶粗酶液于不同pH值(5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5)的缓冲液中测定酶活力,以确定该酶的最适作用pH值。将脂肪酶粗酶液置于不同pH值(6.0、7.0、8.0、9.0、10.0)的缓冲液中4 ℃保存12 h,测定其剩余酶活力,以保存在4 ℃的脂肪酶粗酶液酶活力为对照,确定该酶的pH值稳定性。
最适温度及温度稳定性:取100 μL的脂肪酶粗酶液在不同温度(25、30、35、40、45、50、55、60、65、70 ℃)条件下测定酶活力,以确定该酶的最适作用温度。将脂肪酶粗酶液在不同温度(35、45、55 ℃)条件下保温,每隔1 h测定剩余酶活力,以保存在4 ℃的脂肪酶粗酶液酶活力为对照,确定该酶的温度稳定性。
1.2.5 脂肪酶粗酶液对裂壶藻油脂中DHA的富集作用
裂壶藻油脂由裂壶藻(Aurantiochytrium sp. SD116)[28]发酵提取制得。
依照文献[29]设计酶解体系为油脂:缓冲液:脂肪酶粗酶液以体积比2∶3∶10混合,35 ℃、200 r/min的条件下进行酶解。其中,缓冲液为含有体积分数0.7% TritonX-100的磷酸钾缓冲液(p H 7.0,1 0 0 m m o l/L)。对照组中使用等体积缓冲液代替脂肪酶粗酶液。
每隔1 h从体系中取100 μL样品,加入1 mL乙醇和1 mL蒸馏水,然后加入0.5 mL 0.5 mol/L氢氧化钾-乙醇溶液,中和水解生成的脂肪酸,混匀后用正己烷萃取,得到未水解的脂,称为有机相;然后加入0.3 mL 2 mol/L盐酸,释放中和的脂肪酸,混匀后用正己烷萃取,得到水解生成的脂肪酸,称为水相。
1.2.6 酶解结果分析
脂肪酸组成成分的分析采用文献[30]的方法并稍加改动,具体如下:1 mL样品(氯仿溶解)、100 μL十九酸(3 mg/mL,甲醇溶解)、2.5 mL硫酸甲醇(体积分数为2%)在85 ℃水浴中反应2.5 h,然后用1 mL色谱级正己烷萃取所得脂肪酸甲酯。脂肪酸测定采用气相色谱法,条件参考文献[31],稍作改动为:采用Agilent-GC7890 A气相色谱仪,色谱柱为HP-INNOWax (30 m×250 μm,0.25 μm),载气为高纯氮,设定程序升温为100 ℃保持1 min,然后每分钟升温15 ℃至240 ℃,240 ℃保持10 min,氢离子火焰检测器(flame ionization detector,FID)温度为260 ℃。恒流控制,氮气流量为30 mL/min,氢气流量为30 mL/min,空气流量为400 mL/min。进样量为1 μL。
2 结果与分析
2.1 产脂肪酶细菌的筛选
本实验从3 份土壤样品中分离得到18 个菌落,其中具有分泌胞外脂肪酶能力的细菌3 株。从中选择分泌脂肪酶能力最强的一株进行分析。该菌在LB琼脂平板培养基上的形态如图1A所示,菌落呈黄色,圆形,表面湿润光滑,边缘整齐,不透明;在光学显微镜下的形态如图1B所示,菌体呈短杆状,菌体长度约1~1.5 μm,宽度约0.3~0.7 μm;在筛选培养基上的形态如图1C所示,该菌能够产生很明显的水解圈,水解圈与菌落圈直径比值约为3,说明该菌的胞外脂肪酶活力较强。
2.2 产酶菌株SD001的鉴定
通过PCR扩增,得到该菌的16S rDNA,经过测序之后,根据16S rDNA序列相似性比对确定该菌为伯克霍尔德氏菌属,通过MEGA5软件采用邻位相连法(Neighbor-Joining)构建系统发育树(图2),鉴定为伯克霍尔德氏菌(Burkholderia sp.),命名为Burkholderia sp. SD001,GenBank登录号为KJ725085。

图2 基于16S rDNA序列构建的系统发育树Fig.2 Neighbor-Joining phylogenetic tree resulting from analysis of the 16S rDNA sequences
2.3 脂肪酶酶学性质分析
2.3.1 Burkholderia sp. SD001的产酶时间曲线
微生物来源的脂肪酶一般都是分泌性的胞外酶,在生长曲线的对数末期酶活力较高。将该菌在产酶培养基中30 ℃、200 r/min的培养条件下培养,从产酶曲线(图3)可以看出,在40 h内,酶活力随着时间的延长而增大,到40 h时,酶活力达到最大值,约为70 U/mL。文献[32-35]中伯克霍尔德氏菌的产酶活力在1.90~540.46 U/mL之间,但不同文献使用的培养条件、酶活力测定方法和底物不尽相同。40 h后,随着培养时间的延长,发酵液中酶活力渐渐降低。这可能是因为营养成分耗尽,菌体不再外分泌脂肪酶,反而水解脂肪酶作为氮源或是已经分泌至培养液中的脂肪酶活性逐渐降低所致。
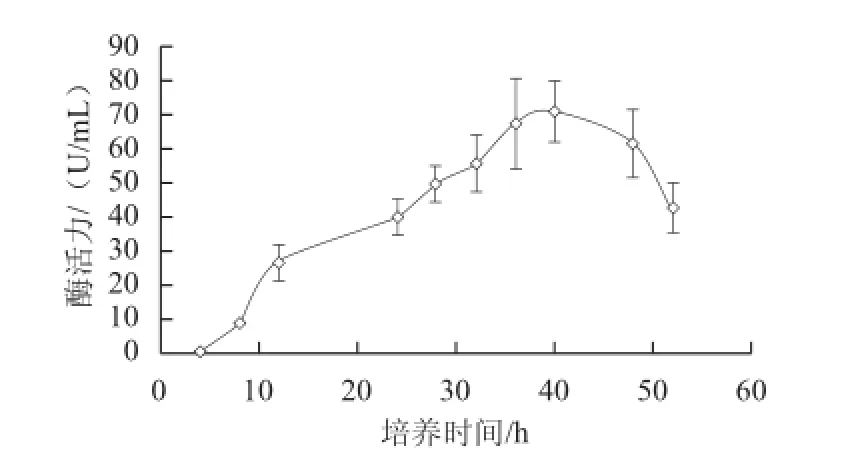
图3 3 Burkholderiaderia sp. SD001在产酶培养基中的酶活力变化Fig.3 The lipase activity of Burkholderia sp. SD001 during cultivation
2.3.2 脂肪酶的最适作用温度及热稳定性
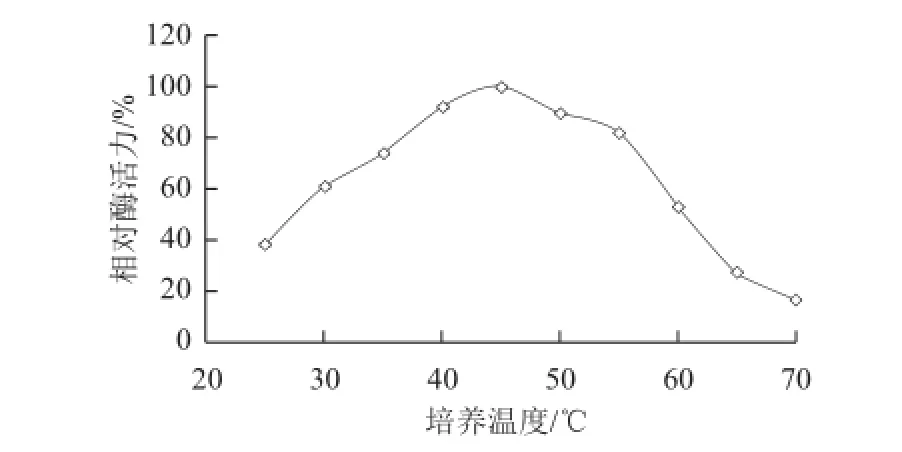
图4 温度对Burkholderiaderia sp. SD001脂肪酶粗酶活性的影响Fig.4 Effect of temperature on the activity of crude lipase from Burkholderia sp. SD001
以双水相萃取所得上相作为粗酶液,分别在25~70 ℃条件下测定酶活力,结果见图4。在温度较低时,酶活力随着温度的升高而增大,并且在45 ℃时达到最大,而在温度大于45 ℃时,酶活力随着温度的升高而降低。这表明该酶的最适作用温度为45 ℃。将酶液分别在35、45、55 ℃条件下保温,测定其热稳定性,曲线如图5所示,该酶在35 ℃条件下比较稳定,随保温时间的延长,酶活力损失很小;45 ℃条件下保温时,酶活力随保温时间延长而降低,5 h后,酶活力降为原来的50%;55 ℃条件下保温时,酶活力急剧下降,保温1 h后,酶活力已经损失超过60%,保温5 h后,酶活力基本丧失。因此酶解油脂实验所选用的温度定为35 ℃。
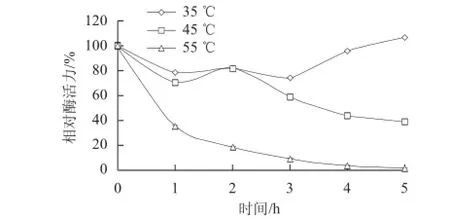
图5 温度对脂肪酶粗酶稳定性的影响Fig.5 Effect of temperature on the stability of crude lipase from Burkholderia sp. SD001
2.3.3 脂肪酶的最适作用pH值及pH值稳定性
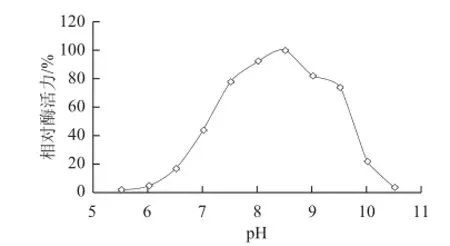
图6 pH值对Burkholddeerriiaa sp. SD001脂肪酶粗酶活性的影响Fig.6 Effect of pH on the activity of crude lipase from Burkholderia sp. SD001
以双水相萃取所得上相作为酶液,测定不同pH值条件下的酶活力,结果如图6所示。在pH值低于8.5时,酶活力随着pH值的升高而增大,pH值到8.5时达到最大值,而后随pH值升高,酶活力降低。表明该酶的最适pH值为8.5。将酶液在不同pH值缓冲液中4 ℃保存12 h后,测定剩余酶活力,对照为在4 ℃保存的酶液酶活力,结果见图7。在pH 6.0~10.0的范围内,虽然酶活力有所降低,但该酶仍能保持70%以上的酶活力。说明该酶在以上pH值范围内都能够保持稳定,考虑到裂壶藻油脂在中性pH值条件下比较稳定,因此酶解油脂实验所选用的缓冲液pH值定为7.0。
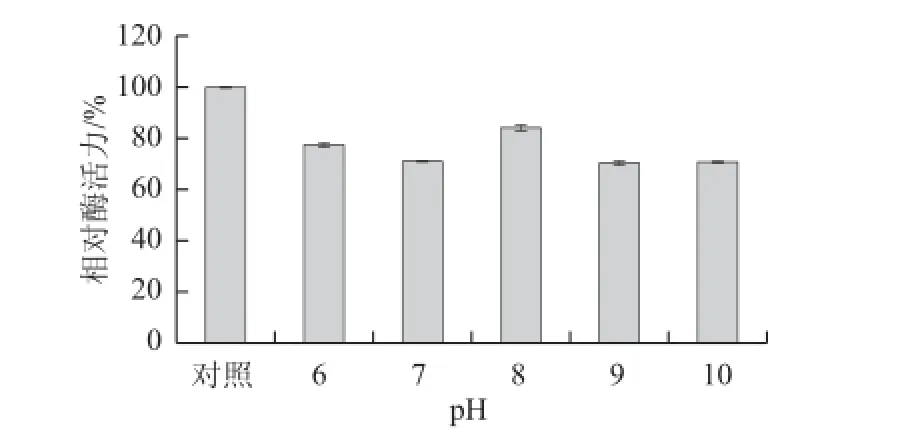
图7 pH值对脂肪酶粗酶稳定性的影响Fig.7 Effect of pH on the stability of crude lipase from Burkholderia sp. SD001
2.4 对裂壶藻油脂的DHA富集作用
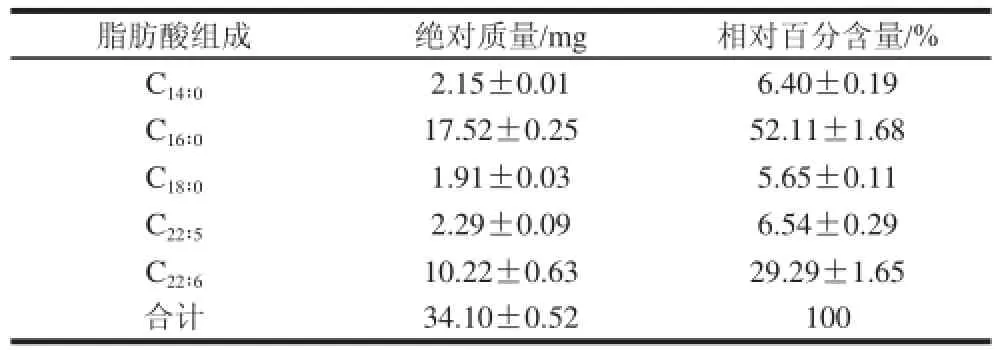
表1 裂壶藻油脂初始的主要脂肪酸组成Table 1 Initial fatty acid composition of Aurantiochyttrriiuumm sp. SD116 oil
裂壶藻油脂的主要脂肪酸组成经气相色谱(gas chromatography,GC)检测,所得结果如表1。其中,C16∶0和C22∶6的百分含量相对较高。C16∶0的相对百分含量高达52.11%,而C22∶6的相对百分含量约为29.29%。
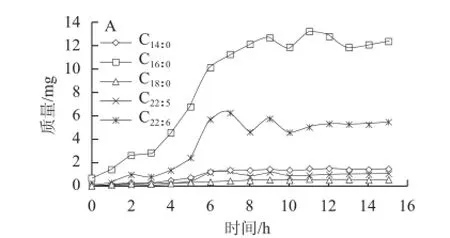

图8 经过脂肪酶粗酶液酶解后脂肪酸含量的变化Fig.8 Changes in fatty acid composition of Aurantiochytrium sp. SD116 oil after treatment with crude lipase
经过脂肪酶粗酶液水解后,用GC法对反应体系的水相和有机相脂肪酸含量进行测定,结果如图8所示,其中脂肪酸的绝对含量由内标十九酸的质量通过气相色谱峰面积计算得到。从水相和有机相脂肪酸的绝对含量变化(图8A、8B)来看,随着脂肪酶水解过程的进行,有机相中的脂肪酸逐渐减少,水相中的脂肪酸逐渐增加,到8 h后基本维持恒定,说明水解反应在此时达到了平衡状态。图8显示,裂壶藻油脂中所有的脂肪酸都不同程度的从有机相转移到了水相,其中棕榈酸(C16∶0)从有机相转移到水相的绝对量要远大于DHA(C22∶6)。从有机相脂肪酸的相对含量变化(图8C)中可以看出,棕榈酸在经过该酶水解8 h后含量从最初的50%下降到30%,而DHA含量则从最初的30%升高到了40%。这说明本实验所使用的脂肪酶相对于DHA与甘油形成的酯键来说,更多的作用于棕榈酸与甘油形成的酯键。正是脂肪酶的这种对于底物的差异性识别作用,使得裂壶藻油脂中的DHA能够以甘油酯的形式得到富集。之后随着水解过程的进行,棕榈酸的相对含量略有上升,DHA的相对含量略有下降,可能是因为经过脂肪酶水解后有机相中棕榈酸和DHA的绝对含量相当,加上水解反应达到平衡,脂肪酶对于这两种脂肪酸的差异性识别作用降低所致。在不添加酶液的对照实验中(图9),水相和有机相的脂肪酸绝对含量基本保持不变,同时由于DHA的稳定性较低,其在有机相中的质量分数有轻微的降低,这进一步证实本实验使用的伯克霍尔德氏菌脂肪酶具有一定的DHA富集效果。

图9 不添加脂肪酶的对照组裂壶藻油脂的脂肪酸含量的变化Fig.9 Changes in fatty acid composition of the control group without treatment with lipase
3 讨 论
伯克霍尔德氏菌是一种广泛存在于水、土壤和植物中的革兰氏阴性菌,伯克霍尔德氏菌脂肪酶在之前的文献报道中,其最适温度范围在30~60 ℃,最适pH值范围在9.0~10.0,属碱性脂肪酶[33,36]。本研究从广州的泥土样品中所筛选得到的脂肪酶最适温度为45 ℃,最适pH值为8.5,是一种典型的伯克霍尔德氏菌脂肪酶。脂肪酶催化天然底物油脂水解,其发挥水解作用活性是在油水界面上[37]。因此,为了能够使脂肪酶最大限度的发挥水解作用,水解实验的缓冲液中加了体积分数0.7%的表面活性剂Triton X-100,构成乳化体系。由于乳化体系的不均一性,不同时间点所取样品的体积会存在一定的误差,结果造成了图8中水解曲线的波动,但对脂肪酸总体的变化趋势影响不大。
在用该脂肪酶水解裂壶藻油脂的实验中发现,如果单纯看有机相中脂肪酸相对含量的变化,DHA在有机相中的质量分数在经过8 h脂肪酶的水解作用后从最初的30%升高到了40%,有一定的效果。但是如果结合有机相中DHA的绝对含量的变化情况,则发现在经过酶解8 h后,有机相样品中DHA的含量从最初的10.44 mg下降到5.0 mg,损失了约50%。因此,该酶对裂壶藻油脂DHA的富集作用比较有限,有待进一步改善。在有关用酵母或霉菌脂肪酶富集DHA的文献中,有结果显示来自于Candida rugosa的脂肪酶对于ω-3多不饱和脂肪酸的富集效果最明显,能够使其相对含量上升20%~30%[38]。本实验所筛选的脂肪酶来源于细菌,因其生长速率较快,在降低脂肪酶的成本方面有一定的实用价值,但其选择性有待通过水解条件优化或蛋白质工程手段进一步提高。
除了利用脂肪酶对油脂的水解反应来富集DHA,还有利用脂肪酶的特殊催化性能比如酯化、转酯化等进行DHA富集的报道[39]。另外,脂肪酶法与其他的物理化学方法相结合能够进一步提高DHA的富集效果,文献[40]中也已经有关于这方面的研究。因此,DHA的富集可以结合脂肪酶的多种催化性能和其他物理化学方法,最终实现高效低成本的工业应用。
4 结 论
本实验从来自广州的泥土样品中分离得到一株高产脂肪酶的伯克霍尔德氏菌,命名为Burkholderia sp. SD001。对其脂肪酶粗酶液进行研究发现,该酶的最适作用温度为45 ℃,最适作用pH值为8.5,在短链醇酮类有机溶剂中有较好的耐受性。通过该酶对裂壶藻油脂的水解实验发现,该酶可以将油脂中的DHA从最初的30%提高到40%,对DHA有一定的富集效果。本研究表明细菌脂肪酶也可用于富集油脂中的DHA,拓宽了可用于多不饱和脂肪酸分离纯化的脂肪酶的范围。
[1] CARLSON S J, FALLON E M, KALISH B T, et al. The role of the omega-3 fatty acid DHA in the human life cycle[J]. Journal of Parenteral and Enteral Nutrition, 2013, 37(1): 15-22.
[2] LORENTE-CEBRI N S, COSTA A V, NAVAS-CARRETERO S, et al. Role of omega-3 fatty acids in obesity, metabolic syndrome, and cardiovascular diseases: a review of the evidence[J]. Journal of Physiology and Biochemistry, 2013, 69(3): 633-651.
[3] SIDDIQUI R A, HARVEY K A, WALKER C, et al. Characterization of synergistic anti-cancer effects of docosahexaenoic acid and curcumin on DMBA-induced mammary tumorigenesis in mice[J]. BMC Cancer, 2013, 13: 418.
[4] RUSSELL F D, BURGIN-MAUNDER C S. Distinguishing health benefits of eicosapentaenoic and docosahexaenoic acids[J]. Marine Drugs, 2012, 10(11): 2535-2559.
[5] TAI E K K, WANG Xiaobo, CHEN Zhenyu. An update on adding docosahexaenoic acid (DHA) and arachidonic acid (AA) to baby formula[J]. Food & Function, 2013, 4(12): 1767-1775.
[6] WARD O P, SINGH A. Omega-3/6 fatty acids: alternative sources of production[J]. Process Biochemistry, 2005, 40(12): 3627-3652.
[7] QU Liang, REN Lujing, HUANG He. Scale-up of docosahexaenoic acid production in fed-batch fermentation by Schizochytrium sp. based on volumetric oxygen-transfer coeffi cient[J]. Biochemical Engineering Journal, 2013, 77: 82-87.
[8] QU Liang, REN Lujing, SUN Guannan, et al. Batch, fed-batch and repeated fed-batch fermentation processes of the marine thraustochytrid Schizochytrium sp. for producing docosahexaenoic acid[J]. Bioprocess and Biosystems Engineering, 2013, 36(12): 1905-1912.
[9] 林文, 田龙, 王志祥, 等. 尿素包合法联合分子蒸馏技术提纯乙酯化鱼油中EPA及DHA的工艺研究[J]. 中国粮油学报, 2012, 27(12): 84-88; 92.
[10] RUBIO-R ODRIGUEZ N, BELTRAN S, JAIME I, et al. Production of omega-3 polyunsaturated fatty acid concentrates: a review[J]. Innovative Food Science & Emerging Technologies, 2010, 11(1): 1-1 2.
[11] MCNEILL G, ACKMAN R, MOORE S. Lipase-catalyzed enrichment of long-chain polyunsaturated fatty acids[J]. Journal of the American Oil Chemists’ Society, 1996, 73(11): 1403-1407.
[12] KAHVECI D, FALKEBORG M, GREGERSEN S, et al. Upgradi ng of farmed salmon oil through lipase-catalyzed hydrolysis[J]. Open Biotechnology Journal, 2010, 4: 47-55.
[13] KAHVECI D, XU X. Repeated hydrolysis process is effective for enrichment of omega 3 polyunsaturated fatty acids in salmon oil by Candida rugosa lipase[J]. Food Chemistry, 2011, 129(4): 1552-1558.
[14] SHIMADA Y, MARUYAMA K, OKAZAKI S, et al. Enrichment of p olyunsaturated fatty acids with Geotrichum candidum lipase[J]. Journal of the American Oil Chemists’ Society, 1994, 71(9): 951-954.
[15] MURALIDHAR R V, CHIRUMAMILLA R R, MARC HANT R, et al. Understanding lipase stereoselectivity[J]. World Journal of Microbiology and Biotechnology, 2002, 18(2): 81-97.
[16] DODSON G, WLODAWER A. Catalytic triads and their relatives[J]. Trends in Biochemical Sciences, 1998, 23(9): 347-352.
[17] LEE J E, CHANG Y H, GANESAN P, et al. Concentration of n-3 polyunsaturated fatty acids in cholesterol-reduc ed cod-liver oil by lipases[J]. International Journal of Food Science and Technology, 2011, 46(7): 1462-1468.
[18] YAN H, NORITOMI H, NAGAHAMA K. Concentration of docosahexaenoic acid in glyceride by hydrolysis of tuna oil with Candida rugosa lipase[J]. Kagaku Kogaku Ronbunshu, 2002, 28(1): 31-35.
[19] CARVALHO P D, CAMPOS P R B, NOFFS M D, et al. Enzymatic hydrolysis of salmon oil by nativ e lipases: optimization of process parameters[J]. Journal of the Brazilian Chemical Society, 2009, 20(1): 117-124.
[20] OKADA T, MORRISSEY M T. Production of n-3 polyunsaturated fatty acid concen trate from sardine oil by immobilized Candida rugosa lipase[J]. Journal of Food Science, 2008, 73(3): C146-C150.
[21] MBATIA B, ADLERCREUTZ P, MULAA F, et al. Enzymatic enrichment of omega-3 polyunsaturated fatty acids in Nile perch (Lates niloticus) viscera oil[J]. European Journal of Lipid Science and Technology, 2010, 112(9): 977-984.
[22] MA Qiongli, SUN Xuepiao, GONG Shufeng, et al. Screening and identifi cation of a highly lipolytic bacterial strain from barbecue sites in Hainan and characterization of its lipase[J]. Annals of Microbiolo gy, 2010, 60(3): 429-437.
[23] ALTSCHUL S F, GISH W, MILLER W, et al. Basic local alignment search tool[J]. Journal of Molecular Biology, 1990, 215(3): 403-410.
[24] TAMURA K, PETERSON D, PETERSO N N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolu tion, 2011, 28(10): 2731-2739.
[25] 苑博华, 蔡宇杰, 廖祥儒, 等. 响应面法优化Burkholderia sp. SYBC LIP-Y发酵产低温脂肪酶条件的研究[J]. 工业微生物, 2011, 41(4): 21-25.
[26] OOI C W, TEY B T, HII S L, et al. Direct purifi cation of Burkholderia pseudomallei lipase from fermentation broth using aqueous two-phase systems[J]. Biotechnology and Bioprocess Engineering, 2009, 14(6): 81 1-818.
[27] 李蓓, 李晓晖, 衣杰荣. 对硝基苯酚法对雅致放射毛霉脂肪酶特性的研究[J]. 食品工业科技, 2011, 32(11): 220-222; 263.
[28] GAO Mang, SONG Xiaojin, FENG Yingang, et al. Isolation and characterization of Aurantiochytrium species: high docosahexaenoic acid (DHA) production by the newly isolated microalga, Aurantiochytrium sp. SD116[J]. Journal of Oleo Science, 2013, 62(3): 143-151.
[29] GÁMEZ-MEZA N, NORIEGA-RODRÍ́GUEZ J A, MED INAJUÁREZ L A, et al. Concentration of eicosapentaenoic acid and docosahexaenoic acid from fish oil by hydrolysis and urea complexation[J]. Food Research International, 2003, 36(7): 721-727.
[ 30] DODDS E, MCCOY M, REA L, et al. Gas chromatographic quantifi cation of fatty acid methyl esters: fl ame ionization detection vs. electron impact mass spectrometry[J]. Lipids, 2005, 40(4): 419-428.
[31] AKANBI T O, ADCOCK J L, BARROW C J. Selective concentration of EPA and DHA using Thermomyces lanuginosus lipase is due to fatty acid selectivity and not regioselectivity[J]. Food Chemistry, 2013, 138(1): 615-620.
[32] CHAIYASO T, SEESURIYACHAN P, ZIMMERMANN W, et al. Purification and characterization of lipase from newly isolated Burkholderia multivorans PSU-AH130 and its application for b iodiesel production[J]. Annals of Microbiology, 2012, 62(4): 1615-1624.
[33] WEI Hanning, SHI Lingling, WU Bo. Production and characteristics of an enantioselective lipase from Burkholderia sp. GXU56[J]. Chemical Engineering & Technolo gy, 2008, 31(2): 258-264.
[34] LAU H L, ARIFF A, WOO K K, et al. Production and optimization of alkalostable lipase by alkalophilic Bur kholderia cenocepacia ST8[J]. African Journal of Biotechnology, 2011, 10(36): 7002-7009.
[35] LO C F, YU C Y, KUAN I C, et al. Optimization of lipase production by Burkholderia sp. using response surface methodology[J]. International Journal of Molecular Sciences, 2012, 13(11): 14889-14897.
[36] DALAL S, SINGH P K, RAGHAVA S, et al. P urification and properties of the alkaline lipase from Burkholderia cepacia ATCC 25609[J]. Biotechnology and Applied Biochemistry, 2008, 51: 23-31.
[37] REIS P, HOLMBERG K, WATZKE H, et al. Lipases at interfaces: a review[J]. Advances in Colloid and Interface Scie nce, 2009, 147-148: 237-250.
[38] SUN T, PIGOTT G M, HERWIG R P. Lipase-assisted concentration of n-3 polyunsaturated fatty acids from viscera of farmed Atlantic salmon (Salmo salar L.)[J]. Journal of Food Science, 2002, 67(1): 130-136.
[39] JONZO M D, HIOL A, ZAGOL I, et al. Concentrates of DHA from fish oil by selective esterification of cholesterol by immobilized isoforms of lipase from Candida rugosa[J]. Enzyme and Microbial Technolog y, 2000, 27(6): 443-450.
[40] 吴彩娥, 许克勇, 李元瑞. n-3多不饱和脂肪酸富集纯化的研究进展[J].中国油脂, 2005, 30(12): 45-49.
Concentration of Docosahexaenoic Acid in Aurantiochytrium sp. Oil by Burkholderia Lipase
LAN Jun1,2, SONG Xiaojin1, TAN Yanzhen1, XU Jianchun3, CUI Qiu1,4, FENG Yingang1,*
(1. Shandong Provincial Key Laboratory of Energy Genetics, Qingdao Engineering Laboratory of Single Cell Oil, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China; 2. College of Life Sciences, University of Chinese Academy of Sciences, Beijing 100049, China; 3. Qingdao Langyatai Co. Ltd., Qingdao 266400, China; 4. Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China)
Purpose: To explore the effect Burkholderia lipase on enrichment of docosahexaenoic acid (DHA) in Aurantiochytrium sp. oil. Methods: Tributyrin plate method was used to screen a lipase-producing bacterium. Using 4-nitrophenyl laurate as substrate, the enzymatic properties of the Burkholderia lipase were studied. The lipase was used to hydrolyze Aurantiochytrium oil. To evaluate the enrichment efficiency of DHA with the lipase, the fatty acid compositions in the aqueous and the organic phase after hydrolysis were detected by gas chromatography. Results: The lipase-producing bacterium obtained from mud samples collected from Guangzhou city was identifi ed as Burkholderia sp. SD001. Its lipase activity reached the maximum value of 70 U/mL in the culture after fermentation at 30 ℃ for 40 h. The lipase had an optimal pH of 8.5 and an optimal temperature of 45 ℃. When the lipase was used to hydrolyze the oil from Aurantiochytrium sp., the percentage of DHA content in the oil was increased from 30% to 40%. Conclusions: A bacterium producing a lipase capable of enriching DHA has been obtained. The lipase from this strain with expanded applicability is useful for the enrichment of polyunsaturated fatty acid.
lipase; Burkholderia sp.; Aurantiochytrium sp.; oil; docosahexaenoic acid enrichment
Q81
A
1002-6630(2015)01-0128-07
10.7506/spkx1002-6630-201501025
2014-01-15
国家高技术研究发展计划(863计划)项目(2012AA02A707;2014AA021701);
国家自然科学基金青年科学基金项目(41306132)
兰君(1989—),男,硕士研究生,研究方向为裂殖壶菌油脂的分析与应用。E-mail:lanjun@qibebt.ac.cn
*通信作者:冯银刚(1977—),男,研究员,博士,研究方向为蛋白质结构、功能与蛋白质工程。E-mail:fengyg@qibebt.ac.cn
