糖尿病大鼠模型的建立及相关蛋白组学的实验研究
2015-12-08陈红谨刘小溪杨宇峰
陈红谨,刘小溪,连 捷,杨宇峰,石 岩
(1.山西中医学院,山西太原 030024; 2.辽宁中医药大学附属医院,辽宁沈阳110032;3.大连市骨科医院,辽宁 大连116011; 4.辽宁中医药大学,辽宁沈阳 110847)
糖尿病(diabetes mellitus,DM)是一组以慢性血糖水平增高为特征的代谢性疾病,是由于胰岛素分泌和(或)作用缺陷所引起。糖尿病是由遗传和环境因素相互作用,导致胰岛素绝对或相对分泌不足以及靶组织细胞对胰岛素敏感性降低,引起蛋白质、脂肪、水和电解质等一系列代谢紊乱综合征,主要以高血糖为标志。蛋白质组学(proteomics)是指以基因组编码的所有蛋白质为研究对象,从细胞水平及整体水平上研究蛋白质的组成及其变化规律,从而深入认识有机体的各种生理和病理[1-2]。因此,对蛋白质的研究能为深入研究疾病的本质提供更多的生命信息,并筛选出疾病的生物标志物。
1 材料与方法
1.1 实验材料
1.1.1 动物与饲料 清洁级Wistar雄性大鼠40只,体重(220±20)g,由辽宁长生生物技术有限公司提供。普通饲料:购置于沈阳市于洪区前民动物实验饲料厂。高脂饲料成分:玉米油(8%)、砂糖(6%)、蛋黄粉(5%)、胆固醇(1.5%)、猪胆盐(0.2%)、甲基硫氧嘧啶(20 g)、谷氨酸钠(味素)(1%)、基础饲料(78.3%)。基础饲料由沈阳市于洪区前民动物实验饲料厂提供并负责加工。
1.1.2 仪器与试药 超速低温离心机(Beckman公司),高效液相色谱仪(型号:RIGOL 3220,北京普源精电科技有限公司),液质联用质谱仪:四级杆-静电场轨道阱质谱仪(型号:Q-Exactive,赛默飞世尔科技有限公司),串级质谱数据分析使用Protein Pilot 3.0软件(ABI公司)。
胆固醇(分析纯AR)及猪胆盐:国药集团化学试剂有限公司,柠檬酸、柠檬酸钠(国药集团化学试剂有限公司),链脲佐菌素(STZ)(美国Sigma公司)。
1.1.3 试剂溶液的配制 柠檬酸2.1 g,柠檬酸钠2.94 g,分别用0.9%氯化钠注射液定容至100 mL,使其各自的浓度为0.1 mol/L,取上述柠檬酸溶液28 mL,柠檬酸钠溶液22 mL(亦可保持此比例多配点),充分混匀,4℃冰箱保存备用。
1.2 实验方法
1.2.1 分组与造模 适应性喂养1 w后按体重随机分成正常组和模型组,每组10只。模型组予高糖高脂饲料喂养,自由饮水;禁食12 h,将链脲佐菌素(STZ)临用时溶于“1.1.3项下”配制的溶液,采取少量多次腹腔注射的方法,首次注射剂量为30 mg/kg,以后每周每次注射剂量为10 mg/kg。喂养期间每2 w测1次血糖(取尾部静脉血),当血糖≥16.7 mmol/L作为糖尿病大鼠造模成功。造模结束后有12只大鼠血糖≥16.7 mmol/L,死亡0只,造模的成功率为80%,造模时间为10 w。
1.2.2 检测指标与方法
1.2.2.1 标本采集 造模成功后,正常组及模型组各取大鼠8只,标本采集前禁食12 h,10%水合氯醛(350 mg/kg)腹腔注射麻醉;腹正中开口,经腹主动脉穿刺采血,每个样本都分两部分,一部分用于检测血糖,一部分静置后,3 000 r/min离心10 min,取上清液于小离心管中,即刻放置于干冰中,寄往北京蛋白质组学研究中心进行蛋白质组学检测分析。
1.2.2.2 iTRAQ标记 去高丰度蛋白:将每个血清样本取等体积原液,各组混合后用去高丰度试剂盒去除高丰度蛋白,溶解,定量。样本中加入dissolution buffer,溶解蛋白并bradford定量。酶切标记:将样本分别取100 μg进行酶切标记,模型组样本用116标记,空白对照组样本用117标记,标记后样本合并。
1.2.2.3 肽段分离 色谱柱:C18反相柱(Agela,C18色谱柱,250 mm×4.6 mm,填料颗粒直径 5 μm)。流动相:A:2%ACN-98%H2O(氨水调 pH=10.0);流动相B:98%ACN-2%H2O(氨水调pH=10.0);溶剂梯度:5%~8%B,1 min;8%~32%B,24 min;32%~95%B,2 min;95%A,4 min;95%~5%B,1 min;柱温 45 ℃;流速0.7 mL/min;检测波长214 nm。
组分收集:1管/min,在8%~32%有效梯度内,共24组分。分为24个馏分,真空干燥。
1.2.2.4 质谱分析 将24个馏分用A液复溶后合并为8个样本,上液质联用质谱仪(Q-Exactive)。LC-MS质谱上样:QE参数设置取抽干的样本,溶解于 A 液(1.9%ACN:98%H2O:0.1%FA),12 000 r/min离心3 min,取上清,采EASY-nLC-1000液相与ThermoFisher的Q Exactive质谱仪检测。
1.2.2.5 搜库与分析 采用Proteome Discoverer 1.2软件进行搜库,搜索引擎为内置的mascot,数据库为Rattus库,并进行分析。
2 结 果
2.1 造模前的基线情况
结果见表1。
表1 造模前的基线情况 (s)

表1 造模前的基线情况 (s)
n组别 空腹血糖(mmol/L)体重(g)正常组 10 4.90±0.64 218.8±19.2模型组 15 5.12±0.48 220.5±16.8
由表1可见,模型组与正常组在实验开始时血糖、体重方面比较差异均无统计学意义(P>0.05),基线水平齐。
2.2 造模期间血糖的变化
结果见表2。
表2 造模期间血糖的变化 (mmol/L,s)

表2 造模期间血糖的变化 (mmol/L,s)
注:与正常组相应时间段比较,1)P<0.05,2)P<0.01
组别 第2周 第4周 第6周 第8周 第10周正常组 5.11±0.49 5.08±0.50 4.70±0.56 4.87±0.54 5.09±0.38模型组 6.13±0.771) 8.64±0.522) 12.49±1.072) 15.72±1.362) 21.32±3.412)
由表2可以看出,第2周开始,模型组血糖相应时间段较正常组显著升高(P<0.05);第10周时,模型组大鼠的血糖基本达到了糖尿病模型的标准,即血糖值≥16.7 mmol/L。
根据糖尿病大鼠模型评估标准,1只大鼠血糖水平未达到标准,另外2只大鼠血糖值为过高。为了减少不利因素对实验的影响,使实验结果更能反映客观情况,将这3只大鼠予以剔除,其余大鼠均符合成模标准,成模大鼠共12只,成模率为80%。
2.3 蛋白组学的变化
差异有统计学意义的蛋白见表3、表4,部分差异蛋白的质谱图见图1。
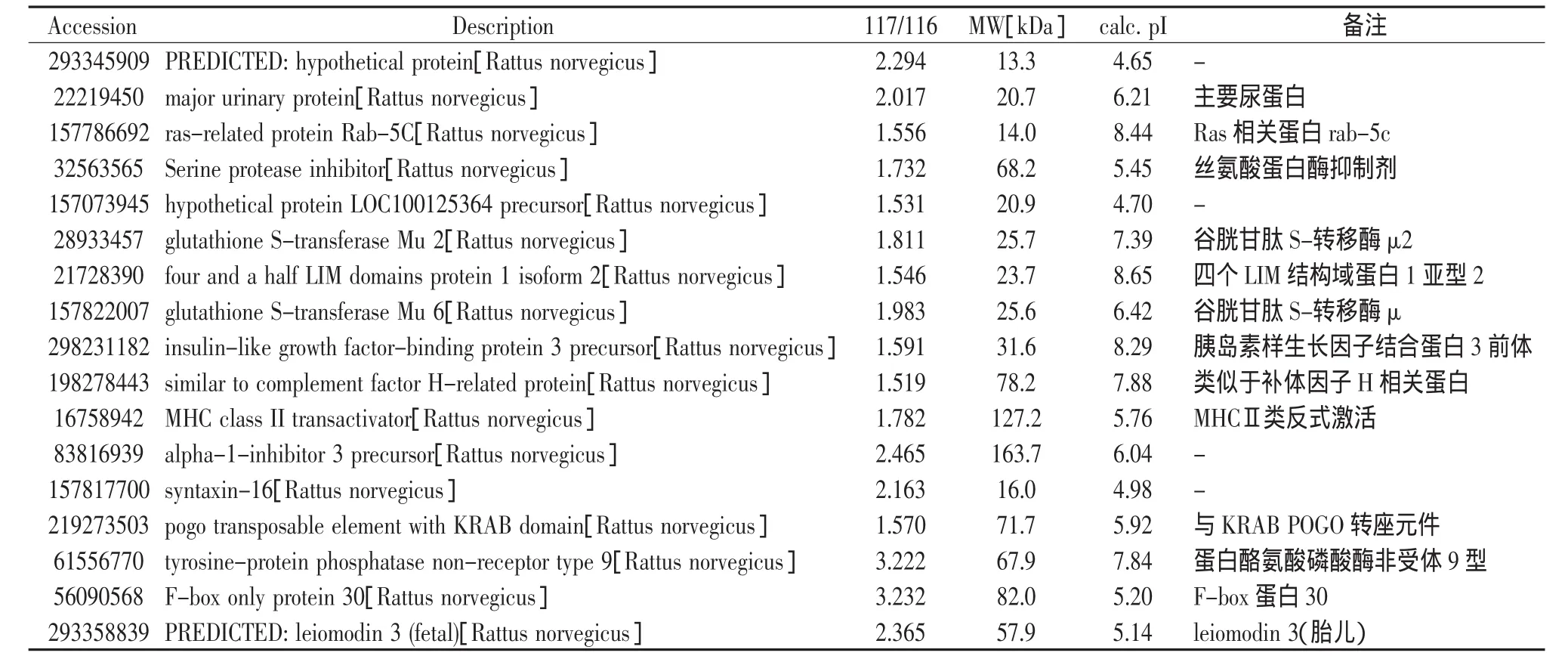
表3 上调大于1.5倍的蛋白

图1 16758942蛋白的一级质谱、一级序列匹配、二级质谱、定量及标记图
图1为16758942蛋白的Intensity[counts](106)一级质谱、一级序列匹配、二级质谱、定量及标记图。
由表3、表4可见,与正常组比较(D-E),上调大于1.5倍的蛋白有17个,下调小于0.75倍的有50个。上调的蛋白中主要有MHCⅡ反式激活因子、主要尿蛋白、LIM结构域蛋白、谷胱甘肽S-转移酶,下调的蛋白中主要有肉碱乙酰转移酶、多聚免疫球蛋白受体前体等。
3 讨论
糖尿病是目前继肿瘤、心脑血管疾病之后的第三位威胁人类健康的重大非传染性疾病,根据国际糖尿病联盟(IDF)估计糖尿病的患病人数将从2007年的2.4亿增加至2025年的3.8亿[3]。随着我国经济发展、生活水平的提高以及人口的老龄化,糖尿病的患病率逐年增长。糖尿病已经成为一个严重的公共健康问题,因此,对糖尿病的研究具有重要的学术和临床意义。
传统的糖尿病大鼠模型建立方法,一般都是采用一次性大剂量注射链脲佐菌素(STZ>60 mg/kg)诱导急性糖尿病的发生,这样会导致大鼠死亡率高,而且,大剂量的STZ短时间内迅速破坏B细胞,这与发生在自身免疫性胰岛素炎基础上的糖尿病在病程及发病机制方面存在较大差异,即免疫系统的变化因素参与糖尿病发生的机制不能被所建立的模型得以复制。本研究者认为,采用小剂量、多次注射STZ的方法,可以使B细胞逐渐少量地被破坏,这与糖尿病发生的机制及病程更接近,研究结果更能反映疾病的本质。

表4 下调小于0.75倍的蛋白
目前,国内关于从血清蛋白组学的角度研究糖尿病的发生发展的病理生理及其生物学机理的文献比较少。本研究运用蛋白组学技术研究糖尿病大鼠模型,共获得67个有统计学意义的差异蛋白。其中,MHCⅡ类分子反式激活蛋白(CⅡTA,classⅡtransactivator)是近些年来国际免疫学研究的热点之一,对CⅡTA作用机制取得了重大突破。CⅡTA及其突变体在免疫调节和免疫治疗中具有作用。CⅡTA是决定MHCⅡ类基因表达的关键成分,CⅡTA在MHCⅡ类分子的活化过程中所起的作用,有人将CⅡTA称为MHCⅡ类分子表达的“ 限速因子(limiting factor)”[4]。在 IFN-γ 诱导 MHC Ⅱ类分子表达的过程当中,IFN-γ先诱导CⅡTA表达,进而由CⅡTA激活MHCⅡ类分子基因。在MHCⅡ类分子阴性的细胞中转染入CⅡTA,能使之表达MHCⅡ类分子。有研究发现,CⅡTA并不直接结合DNA,而是通过作用于几种与之相结合的反式作用蛋白,进而调控MHCⅡ类基因的转录。此外,CⅡTA在T细胞分化中也起着一定作用。MUPs蛋白中的一个亚型—MUP-1与糖脂代谢调节关系密切。2007 年,Tilton R G 等[5]对糖尿病小鼠的肾皮质进行蛋白组学分析,并发现MUP-1、MUP-2、MUP-6、MUP-11在糖尿病肾皮质中表达均有显著差异。以MUP-1为代表的MUPs不仅与高血糖和胰岛素水平相关,还与胰岛素抵抗密切相关,MUPs的异常表达和分泌有可能参与了糖尿病动物模型的病理生理过程,具体机制尚不清楚。本研究中发现的LIM蛋白是一族数目庞大、功能繁多的蛋白家族,主要参与细胞的转录、凋亡、分化以及细胞骨架的组成等。目前LIM蛋白主要分为4类:LIM同源异型结构域蛋白(LHX)、单纯 LIM 结构域蛋白(LMO)、LIM 激酶以及其他LIM蛋白。其中LIM激酶1(LIMK1)也是目前唯一可使cofilin发生磷酸化的激酶。Cofilin是肌动蛋白丝的特异性解聚因子,在LIMK1作用下磷酸化和失活,从而导致肌动蛋白细胞骨架的改变。
本研究表明,糖尿病的发病机制除了胰岛素分泌异常、糖脂代谢紊乱外,免疫系统也发生了一系列的显著变化,该变化对糖尿病发生发展的生物学机理以及在临床治疗上有何重要的影响,目前该方面的研究信息比较少,有待进一步探讨和研究。
[1]刘骁勇,王世立,韩金祥.蛋白质组学技术及其在胃肠道肿瘤标志物研究中的进展[J].中华肿瘤防治杂志,2006,13(1):69-73.
[2]朱文,周清华.蛋白质组学及其在肺癌中的研究进展[J].中国肺癌杂志,2006,9(1):89-92.
[3]International Diabetes Federation.Diabetes Atlas[M].3 ed.Belgium:International Diabetes Federation,2006.
[4]Chang C H,Fontes J D,Peterlin M,et al.Class Ⅱ transactivator(CⅡTA)in sufficient for the inducible expression of major histocompatibility complex class Ⅱ genes[J].J Exp Med,1994,180(4):1 367-1 374.
[5]Tilton R G,Haidacher S J,Lejeune W S,et al.Diabetes-induced changes in the renal cortical proteome assessed with two-dimensional gel electrophoresis and mass spectrometry[J].Proteomics,2007,7(10):1 729-1 742.
