白杨素抑制H1299细胞系肺癌干细胞样细胞肿瘤球形成
2015-12-07冷超韦兵莫靓龙超众冯耀光贺大璞王元星
冷超,韦兵,莫靓,龙超众,冯耀光,贺大璞,王元星
(南华大学附属第一医院心胸外科,湖南 衡阳 421001)
·论著·
白杨素抑制H1299细胞系肺癌干细胞样细胞肿瘤球形成
冷超,韦兵,莫靓,龙超众,冯耀光,贺大璞,王元星
(南华大学附属第一医院心胸外科,湖南 衡阳 421001)
目的观察白杨素是否抑制人肺癌H1299细胞系干细胞样细胞肿瘤球形成能力,并探讨其作用机制是否涉及CK2α表达和Notch1信号。方法干细胞条件培养基悬浮培养与扩增H1299细胞系球形成细胞作为肺癌干细胞样细胞。不同浓度白杨素处理,肿瘤球形成法检测H1299球形成细胞的肿瘤球形成率;Western blot分析CK2α、Notch1和CD44蛋白表达。CK2α siRNA转染探讨白杨素作用机制。结果白杨素(5、10和20μM)处理H1299球形成细胞72 h,肿瘤球形成率以浓度依赖方式降低;CK2α、Notch1和CD44蛋白表达下调。CK2α siRNA转染H1299球形成细胞导致Notch1信号抑制,并协同白杨素抑制肿瘤球形成。结论白杨素具有抑制肺癌干细胞样细胞肿瘤球形成作用,其作用机制涉及下调CK2α表达抑制Notch1信号传导。
肺癌;肺癌干细胞;白杨素;CK2α;Notch1
肿瘤干细胞理论认为肺癌是一种干细胞疾病,干细胞自我更新性质使其自我复制性生存并不断增殖和分化,干细胞自我更新的调控机制紊乱导致肿瘤发生和演进[1]。有研究显示,Notch信号参与肺发育,并有促癌作用[2]。此外,肿瘤干细胞标志物CD44被证明是Notch信号下游靶基因,受Notch信号调控[3],同时,Notch信号传导和CD44调节干细胞自我更新能力[3]。CK2α(蛋白激酶CK2催化亚基)在包括肺癌在内的许多肿瘤中过表达[4]。ZHANG等[4]最近研究证明,CK2α抑制下调Notch1信号,并随后降低人肺癌干细胞样细胞群比例。
白杨素是一种在多种植物中广泛存在的黄酮类化合物,具有抑制CK2和抗肿瘤作用[5-6]。新近的研究提供证据表明,白杨素类似物即8-溴-7-甲氧基白杨素具有逆转宫颈癌干细胞样细胞上皮-间充质转化和抑制肝癌干细胞自我更新作用[7]。本文检测白杨素是否抑制人肺癌H1299细胞系干细胞样细胞肿瘤球形成,并探讨其作用机制是否涉及CK2α、Notch1和CD44蛋白表达下调。
1 材料与方法
1.1细胞培养
人非小细胞肺癌H1299细胞系细胞购自中国科学院细胞库(中国上海市),细胞用添加10%热灭活胎牛血清,青霉素(100μg/mL)和链霉素(100μg/mL)的DMEM/F12培养基,在含5%二氧化碳CO2的37℃增湿培养箱中培养和扩增。
1.2细胞成球培养
为了获得H1299细胞系球形成细胞,用添加20 ng/mL碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(PeproTech公司)、20 ng/mL表皮生长因子(epidermal growth factor,EGF)(PeproTech公司)、5μg/mL胰岛素(Sigma-Aldrich公司)、0.4%牛血清清蛋白(BSA,Invitrogen公司)和0.02×B27添加物(Invitrogen公司)的无血清DMEM/F 12培养基接种于超低黏附6孔板悬浮培养细胞,细胞密度为105个/mL。每3天补充培养液1.0 mL。培养9 d,收集球形成细胞,分散成单细胞悬液并再悬浮于新鲜干细胞条件培养基中进行传代培养。
1.3肿瘤球形成率测定
为了测定白杨素(美国Sigma公司)对肿瘤球形成率的影响,细胞以1 000个/mL的密度接种于超低黏附24孔培养板,每孔1 mL。培养9 d,计数肿瘤
球数。肿瘤球形成率(%)=每孔肿瘤球均数/每孔接
种活细胞数(1000)×100%。
1.4siRNA转染
CK2α siRNA与对照siRNA为美国Thermo Scientific公司(Waltham,MA)产品。按照厂商的说明,使用阳离子脂质体RNAiMAX(Invitrogen,Carlsbad,CA)用50 nmol/L siRNA转染细胞。Western blot分析确证siRNA敲除效率。
1.5Western blot分析
参照文献[7]的方法,用裂解缓冲液(50 mM Tris-HCl(pH 7.4)、150 mM NaCl、0.2 mM EDTA、0.2%NP-40、10%甘油、1 M β-Me、1μg/mL抑肽酶、0.1 mM Na3VO4、0.5 mM 4NPP、0.5 mM NaF和蛋白酶抑制剂)裂解细胞。Bradford法测定蛋白含量。10%SDS-聚丙烯凝胶电泳分离蛋白并转移至聚偏氟乙烯膜(PVDF)。用含5%脱脂牛奶PBST封闭PVDF膜,抗-CK2α(Millipore公司)、抗-活化型Notch1和抗-CD44(Cell Signaling,Beverly,MA)以及抗-β-actin(Sigma公司)抗体作为一抗,在4℃、轻微震动条件下孵育PVDF膜过夜。然后,用过氧化物酶连接二抗孵育膜1 h,根据厂商说明书的操作步骤,用增强化学发光仪(Amersham Biosciences)检测信号。
1.6统计学方法
数据以均数±标准差(x±s)表示。应用SPSS 13.0 Windows软件系统(SPSS Inc,Chicago,IL)分析所有数据。Student’st-检验用于比较各组间的差异。P<0.05为差异具有统计学意义。
2 结果
2.1肺癌H1299细胞系球形成细胞具有自我更新特性
干细胞条件培养基悬浮培养法结果显示:H1299细胞系能形成非粘附性肿瘤球(图1A),称为球形成细胞。球形成细胞传代培养结果证明:分散的单个细胞能形成新肿瘤球,以第3代球细胞的肿瘤球形成率最高(图1B)。提示:H1299细胞系球形成细胞具有自我更新能力。因此,在后续试验研究中,我们以H1299细胞系第3代球形成细胞作为肺癌干细胞样细胞模型。
2.2白杨素有效减弱H1299细胞系球形成细胞自我更新能力
肿瘤球形成率检测结果证实:ChR(5、10和20μM)处理H1299细胞系第3代球形成细胞72 h,肿瘤球形成率以浓度依赖降低(图2)。说明:ChR有效减弱H1299细胞系球形成细胞自我更新能力。
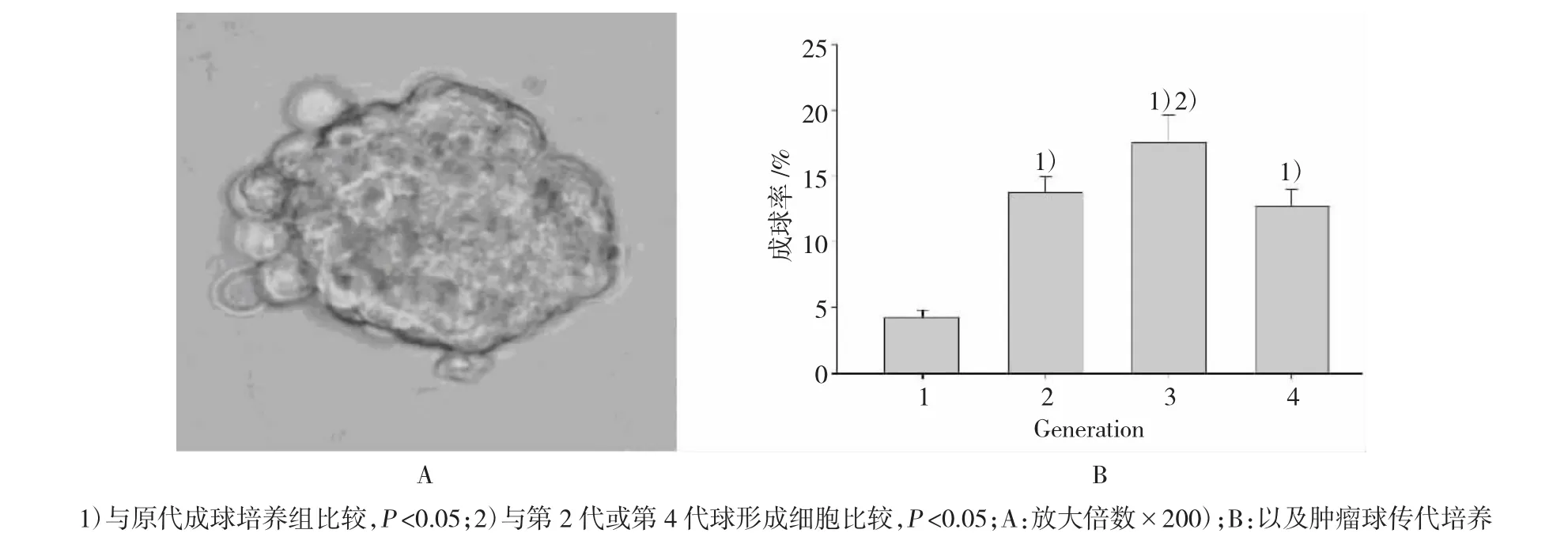
图1 人肺腺癌H1299细胞系成球培养
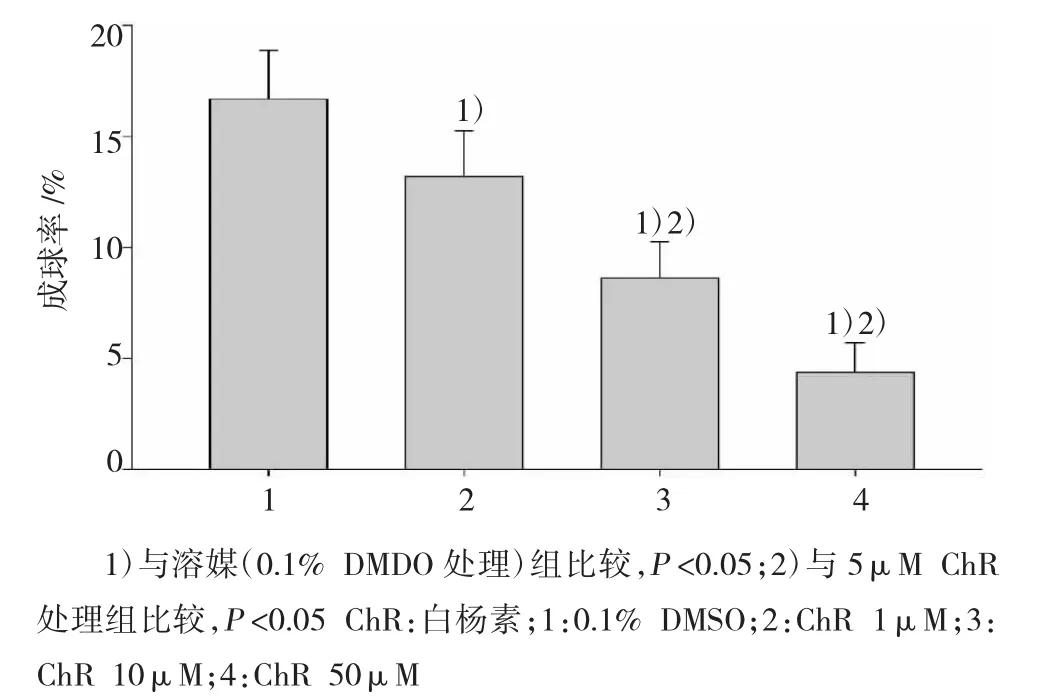
图2 白杨素对H1299细胞系球形成细胞自我更新的影响
2.3白杨素抑制H1299细胞系球形成细胞CK2α、Notch1和CD44蛋白表达
Western blot分析结果表明:ChR浓度依赖性下调H1299球形成细胞CK2α、Notch1和CD44蛋白表达(图3)。
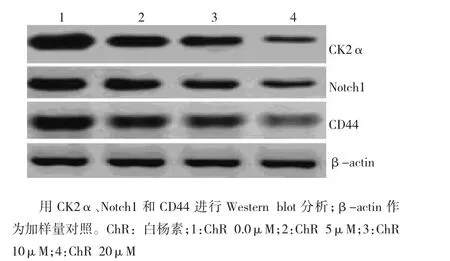
图3 白杨素对H1299球形成细胞CK2α、Notch1和CD44蛋白表达的影响
2.4CK2α沉默下调Notch1及其靶基因蛋白表达
Western blot分析结果发现:CK2α特异性siRNA转染H1299细胞系球形成细胞导致CK2α蛋白水平明显下调(图4,上泳道);Notch1和CD44蛋白水平下降(图4,中泳道和下泳道)。
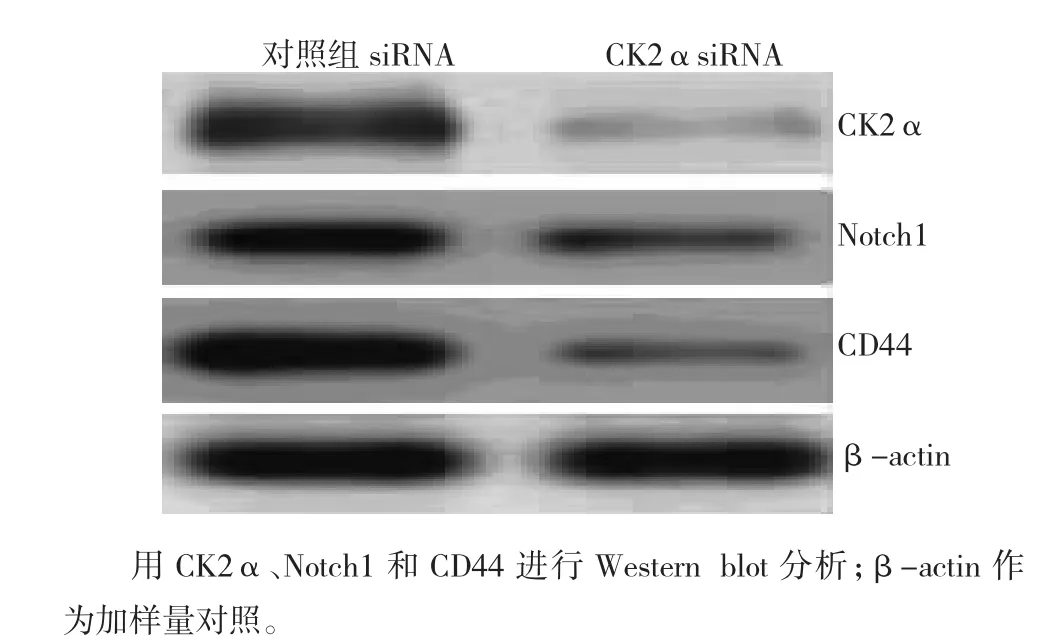
图4 CK2α siRNA转染对H1299细胞系球形成细胞CK2α、Notch1和CD44表达的影响
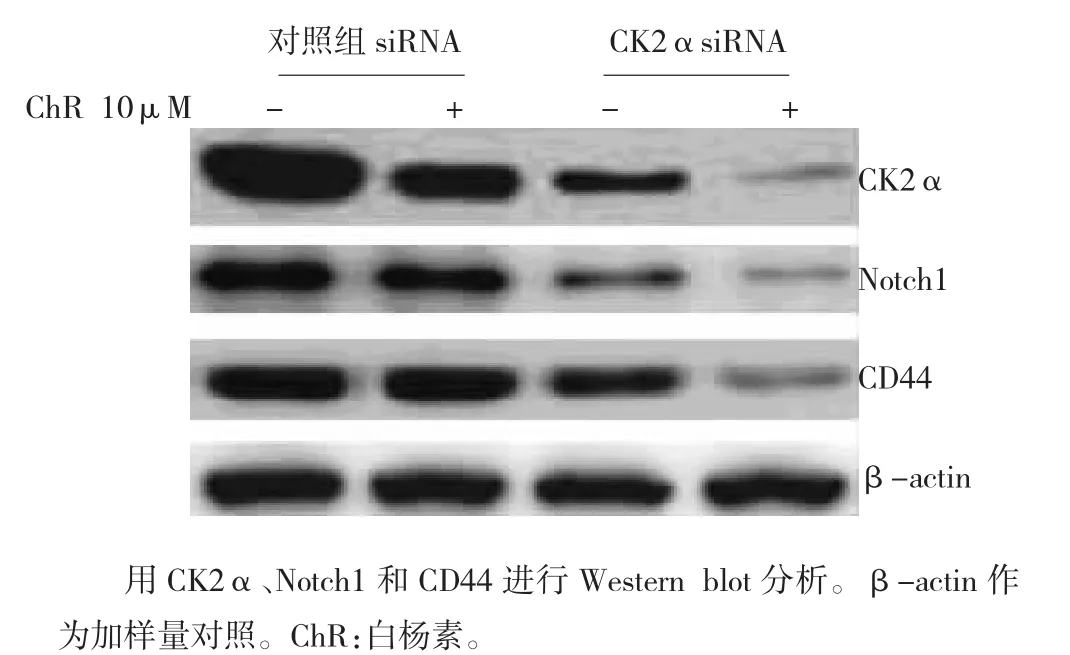
图5 CK2α siRNA转染联合白杨素处理对H1299细胞系球形成细胞CK2α、Notch1和Gli1表达的影响
2.5CK2α抑制增强白杨素抑制Notch1及其靶基因蛋白表达作用
Western blot检测发现:与对照siRNA转染细胞相比。CK2α siRNA转染与10μM ChR合用导致H1299细胞系球形成细胞CK2α、Notch1和CD44蛋白表达水平进一步下降(图5)。
2.6CK2α抑制协同白杨素降低肿瘤球形成率
肿瘤球形成法检测结果表明:CK2α siRNA转染导致H1299球形成细胞的肿瘤球形成率下降(图6),并显著增强ChR(10 μM)降低H1299球形成细胞肿瘤球形成率作用(图6)。

图6 CK2α siRNA转染联合白杨素处理对H1299球形成细胞自我更新的影响
3 讨论
本文的实验结果显示:在人肺癌H1299细胞系球形成细胞,多功能蛋白激酶CK2为Notch1信号正性调节因子。其证据包括:首先,CK2α siRNA转染抑制CK2α导致Notch1蛋白水平下降。其次,CK2α敲除引起Notch1信号靶基因(CD44)产物表达下调。第三,CK2α敲除导致人肺癌H1299细胞系球形成细胞的肿瘤球形成率降低。
已有研究报道称Notch1能被CK2在丝氨酸1901处磷酸化并且这种磷酸化负性调节Notch1转录活性[8]。CK2磷酸化Notch1第2个丝氨酸位点(S847)有可能增强Notch1蛋白稳定性[8]。ZHANG等[4]通过CK2α siRNA处理后的蛋白降解试验证明,CK2α沉默缩短A549细胞Notch1蛋白半衰期;说明这种CK2对Notch1的正性调节作用部分归因于减少蛋白降解。然而,CK2正性调节Notch1信号精确分子机制尚待深入研究。
已有研究报道,在非小细胞肺癌H1299细胞系,球形成细胞富集表达CD44干细胞样细胞[9]。本文的研究结果亦证实,H1299球形成细胞具有自我更新特性,并高表达干细胞标志物CD44蛋白。特别值得注意的是,来源丰富的黄酮类化合物白杨素显著抑制H1299细胞系球形成细胞自我更新能力,并与CK2α siRNA转染协同性下调CK2α、Notch1和CD44蛋白表达。这些结果为应用小分子CK2α抑制剂调控Notch信号靶向抑制肺癌干细胞样细胞特性治疗人非小细胞肺癌提供了合理性解释。
[1]LUANPITPONG S,WANG L,CASTRANOVA V,et al.Induction of stem-like cells with malignant properties by chronic exposure of human lung epithelial cells to single-walled carbon nanotubes [J].Part Fibre Toxicol,2014(11):22.
[2]ELIASZ S,LIANG S,CHEN Y,et al.Notch-1 stimulates survival of lung adenocarcinoma cells during hypoxia by activating the IGF-1R pathway[J].Oncogene,2010,29(17):2488-2498.
[3]YABUUCHI S,PAI SG,CAMPBELL NR,et al.Notch signaling pathwaytargetedtherapysuppressestumorprogressionand metastatic spread in pancreatic cancer[J].Cancer Lett,2013,335 (1):41-51.
[4]ZHANG S,LONG H,YANG YL,et al.Inhibition of CK2α down-regulates Notch1 signalling in lung cancer cells[J].J Cell Mol Med,2013,17(7):854-882.
[5]LI C,LIU X,LIN X,et al.Structure-activity relationship of 7 flavonoids on recombinant human protein kinase CK2 holoenzyme [J].Journal of Central South University(Medical Sciences),2009, 34(1):20-26.
[6]QUAN MF,XIAO LH,LIU ZH,et al.8-bromo-7-methoxychrysin inhibits properties of liver cancer stem cells via downregulation of β-catenin[J].World J Gastroenterol,2013,19(43): 7680-7695.
[7]曹晓正,杨小红,曹建国,等.8-溴-7-甲氧基白杨素逆转人宫颈癌SiHa细胞系球形成细胞上皮-间叶样表型转化[J].中国药理学通报,2014,30(5):668-671.
[8]VENUGOPALAN SR,LI X,AMEN MA,et al.Hierarchical interactions of homeodomain and forkhead transcription factors in regulating odontogenic gene expression[J].J Biol Chem,2011, 286(24):21372-21383.
[9]LEUNG EL,FISCUS RR,TUNG JW,et al.Non-small cell lung cancer cells expressing CD44 are enriched for stem cell-like properties[J].PLoS One,2010,5(11):e14062.
(王荣兵 编辑)
Inhibitory effects of chrysin on tumor sphere formation of lung cancer stem-like cells from H1299 cell line
Chao LENG,Bing WEI,Liang MO,Chao-zhong LONG,Yao-guang FENG, Da-pu HE,Yuan-xing WANG
(Department of Thoracic Cardiovascular Surgery,the First Affiliated Hospital of University of South China,Hengyang,Hunan 421001,P.R.China)
【Objective】To investigate whether Chrysin(ChR)inhibits the capacity of tumor sphere formation in lung cancer stem cell-like cells(LCSCLCs)derived from H1299 cell line and whether the mechanism underlying this action is associated with inhibition of CK2α expression and Notch1 signaling.【Methods】Sphere-forming cells (SFCs)from H1299 cell line which were suspended cultured with stem cell-conditioned medium were taken as LCSCLCs.H1299 SFCs were treated with various concentrations of ChR.Self-renewal capacity was detected by tumor sphere-forming assay.The expression of CK2α,Notch1 and CD44 was detected by Western blot analysis.The mechanism by which chrysin inhibits self-renew of H1299 SFCs was explored using CK2α siRNA transfection.【Results】After treatment with ChR(5,10 and 20 μM)for 72 h,the rate of tumor sphere-forming of H1299 SFCs was decreased in a concentration-dependent manner.CK2α siRNA transfection led to inhibition of Notch1 signal pathway in H1299 SFCs.CK2α siRNA transfection also can enhance the inhibitory effect of ChR on the capacity of tumor sphere-forming in LCSCLCs.【Conclusion】The inhibitory effect of ChR on tumor sphere-forming capacity of LCSLCs derived from H1299 cell line is associated with down-regulation of CK2α expression and inhibition of Notch1 signal pathway.
lung cancer;lung cancer stem cells;chrysin;CK2α;Notch1
R734.2
A
1005-8982(2015)25-0030-04
2015-03-16
