人骨髓间质干细胞诱导成骨分化过程中差异表达蛋白的鉴定和分析*
2015-12-07张爱霞余伟华王涛马保锋
张爱霞,余伟华,王涛,马保锋
(1.嘉应学院生命科学学院生物工程系,广东 梅州 514015;2.中山大学中山医学院干细胞与组织工程中心,广东 广州 510080)
·论著·
人骨髓间质干细胞诱导成骨分化过程中差异表达蛋白的鉴定和分析*
张爱霞1,余伟华2,王涛1,马保锋2
(1.嘉应学院生命科学学院生物工程系,广东 梅州 514015;2.中山大学中山医学院干细胞与组织工程中心,广东 广州 510080)
目的探讨人骨髓间质干细胞(hMSCs)诱导成骨分化过程中的差异表达的蛋白点,为阐明hMSCs成骨分化的分子机制提供依据。方法收集hMSCs和成骨诱导7 d的细胞全蛋白,应用双向凝胶电泳和图像分析软件进行蛋白质点的识别和检测,应用比较蛋白质组学技术找出凝胶上的差异蛋白点,应用基质辅助激光解析离子化飞行时间质谱(MALDI-TOF-MS)和生物信息学方法对差异蛋白点进行蛋白质的鉴定和分析。结果通过MALDI-TOF-MS和生物信息学方法鉴定出了52种差异蛋白质,其中13种蛋白质在成骨诱导7 d后表达明显上调,39种蛋白质在成骨诱导7 d后表达明显下调;利用Gene Ontology对这些蛋白质按生物学过程和分子功能进行了分析。结论鉴定了52种可能在hMSCs诱导成骨分化过程中发挥重要作用蛋白质,这为进一步揭示hMSCs成骨分化的分子机制提供了科学依据。
骨髓间质干细胞;成骨分化;蛋白质组学
骨髓间质干细胞(mesenchymal stem cells,MSCs)具有很强的自我更新能力和多向分化潜能[1],研究表明MSCs在骨损伤的修复中起重要作用[2]。MSCs已成为重要的组织工程种子细胞,并且MSCs的细胞增殖分裂模式使外源基因易于导入和表达。因此,成为潜在细胞替代治疗、基因治疗的靶细胞。目前对间充质干细胞的研究也越来越深入,同时取得了很多可喜的成绩。但是MSCs的成骨分化的确切机制尚未阐明。
本研究利用体外定向诱导人骨髓间质干细胞(human bone marrow mesenchymal stem cells,hMSCs)分化为成骨细胞的模型和蛋白组学技术,研究hMSCs分化为成骨细胞过程中成骨相关蛋白的表达,对于阐明MSCs分化为成骨细胞的分子机制具有重要意义,也将为临床上治疗骨质疏松、难治性骨损伤等奠定初步的实验基础。
1 材料与方法
1.1细胞与试剂
hMSCs来自中山大学中山医学院干细胞与组织工程中心,L-DMEM培养基、H-DMEM培养基均购自美国Gibco BRL公司,Vitamin C、地塞米松购自美国Sigma公司,β-甘油磷酸钠购自美国Calbiochem公司,溴酚蓝、十二烷基磺酸钠、固相pH梯度胶条(pH 3~10,线性)、蛋白质纯化试剂盒及蛋白质定量试剂盒等均购自瑞典Amersham Biosciences公司。
1.2仪器
倒置显微镜(IX71-22FL/PH,日本OLYMPUS公司),超净工作台(NU-301-630E,美国NUARIE公司),等电聚焦电泳系统(Ettan IPGphorⅡ,瑞典Amersham Biosciences公司)、垂直电泳系统(Ettan DALTsix,瑞典Amersham Biosciences公司)、扫描仪(Typhoon9400,瑞典Amersham Biosciences公司)、图像分析软件(Image MasterTM 2-D Platinum software 5.0,瑞典Amersham Biosciences公司)、全自动斑点处理工作站(Ettan Spot Handing Workstation,瑞典Amersham Biosciences公司)、基质辅助激光解析离子飞行时间质谱分析仪(Ettan MALDI-TOF Pro Mass Spectrometry,瑞典Amersham Biosciences公司)等。
1.3方法
1.3.1hMSCs体外定向诱导分化为成骨细胞及鉴定
将传代扩增后至第5代的hMSCs接种于六孔板,实验组每孔加入成骨细胞诱导液(含10-7mol/L地塞米松,10 mmol/L β-甘油磷酸钠,50μg/ml Vitamin C)2 ml;对照组每孔加入L-DMEM完全培养液,置培养箱中。碱性磷酸酶染色:取成骨细胞诱导分化第10天的细胞,4%多聚甲醛固定15 min,加入适量碱性磷酸酶染色液在室温下孵育10~20 min,显微镜下观察染色的结果。钙结节染色:取上述诱导分化第18天的细胞,加入适量的茜素红-S染色10~15 min,显微镜下观察结果。
1.3.2蛋白样品的制备、双向凝胶电泳及图像分析加入裂解液裂解hMSCs及诱导成骨分化7 d的细胞,超声波处理,20000 g,4℃离心30 min,取上清液。按蛋白质纯化试剂盒说明书方法纯化蛋白后,使用蛋白质定量试剂盒,按照说明书方法,对蛋白浓度进行定量。将蛋白样品进行第一向等电聚焦电泳后,将胶条转移至12.5%浓度的SDS-PAGE胶面上进行第二向电泳,直至胶内电泳指示剂溴酚蓝跑出凝胶下缘10 min后,对凝胶进行荧光染色。用扫描仪对荧光染色的凝胶进行扫描后,利用图像分析软件进行双向凝胶电泳(Two-dimensional gel electrophoresis,2-DE)图像分析,通过背景消减、斑点检测等,建立hMSCs和诱导成骨分化7 d的凝胶图像,选取ratio≥2.0的差异表达候选蛋白,进行质谱鉴定和生物信息学分析。
1.3.3质谱鉴定和生物信息学分析使用全自动斑点处理工作站对差异蛋白斑点自动进行切割、脱色、干燥、酶解、加入基质和质谱靶点样等一系列操作。将点好的质谱靶放入质谱仪,激光源为337 nm波长的氮气激光器,获得样品的肽质量指纹图谱。质谱数据的分析使用Profound软件检索,以MASCOT为搜索引擎在人的NCBInr和Swiss-prot数据库中进行搜索。对所鉴定出的蛋白,依据Gene Ontology的生物过程和分子功能分别对它们分类分析,并绘制成图。
2 结果
2.1hMSC成骨诱导分化过程中的形态变化及成骨诱导分化的鉴定
在铁路工程连续梁桥的施工控制中,自适应控制方法也是铁路工程连续桥梁施工控制中的重要方法之一。该方法在现阶段铁路工程连续桥梁施工中的应用是最为普遍的,主要是对计算参数进行分析,将分析后的参数结果与实际参数加以对比,了解参数偏差。在此基础上,对参数进行估计与修正,将修正和识别后的参数,应用到下阶段的实时结构分析与往复循环中。经过多个铁路工程连续桥梁的施工阶段,得到的参数取值会最大限度地趋于合理,且软件模拟计算结果也会与铁路工程连续桥梁施工的实际情况相适应。一般来说,连续桥梁的自适应控制法多应用于大跨度结构的连续桥梁施工中,且是在闭环控制方法基础上展开的。
hMSCs加入成骨诱导液后,可见部分细胞由长梭形逐渐变为多角形,体积增大。随着培养时间的延长,这种多角形细胞逐渐增多。随着成骨诱导的进行,细胞持续增殖,开始呈多层重叠生长,细胞之间界限模糊,细胞逐渐聚集形成多个散在的岛状细胞结构,此岛状细胞结构逐渐被分泌的基质所包埋,13~14 d左右出现钙结节,有明显的钙沉积。对照组加入L-DMEM完全培养液,细胞增殖良好,形态不变,不见致密的岛状细胞结构和钙化结节。见图1。
在诱导培养的第10天,进行碱性磷酸酶染色,实验组可观察碱性磷酸酶染色反应为强阳性,细胞密集区出现紫黑色颗粒,胞浆内有紫黑色的颗粒沉淀;对照组碱性磷酸酶染色阴性或弱阳性反应,见图2。在成骨细胞诱导培养2周后用茜素红-S检测钙沉积的情况,实验组镜下可见散在大量橘红色的钙结节,为茜素红与钙盐形成的橘红色的复合物,对照组结果为阴性,见图3。
2.2hMSCs及诱导成骨分化7 d的总蛋白的双向凝胶电泳及其质谱鉴定
软件分析结果显示,3张hMSCs和3张诱导成骨分化7 d的双向凝胶电泳图谱蛋白质斑点匹配率均达到75%以上,胶的重复性好,蛋白点的分子量主要集中在20~80 kD之间,等电点主要分布在pH 4.0~8.0之间,蛋白点分离良好。
筛选ratio≥2.0的差异表达候选蛋白,经过胶内酶切和多肽提取后,进行质谱鉴定,70多个蛋白质点成功的获得了肽质量指纹图谱。
2.3生物信息学分析
通过数据库搜索,共鉴定出52种差异蛋白质,其中13种蛋白质在成骨诱导7 d后表达明显上调,39种蛋白质在成骨诱导7 d后表达明显下调。附表列出了这些蛋白质的相关信息,其中后35种蛋白在相关文献中已有报道[3],从左到右依次是数据库登入号、蛋白质名称及表达情况:上调/下调(U/D)。

图1 hMSCs的体外成骨分化的细胞形态学观察(×40)
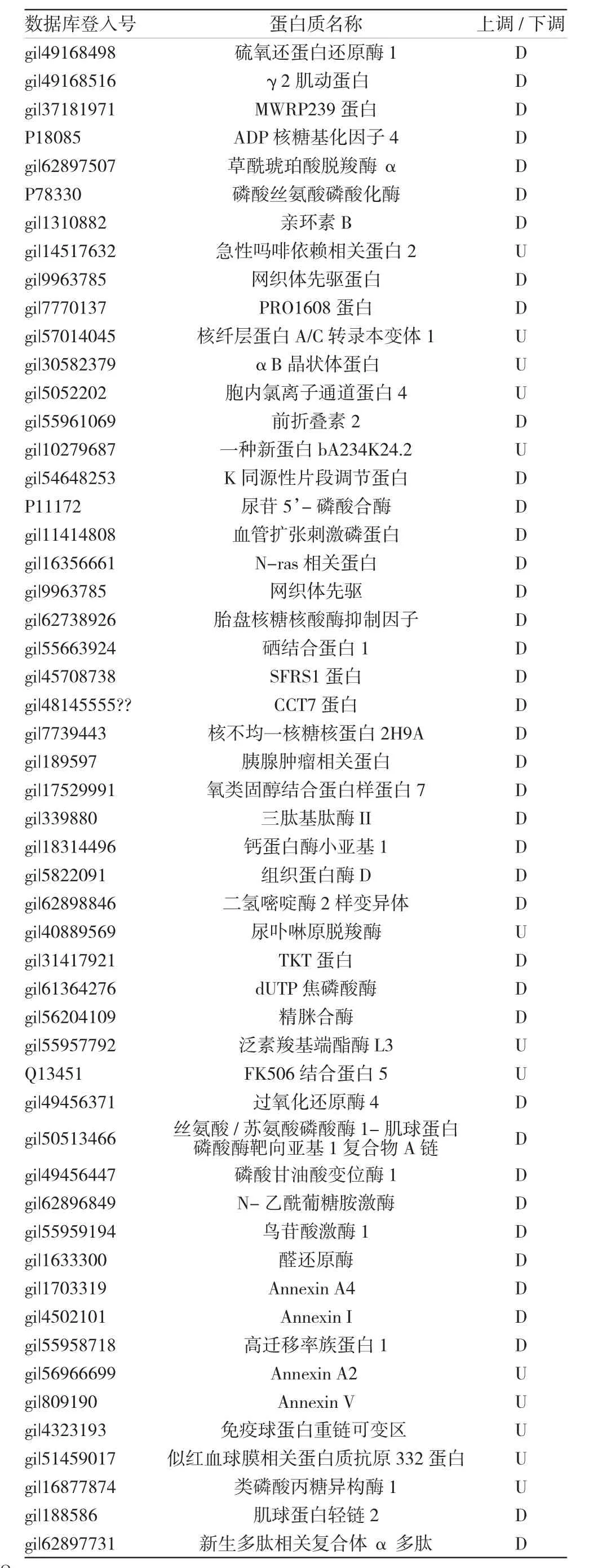
附表 52种差异蛋白的鉴定结果
按照Gene Ontology的分类方式对所有鉴定的蛋白质分类绘图,生物学过程分类中发现参与体内代谢和发育过程的蛋白质分别占37%和31%,分子功能分类中发现具有催化活性和结合功能的蛋白质分别占37%和27%,见图4。
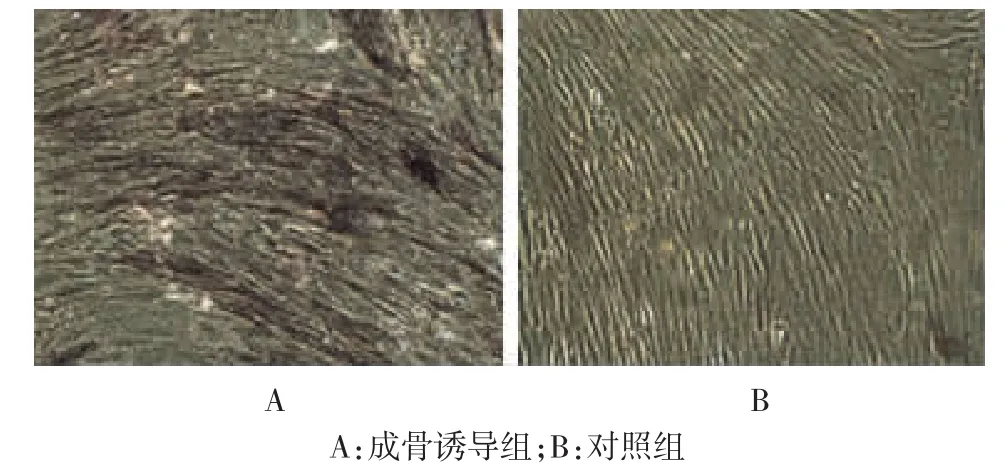
图2 hMSCs体外成骨分化的碱性磷酸酶染色(×100)
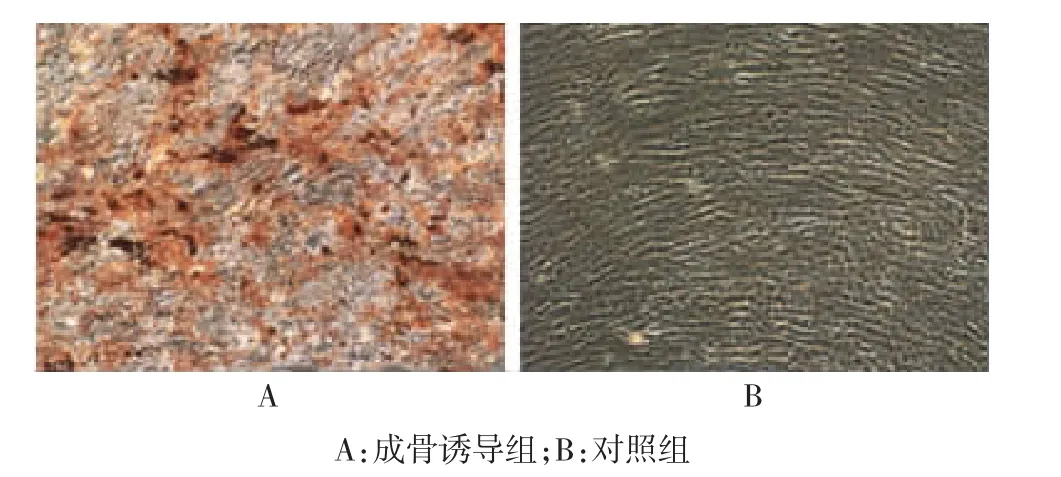
图3 hMSCs体外成骨分化的茜素红-S染色(×100)
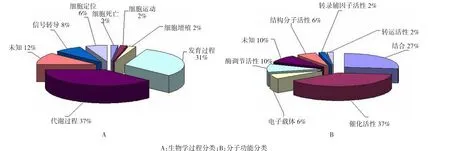
图4 按照Gene Ontology的分类方式对所有鉴定的蛋白质进行分类
3 讨论
蛋白质组学方法己被广泛应用于各种组织细胞的生理病理的分子特征的分析[4-5],本研究通过高分辨率的双向电泳技术、质谱分析以及生物信息学技术,成功的鉴定出52种差异蛋白,一些可能是在成人骨髓间质干细胞诱导成骨分化过程中起关键作用的新蛋白。
本研究鉴定出的多种蛋白中,一些是已知的与骨发育有关的蛋白,如Annexin A2和Annexin V,研究表明,Annexin A2和Annexin V对于启动成骨的矿化过程有着至关重要的作用[6]。Annexin A2与成骨必需的碱性磷酸酶位于细胞膜上的同一脂筏中,Annexin A2能增强碱性磷酸酶的活性,从而有利于成骨的矿化,如果抑制Annexin A2的表达则减弱了成骨的矿化过程[7]。GENETOS等研究发现,Annexin A2和Annexin V可通过调节成骨前体细胞的增殖、分化以及对细胞因子的反应而影响成骨过程[8]。成骨细胞表达Annexin A2,对于移植造血干细胞在骨髓微环境的黏附、归巢及迁移起到重要的调节作用[9]。研究发现,ERK信号传导通路在成骨分化过程中有重要作用[10-11],而ERK信号通路可激活Annexin A2的表达[12],可能在成骨过程中,成骨诱导剂通过ERK信号通路而作用与Annexin A2,从而使成骨过程顺利进行。
本研究鉴定的蛋白中,一些是与分化发育有关的蛋白,如胞内氯离子通道蛋白4(chloride intracellular channel protein 4,CLIC4),研究表明,CLIC4参与内皮增殖及内皮与上皮的形态建成[13-14],抑制CLIC4的表达将导致细胞的凋亡[15-16],在肌纤维母细胞的分化中,CLIC4通过p38信号通路调节此分化过程[17],而p38信号转导通路在成骨分化中发挥重要的作用[18-19],hMSCs成骨诱导分化过程中,细胞的数量也在不断增加,CLIC4可能有助于细胞增殖以及通过p38信号转导通路而调节hMSCs成骨分化的过程。另外,新生多肽相关复合体α多肽的下调表达在hMSCs成骨分化中可能起重要作用,研究表明,caspases能促进成骨分化[20],caspases的激活需要Fas相关死亡域蛋白(fas-associated with death domain protein,FADD)的参与,而新生多肽相关复合体α多肽与FADD的结合抑制了FADD的二聚体形成,从而抑制caspases的表达[21],在本试验中,新生多肽相关复合体α多肽的表达下调,可能通过调节FADD的二聚体形成、增强caspases的表达进而促进成骨分化过程。对于所鉴定出的蛋白的具体作用机制还有待于进一步的实验研究。
本研究获得了大量与成人骨髓间质干细胞诱导成骨分化相关的新信息,初步建立了hMSCs诱导成骨分化的差异表达蛋白质数据库,为进一步揭示间质干细胞诱导成骨分化的机制提供了新的思路。
[1]MUNDRA V,GERLING IC,MAHATO RI.Mesenchymal stem cell-based therapy[J].Mol Pharm,2013,10(1):77-89.
[2]KNIGHT MN,HANKENSON KD.Mesenchymal Stem Cells in Bone Regeneration[J].Adv Wound Care(New Rochelle),2013,2 (6):306-316.
[3]ZHANG AX,YU WH,MA BF,et al.Proteomic identification of differently expressed proteins responsible for osteoblast differentiation from humanmesenchymal stem cells[J].Mol Cell Biochem, 2007,304(1-2):167-179.
[4]WHITE NM,MASUI O,DESOUZA LV,et al.Quantitative proteomic analysis reveals potential diagnostic markers and pathways involved in pathogenesis of renal cell carcinoma[J].Oncotarget, 2014,5(2):506-518.
[5]BAUWENS J,MILLET C,TARAYRE C,et al.Symbiont diversity in reticulitermes santonensis(isoptera:rhinotermitidae):investigation strategy through proteomics[J].Environ Entomol,2013,42 (5):882-887.
[6]SEKRECKA A,BALCERZAK M,THOUVEREY C,et al.Annexin in mineralization process[J].Postepy Biochem,2007,53(2): 159-163.
[7]GILLETTE JM,NIELSEN-PREISS SM.The role of annexin 2 in osteoblastic mineralization[J].J Cell Sci,2004,117(Pt 3):441-449.
[8]GENETOS DC,WONG A,WEBER TJ,et al.Impaired osteoblast differentiationinannexinA2-and-A5-deficientcells[J].PLoS One,2014,9(9):e107482.
[9]JUNG Y,WANG J,SONG J,et al.Annexin II expressed by osteoblasts and endothelial cells regulates stem cell adhesion,homing,and engraftment following transplantation[J].Blood,2007,110 (1):82-90.
[10]KLEES RF,SALASZNYK RM,KINGSLEY K,et al.Laminin-5 induces osteogenic gene expression in human mesenchymal stem cells through an ERK-dependent pathway[J].MolBiolCell, 2005,16(2):881-890.
[11]ZHANG P,WU Y,JIANG Z,et al.Osteogenic response of mesenchymal stem cells to continuous mechanical strain is dependent on ERK1/2-Runx2 signaling[J].Int J Mol Med,2012, 29(6):1083-1089.
[12]GENETOS DC,WONG A,WATARI S,et al.Hypoxia increases Annexin A2 expression in osteoblastic cells via VEGF and ERK [J].Bone,2010,47(6):1013-1019.
[13]TUNG JJ,HOBERT O,BERRYMAN M,et al.Chloride intra
cellular channel 4 is involved in endothelial proliferation and
morphogenesis in vitro[J].Angiogenesis,2009,12(3):209-220. [14]CHUANG JZ,CHOU SY,SUNG CH.Chloride intracellular channel 4 is critical for the epithelial morphogenesis of RPE cells and retinal attachment[J].Mol Biol Cell,2010,21(17): 3017-3028.
[15]XU Y,KANG J,YUAN Z,et al.Suppression of CLIC4/mtCLIC enhanceshydrogenperoxide-inducedapoptosisinC6glioma cells[J].Oncol Rep,2013,29(4):1483-1491.
[16]ZHONG J,KONG X,ZHANG H,et al.Inhibition of CLIC4 enhancesautophagyandtriggersmitochondrialandER stress-induced apoptosis in human glioma U251 cells under starvation[J].PLoS One,2012,7(6):e39378.
[17]SHUKLA A,EDWARDS R,YANG Y,et al.CLIC4 regulates TGF-β-dependentmyofibroblastdifferentiationtoproducea cancer stroma[J].Oncogene,2014,33(7):842-850.
[18]ZHANG W,GUO H,JING H,et al.Lactoferrin stimulates osteoblast differentiation through PKA and p38 pathways independent of lactoferrin's receptor LRP1[J].J Bone Miner Res,2014, 29(5):1232-1243.
[19]AENLLEKK,CURTISKM,ROOSBA,etal.Hepatocyte growth factor and p38 promote osteogenic differentiation of human mesenchymal stem cells[J].Mol Endocrinol,2014,28(5): 722-730.
[20]MOGI M,TOGARI A.Activation of caspases is required for osteoblastic differentiation[J].JBiolChem,2003,278(48): 47477-47482.
[21]STILO R,LIGUORO D,DI-JESO B,et al.The alpha-chain of the nascent polypeptide-associated complex binds to and regulates FADD function[J].Biochem Biophys Res Commun,2003, 303(4):1034-1041.
(王荣兵 编辑)
Identification and analysis of differential expressed proteins in osteoblast differentiation from human bone marrow mesenchymal stem cells*
Ai-xia ZHANG1,Wei-hua YU2,Tao WANG1,Bao-feng MA2
(1.Department of Biological Engineering,College of Life Sciences,Jiaying University,Meizhou, Guangdong 514015,P.R.China;2.Center for Stem Cell and Tissue Engineering,Zhongshan School of Medicine,Sun Yat-sen University,Guangzhou,Guangdong 510080,P.R.China)
【Objective】To research human bone marrow mesenchymal stem cells(hMSCs)differentiation along osteoblasts to find the important functional proteins and elucidate the molecular mechanism in the process of differentiation into osteoblasts.【Methods】The total protein extracts were obtained with cell lysis buffer from undifferentiated hMSCs and osteogenic induced hMSCs on day 7.Using proteomic approaches based on two-dimensional gel electrophoresis(2-DE)and 2-DE gel analysis software,differently expressed protein spots were selected after being recognized and tested.The selected differently expressed protein spots were identified and analyzed by matrix-assisted laser desorption ionization-time of flight mass spectrometry(MALDI-TOF-MS)and bioinformatics.【Results】Through MALDI-TOF-MS analysis and database searching,52 proteins were identified including 13 up-regulated and 39 down-regulated in osteogenic induced hMSC for 7 days relative to undifferentiated hMSCs.The identified proteins were grouped by Gene Ontology according to biological process and molecular function.【Conclusion】The identified differential proteins that maybe play important roles in osteogenic differentiation of hMSCs provide a comprehensive reference to understand molecular mechanism of osteogenic differentiation.
human bone marrow mesenchymal stem cells;osteogenic differentiation;proteomics
R329.2
A
1005-8982(2015)25-0016-05
2014-12-20
国家自然科学基金资助项目(No:81000681;No:81000177)
