米诺环素滴眼液对小鼠干眼的疗效及机制研究
2015-12-07肖启国周静周芳李娴李洁唐罗生刘祖国
肖启国,周静,周芳,李娴,李洁,唐罗生,刘祖国
(1.南华大学附属第二医院眼科,湖南 衡阳 421001;2.中南大学湘雅二医院眼科,湖南 长沙 410011;3.厦门大学眼科研究所,福建 厦门 361102)
·论著·
米诺环素滴眼液对小鼠干眼的疗效及机制研究
肖启国1,周静1,周芳1,李娴1,李洁1,唐罗生2,刘祖国3
(1.南华大学附属第二医院眼科,湖南 衡阳 421001;2.中南大学湘雅二医院眼科,湖南 长沙 410011;3.厦门大学眼科研究所,福建 厦门 361102)
目的探讨米诺环素滴眼液对苯扎氯铵诱导的小鼠干眼的疗效及可能机制。方法BALB/c雄性小鼠50只(100眼)使用0.2%的苯扎氯铵滴眼液滴眼诱导干眼。选择严重程度相似的干眼小鼠随机分为A、B、C、D 4组,分别为0.1%米诺环素滴眼液组、0.5%米诺环素滴眼液组、溶剂组及空白组。在治疗前及治疗后第1、3及5天,行泪膜破裂时间(BUT)、角膜炎症指数、角膜上皮荧光素钠染色检查。治疗结束后摘取小鼠眼球,行HE及过碘酸-希夫染色(PAS),免疫组织化学及免疫荧光检测角膜组织角蛋白10(K10)的表达,Western blot检测角组织中白细胞介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α)的表达水平,并分析各组的差异。结果共40只小鼠(80眼)入选进行治疗实验,每组10只(20眼)。用药前各组小鼠BUT、角膜炎症指数、角膜上皮荧光素钠染色差异无统计学意义(F=0.19、0.24和0.81;P=0.902、0.869和0.493)。用药后第3天及第5天,A、B组较C、D组角膜炎症程度明显减轻(F=6.57及10.17;P=0.001和0.000),泪膜破裂时间延长(F= 5.71及5.36;P=0.003及0.004)。治疗第3天,A、B组较C、D组角膜荧光素钠染色轻(F=4.42,P=0.009)。HE染色结果显示A、B组角膜上皮细胞形态较C、D组规整。PAS染色显示A、B组杯状细胞数量多于C、D组(F =15.36,P=0.007)。免疫组织化学及免疫荧光结果均显示A、B组较C、D组K10表达减少(F=162.50,P= 0.000)。Western blot显示A、B组较C、D组IL-1β、TNF-α表达明显降低(F=6.84及11.60;P=0.006及0.001)。结论米诺环素对苯扎氯铵诱导的小鼠干眼有一定的治疗作用,其机制可能与其抑制眼表炎症及鳞状上皮化生有关。
干眼;米诺环素;小鼠;炎症;鳞状上皮化生
干眼是一种常见的泪液与眼表多因素疾病,患病率达5%~34%[1]。轻度干眼可引起眼部干涩、烧灼、疼痛、易疲劳等眼部刺激症状,若无规范治疗,进一步发展可导致角膜上皮持续损害、角膜新生血管形成及眼表鳞状上皮化生等眼表异常,从而产生视力障碍,甚至致盲[2]。
大量的研究已经证实,眼表炎症是干眼发病的关键环节,抗炎已经成为治疗干眼(尤其是中重度干眼)的重要手段[1]。目前治疗干眼常用的抗炎药物主要有皮质类固醇或环孢素A滴眼液等,然而长期使用皮质类固醇滴眼液存在诱发青光眼及白内障的潜在风险,而环孢素滴眼液则存在降低眼表免疫力及刺激性强等缺点[2-3],因此,开发新的安全有效的治疗干眼的局部抗炎药物具有重要的临床意义。
米诺环素属第二代半合成长效四环素衍生物,是一种广谱抗生素,此外,米诺环素还具有抗炎、抑制细胞凋亡、保护神经等多种特性[4-5],尤其是其抗炎特性近年来越来越受重视。目前米诺环素的抗炎作用已被用于治疗多种免疫及炎性相关疾病,如类风湿性关节炎、大疱性皮肤病、炎症性肠炎等[6-8]。在眼部也有报道米诺环素可以抑制视神经炎模型小鼠炎症基因的表达、减少白细胞粘附及趋化的作用[9]。这些研究表明,米诺环素可对多种组织发挥抗炎作用。然而,米诺环素对干眼的抗炎及治疗是否起作用至今未见报道。本研究通过建立苯扎氯铵诱导的小鼠干眼模型,探讨米诺环素滴眼液对小鼠干眼的治疗效果和可能机制,以便为临床上开发新的治疗干眼的药物提供理论依据。
1 材料与方法
1.1主要材料与试剂
BALB/C小鼠(上海SLAC实验动物中心),米诺环素粉剂(Sigma,美国),苯扎氯铵粉剂(Sigma,美国),荧光素钠液(天津晶明新技术开发有限公司),苏木素染色试剂(Solarbio,美国),伊红染色试剂(Solarbio,美国),PAS染色剂(Promega,美国),IL-1β抗体(Abcam,美国),TNF-α抗体(Abcam,美国),K10抗体(Abcam,美国),GADPH抗体(Abcam,美国),荧光二抗FITC(Dako,美国),荧光二抗AlexaFluo488(Dako,美国),蛋白定量试剂盒(BIO-RAD,美国),Westernblot显色反应剂化学发光法(ECL)试剂盒(BIO-RAD,美国)。
1.2苯扎氯铵溶液及米诺环素滴眼液的配制
1.2.1苯扎氯铵溶液配制简要步骤称取0.2 g苯扎氯铵粉末,加入99.8 ml去离子水中,搅拌后放置24 h,待苯扎氯铵粉末完全溶解后,用EP管分装,置于常温下保存备用。
1.2.2米诺环素滴眼液配制简要步骤将等量的去离子水及甘油混匀,根据滴眼液所需浓度不同称取不同量米诺环素粉末加入到100 ml去离子水及甘油混合液中,充分搅拌溶解,加入磷酸缓冲对调节pH值,使米诺环素滴眼液终浓度分别为0.1%及0.5%。用EP管分装,置于4℃冰箱避光保存。
1.3实验过程
1.3.1小鼠干眼模型的构建雄性BALB/c小鼠60只(共120眼),体重18~20 g,健康且无眼表异常。饲养环境:温度(25±1)℃,相对湿度(60±10)%,模拟灯光昼夜更替(9 AM~9 PM)。其中50只小鼠(100眼)予以0.2%苯扎氯铵溶液滴眼,2次/d(早8∶00,晚18∶00),5μl/次,持续14 d诱导干眼模型[10],剩余10只(20眼)不作任何处理,作为基线对照。
1.3.2小鼠干眼模型的评价及筛选用药第15天根据泪膜破裂时间泪膜破裂时间(break-up time,BUT)、角膜荧光素钠染色及角膜炎症指数评分筛选干眼模型,BUT:在小鼠结膜囊内滴入1%的荧光素钠溶液1μl,将其瞬目3次后,张大睑裂,秒表计时,记下最后1次瞬目到角膜出现第1个黑斑的时间。重复3次,取平均值。筛选条件:BUT(2.5±0.5)s。
角膜荧光素钠染色:小鼠结膜囊内滴入1%的荧光素钠溶液1滴,1 min后,裂隙灯显微镜钴蓝光下观察角膜上皮荧光素钠染色情况。评分参照Pauly A等的标准[11],角膜分为4个象限,每象限0~4分,总分为16分。0分:无着染;1分:点状着染,但少于30个;2分:着染点数多于30个,但不弥散;3分:明显弥散着染但无斑块状染色;4分:斑块状染色。筛选条件:角膜荧光素染色总分12分以上。
角膜炎症指数评分:角膜炎症指数由3个参数定量组成[12]:中央角膜水肿(0分:无水肿;1分:轻度水肿,虹膜纹理清晰;2分:中度水肿,虹膜纹理不清;3分:严重水肿,虹膜瞳孔窥不见);周边角膜水肿(评分标准同中央角膜水肿);睫状充血(0分:无充血;1分:有充血带但其宽度小于1 mm;2分:充血带宽度在1~2mm之间;3分:充血带宽度大于2 mm)。分别评分后将3部分指数相加并除以系数9,即为该眼角膜炎症指数。筛选条件:炎症指数大于5/9。1.3.3干眼模型的分组及处理根据上述指标选出符合条件的干眼模型小鼠40只(80眼),随机分为A、B、C及D 4组。其中A组滴用0.1%米诺环素滴眼液,3次/d;B组滴用0.5%米诺环素滴眼液,3次/d;C组滴用不含米诺环素的溶剂(溶剂组),3次/d;D组不予任何处理(空白组)。治疗后第1、3及5天分别行BUT、角膜荧光素钠染色及角膜炎症指数评分检查(方法同前),治疗5天后处死实验小鼠,立即摘除眼球,取下相应组织行实验室检查。
1.4实验室检查
1.4.1HE及PAS染色按照常规病理染色操作。
1.4.2K10免疫组织化学(免疫组化)染色石蜡切片加3%过氧化氢室温下孵育,以阻断内源性过氧化氢酶活性,PBS液冲洗;加人一抗K10(1∶300),4℃过夜;PBS液冲洗,加入二抗,室温下孵育,DAB
显色,苏木素复染后封片。
1.4.3K10免疫荧光染色取新鲜眼球组织OCT包埋,液氮预冷后置于-80℃冰箱保存。冷冻切片,冷丙酮固定,PBS洗涤,0.1%TritonX-100透膜;PBS浸洗,5%BSA常温下封闭;加一抗K10(1∶400),4℃过夜;PBS浸洗,加荧光二抗,室温湿盒内避光孵育;PBS浸洗,DAPI复染并封片。
1.4.4Western blot蛋白检测角膜组织充分剪碎匀浆,加入RIPA裂解液裂解,4℃下高速离心,取上清液BIO-RAD蛋白定量试剂盒进行蛋白定量。制备电泳凝胶,加入样品及Marker,SDS电泳,湿转法转膜,脱脂牛奶封闭,加一抗TNF-α抗体(1∶500),IL-1β抗体(1∶500),GADPH抗体(1∶10 000)孵育,4℃低频摇晃过夜,漂洗滤膜,加入二抗(1∶2 000),常温下孵育后PBST浸洗,ECL显影。
1.5统计学方法
使用GraphPad Prism5.01进行数据分析。各个时间点进行组间比较应用单因素方差分析,满足方差齐性时,采用Tukey显著性检验进行多重比较,非方差齐性时,采用Dunnet-t检验进行多重比较。计量资料用均数±标准差(±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1治疗前各组小鼠临床指标情况
治疗前A、B、C及D组的眼表炎症评分、泪膜破裂时间及角膜上皮荧光素钠染色评分差异均无统计学意义(均P>0.05)。

图1 用药3 d后各组干眼小鼠角膜上皮荧光素钠染色代表性图片
2.2治疗后各组小鼠临床指标的变化
治疗第1天,各组小鼠泪膜破裂时间、角膜荧光素染色及炎症指数评分差异无统计学意义(均P>0.05)。治疗第3及5天,A、B组较C、D组炎症指数评分降低(F=6.57及10.17;P=0.001,0.000),泪膜破裂时间明显延长(F=5.71,5.36;P=0.003,0.004)。治疗第3天,A、B组较C、D组角膜荧光素钠染色轻(F=4.42,P=0.009)(见图1),治疗第5天各组差异无统计学意义(F=1.89,P=0.146)。治疗第3及5天,A组与B组及C组与D组之间泪膜破裂时间、角膜荧光素染色及炎症指数评分差异均无统计学意义(均P>0.05)。
2.3治疗后各组小鼠角膜HE染色情况
HE染色结果显示,空白组及溶剂组角膜上皮细胞层出现异常增大的空泡样细胞,表层上皮欠光滑,角膜基质内见少许炎症细胞。米诺环素滴眼液治疗组角膜上皮相较于空白组及溶剂组角膜上皮细胞形态更规整(见图2)。
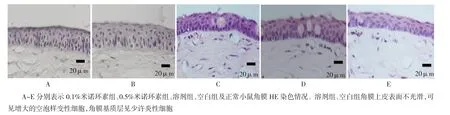
图2 治疗第5天后角膜HE染色图(×400)
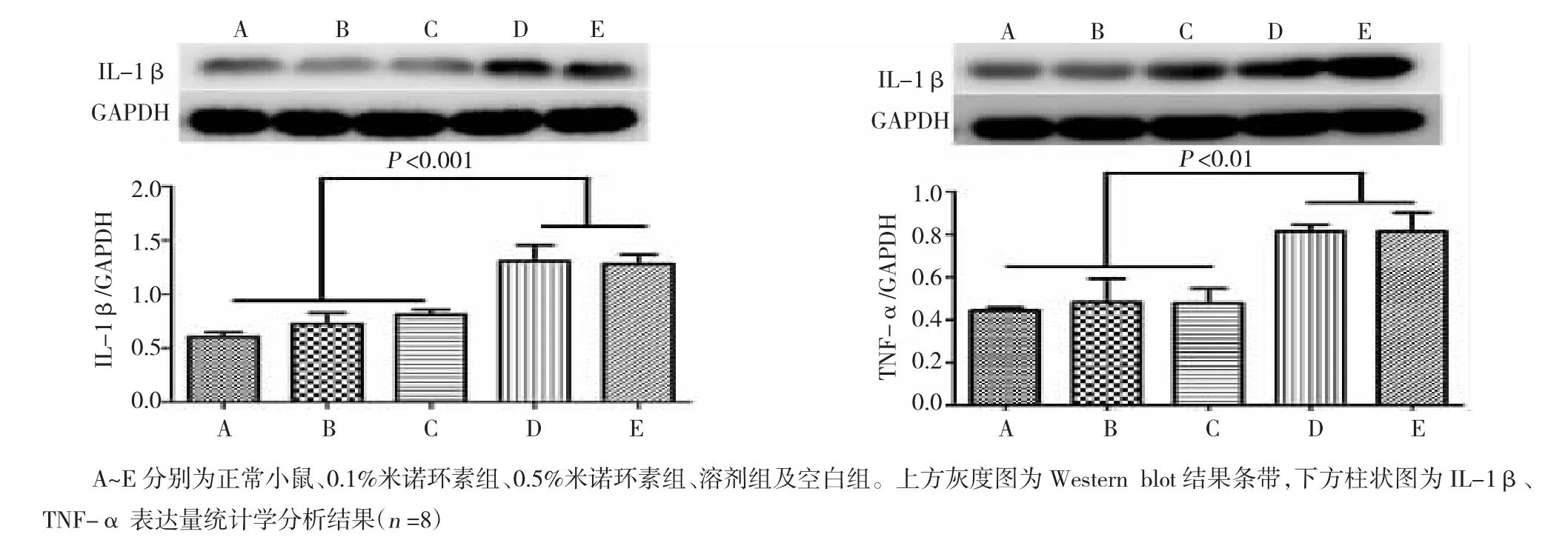
图3 治疗第5天后角膜IL-1β、TNF-αwestern blot检查结果

图4 治疗第5天各组结膜杯状细胞密度
2.4米诺环素滴眼液对干眼小鼠角膜TNF-α、IL-1β表达的影响
Western blot结果显示苯扎氯铵诱导的干眼小鼠角膜炎症因子TNF-α、IL-1β较正常小鼠明显增多,而经米诺环素滴眼液治疗后,TNF-α、IL-1β表达降低,差异具有统计学意义(F=6.84及11.6;P=0.006及0.001)(图3)。
2.5米诺环素滴眼液对小鼠干眼眼表鳞状上皮化生的影响
2.5.1结膜杯状细胞数量的变化结膜穹隆部石蜡切片行PAS染色显示,空白组及溶剂组结膜杯状细胞明显少于正常结膜,经米诺环素滴眼液治疗后结膜杯状细胞数量增加,差异有统计学意义(F=15.36,P=0.007)(图4)。
2.5.2K10表达的变化免疫组织化学及免疫荧光染色结果均显示,正常组角膜上皮基本不表达K10,而空白组及溶剂组小鼠角膜上皮均可见K10的表达,米诺环素滴眼液治疗组K10表达少于空白组及溶剂组(F=162.50,P=0.000)(图5)。

图5 治疗第5天后角膜上皮K10表达情况
3 讨论
苯扎氯铵是临床滴眼液中常用的防腐剂,也是临床上引起干眼的常见因素。苯扎氯铵诱导的小鼠干眼模型不仅临床表现类似于人类干眼,而且病理改变也与人类干眼十分相似,包括眼表炎症、角膜上皮细胞凋亡与鳞状上皮化生、杯状细胞的丢失、泪膜稳定性受损等[10]。故本实验采用苯扎氯铵滴眼液诱导的小鼠干眼模型来探讨米诺环素滴眼液对干眼的治疗作用及可能机制。
笔者通过对小鼠滴用苯扎氯铵滴眼液14 d,成功地诱导了与LIN等[10]报道类似的小鼠干眼的发生。通过对这些干眼小鼠使用米诺环素滴眼液进行治疗,笔者发现米诺环素滴眼液能够延长干眼小鼠的泪膜破裂时间、减轻角膜上皮荧光素钠染色及降低角膜炎症指数评分,证明米诺环素滴眼液对苯扎氯铵滴眼液诱导的小鼠干眼具有一定的治疗作用。为进一步证实米诺环素对小鼠干眼的治疗作用并探讨其可能的机制,笔者从组织病理学及分子生物学水平研究了米诺环素滴眼液对干眼小鼠角膜上皮细胞形态、眼表炎症及鳞状细胞化生等的影响。
眼表上皮与泪膜互相依赖和影响。眼表上皮受损不仅是干眼的表现,它反过来又可以加重干眼的发展。本实验结果显示,滴用米诺环素滴眼液后,不仅干眼小鼠角膜上皮荧光素钠染色减轻,而且HE染色发现角膜上皮形态更加规整,说明米诺环素滴眼液可以减轻干眼小鼠角膜上皮的损伤,从而对干眼产生治疗作用。
炎症是干眼发病的关键因素。IL-1β与TNF-α是干眼发病中十分常见而重要的炎症因子。既往的研究已经证实,IL-1β与TNF-α在各种类型的干眼患者及动物模型中均呈现高表达[13]。干眼的结膜及角膜上皮本身均可以产生IL-1β和TNF-α,它们不仅对干眼眼表炎症的发生及发展具有重要作用,而且其表达水平与干眼的严重程度成正相关[14]。这些发现使得IL-1β及TNF-α成为能够准确反应干眼慢性眼表炎症的代表性因子。本实验研究显示,经苯扎氯铵滴眼液诱导的小鼠干眼角膜中IL-1β及TNF-α表达明显增加,而米诺环素滴眼液能够显著抑制干眼小鼠IL-1β及TNF-α的表达,这与临床指标检查米诺环素滴眼液治疗组小鼠角膜炎症指数评分减轻一致。这些数据表明米诺环素滴眼液能够抑制苯扎氯铵滴眼液诱导的小鼠干眼模型的炎症反应,其机制可能与米诺环素滴眼液抑制IL-1β、TNF-α等炎症因子的产生相关,但确切的信号通路尚需进一步研究。
眼表鳞状上皮化生是中、重度干眼常见的病理改变,也是干眼病情恶化的表现。有研究表明眼表鳞状上皮化生分为3个阶段:①杯状细胞丢失;②细胞层数增多或表皮细胞增大;③角质化[15]。鳞状上皮化生从杯状细胞丢失的基础上进展而来,最后的结果是使具有分泌功能的非角化上皮化生为无分泌功能的角化上皮。本实验结果显示,通过苯扎氯铵滴眼液诱导的干眼小鼠角膜上皮细胞层出现异常增大的空泡样细胞,结膜杯状细胞密度明显降低,反应上皮角化的特异性标志物K10表达阳性[16],说明苯扎氯铵滴眼液诱导的干眼小鼠眼表上皮发生了明显的鳞状上皮化生。而滴用米诺环素滴眼液后,角膜上皮细胞形态更加规整,杯状细胞数目显著增多,K10的表达明显减少,表明米诺环素滴眼液能抑制干眼小鼠的眼表鳞状上皮化生。由于干眼眼表鳞状上皮化生与眼表长期的炎症密切相关[17],而米诺环素滴眼液具有抑制干眼眼表炎症的作用,因此,笔者推测米诺环素滴眼液抑制干眼眼表鳞状上皮化生,可能与米诺环素滴眼液能够抑制干眼眼表炎症有关。
值得注意的是,治疗后第5天,米诺环素治疗组与空白及溶剂对照组角膜荧光素钠染色并无差异,可能与小鼠角膜上皮具有较强的自我修复功能,使得随着时间推移,各组间的角膜荧光素钠染色差异逐渐不明显有关。此外,整个实验中,0.5%米诺环素滴眼液并未表现出比0.1%米诺环素滴眼液更强的治疗作用及抗炎效果,可能与本实验使用滴眼液的制剂工艺不足有关。因为米诺环素是一种呈酸性的脂溶性抗生素,随着药物配制浓度的增加,可能存在药物溶解不充分及药物的pH值下降,从而降低了药物的有效治疗浓度,增加了药物对眼表的刺激。因此,改进米诺环素滴眼液的制剂工艺,是接下来亟需研究的课题。
总之,笔者的研究表明,米诺环素滴眼液对苯扎氯铵诱导的小鼠干眼模型具有一定的治疗作用,其机制可能与米诺环素能抑制干眼眼表炎症及减轻眼表鳞状上皮化生有关。这一结果为开发新的治疗干眼的药物提供了一定的依据。
[1]MA L.The definition and classification of dry eye disease:reportof the Definition and Classification Subcommittee of the International Dry Eye WorkShop(2007)[J].Ocul Surf,2007,5(2):75-92.
[2]MESSMER EM.The pathophysiology,diagnosis,and treatment of dry eye disease[J].Dtsch Arztebl Int,2015,112(5):71-81.
[3]JUNG HH,JI YS,SUNG MS,et al.Long-Term outcome of treatment with topical corticosteroids for severe dry eye associated withsjogren'ssyndrome[J].ChonnamMed,2015,51(1): 26-32.
[4]OSSOLA B,LANTTO TA,PUTTONEN KA,et al.Minocycline protects SH-SY5Y cells from 6-hydroxydopamine by inhibiting both caspase-dependent and-independent programmed cell death [J].Neurosci Res,2012,90(3):682-690.
[5]JIAO X,Y PENG,L YANG.Minocycline protects retinal ganglion cells after optic nerve crush injury in mice by delaying autophagy and upregulating nuclear factor-kappaB2[J].Chin Med (Engl),2014,127(9):1749-1754.
[6]任韵清,杨森,张学军.米诺环素应用新进展[J].中华皮肤科杂志, 2005,12(7):777-778.
[7]JACKSON JM,LH KIRCIK,DJ LORENZ.Efficacy of extended-release 45 mg oral minocycline and extended-release 45 mg oral minocycline plus 15%azelaic acid in the treatment of acne rosacea[J].Drugs Dermatol,2013,12(3):292-298.
[8]BERNARDINO AL,D KAUSHAL,MT PHILIPP.The antibiotics doxycycline and minocycline inhibit the inflammatory responses to the Lyme disease spirochete Borrelia burgdorferi[J].Infect Dis, 2009,199(9):1379-1388.
[9]ABCOUWER SF,LIN CM,SHANMUGAM S,et al.Minocycline prevents retinal inflammation and vascular permeability following ischemia-reperfusion injury[J].Neuroinflammation,2013(10):149.
[10]LIN Z,LIU X,ZHOU T,et al.A mouse dry eye model induced by topical administration ofbenzalkoniumchloride[J]. Mol Vis,2011(17):257-264.
[11]PAULY A,BRIQNOLE-BAUBOUIN F,LABBE A,et al.New tools for the evaluation of toxic ocular surface changes in the rat[J].Invest Ophthalmol Vis Sci,2007,48(12):5473-5483.
[12]LARIA C,ALIÓJL,RUIZ-MORENÓJM.Combined non-steroidal therapy in experimental corneal injury[J].Ophthalmic Res,1997, 29(3):145-53.
[13]LUO L,LI DQ,DOSHI A,et al.Experimental dry eye stimulates production of inflammatory cytokines and MMP-9 and activates MAPK signaling pathways on the ocular surface[J].Investigative Ophthalmology&Visual Science,2004,45(12):4293-4301.
[14]YIHUI CHEN,XIAOYAN ZHANG,LING YANG,et al.Decreased PPAR-gamma expression in the conjunctiva and increased expression of TNF-alpha and IL-1beta in the conjunctiva and tear fluid of dry eye mice[J].Molecular medicine reports,2014,9(5):2015-2023.
[15]TSENG SC.Staging of conjunctival squamous metaplasia by impression cytology[J].Ophthalmology,1985,92(6):728-733.
[16]W LI,Y HAYASHIDA,YT CHEN,et al.Air exposure induced squamous metaplasia of human limbal epithelium[J].Invest Ophthalmol Vis Sci,2008,49(1):154-162.
[17]KUNERT,KS,AS TISDALE,et al.Goblet cell numbers and epithelial proliferation in the conjunctiva of patients with dry eye syndrome treated with cyclosporine[J].Archives of Ophthalmology,2002,120(3):330-337.
(王荣兵 编辑)
Therapeutic effects and mechanism of minocycline eye drops in a murine model of dry eye
Qi-guo XIAO1,Jing ZHOU1,Fang ZHOU1,Xian LI1,Jie LI1,Luo-sheng TANG2,Zu-guo LIU3
(1.Department of Ophthalmology,the Second Affiliated Hospital of University of South China, Hengyang,Hunan 421001,P.R.China;2.Department of Ophthalmology,the Second Xiangya Hospital of Central South University,Changsha,Hunan 410011,P.R.China;3.Eye Institute of Xiamen University,Xiamen,Fujian 361102,P.R.China)
【Objective】To investigate the effects of minocycline eye drops on dry eye in a mouse model induced by topical benzalkonium chloride(BAC)and outline the mechanism.【Methods】Fifty male BALB/c mice were treated with topical administration of 0.2%BAC to induce dry eye.According to clinical evaluations including tear break-up time(BUT),corneal fluorescein staining scores and inflammation index on day(D)15 after the BAC treatment,the similar severity dry eye mice(80 eyes)were selected and randomly divided into four groups:A(0.1% minocycline-treated group),B(0.5%minocycline-treated group),C(solvent-treated group),and D(blank group). Clinical evaluations including BUT,corneal fluorescein staining,and inflammatory index were performed on D1,D3 and D5 after treatment.Eyeballs were collected on D5 and evaluated by histologic investigation,immunostaining using antibodies against cytokeratin 10 in the cornea was performed,and goblet cells were detected by the periodic acid-Schiff(PAS)assay.The levels of IL-1β,TNF-α were measured by Western blot.【Results】Eighty eyes wereincluded in the sequential experiment,20 eyes for each group.There were no clinical differences among the groups before the treatment.Lower inflammatory index scores and longer BUT were recorded on D3 and D5 in minocyclinetreated eyes,and lower corneal fluorescein staining scores were recorded on D3 in minocycline-treated eyes.The expression of cytokeratin 10 was reduced in minocycline-treated eyes.The expressions of IL-1β,TNF-α were inhabited in minocycline-treated eyes.In addition,minocycline relatively increased the number of goblet cells.【Conclusion】Topical minocycline application produced improvements in dry eye,most likely by inhibiting inflammation and squamous metaplasia.
dry eye;minocycline eye drops;mice;inflammation;squamous metaplasia
R772.2;R777.3
A
1005-8982(2015)25-0001-07
2015-05-18
国家自然科学基金(No:81270978);湖南省卫生计划生育委员会基金(No:2015-57)
