活性维生素D3对IgA肾病大鼠肾组织中Toll样受体4表达的影响
2015-12-07王缨汪国平李弼民
王缨,汪国平,李弼民
(南昌大学第一附属医院肾内科,江西 南昌 330006)
·论著·
活性维生素D3对IgA肾病大鼠肾组织中Toll样受体4表达的影响
王缨,汪国平,李弼民
(南昌大学第一附属医院肾内科,江西 南昌 330006)
目的探讨活性维生素D3对IgA肾病(IgAN)大鼠保护作用的可能机制。方法50只大鼠随机分为3组,正常对照组(NC组)10只、对照模型组(MC组)20只、活性维生素D3治疗组(干预组)20只。干预组给予活性维生素D3灌胃8周。灌胃第4和8周末检测24 h尿蛋白定量、肾功能及血浆清蛋白,采用酶联免疫吸附测定血浆白细胞介素-1(IL-1)蛋白表达,免疫组织化学法检测肾组织Toll样受体4(TLR4)蛋白的表达。结果①与MC组比较,干预组血肌酐和24 h尿蛋白均下降(均P<0.05);②与NC组比较,MC组TLR4蛋白表达增加(P<0.05);与MC组比较,干预组TLR4蛋白表达下降(P<0.05);③与NC组比较,MC组IL-1表达增加(P<0.05);与MC组比较,干预组IL-1表达下降(P<0.05)。结论活性维生素D3可通过抑制IgAN大鼠的TLR4的表达及细胞因子IL-1的表达,对IgAN大鼠肾脏损伤有预防保护作用。
IgA肾病;活性维生素D3;Toll样受体4;白细胞介素-1;大鼠
IgA肾病(immunoglobulin A nephropathy,I-gAN)是目前最常见的原发性肾小球疾病之一,IgAN典型的临床表现为黏膜感染,尤其是上呼吸道感染同时或之后短期内伴发肉眼血尿。因此,研究认为天然黏膜免疫异常在IgAN的发生中有一定的作用。天然免疫分子Toll样受体(toll-like receptor,TLRs)在天然免疫和获得性免疫中均起重要的作用。既往研究表明,TLR4通路与IgAN关系密切。近年活性维生素D3[1,25(OH)2D3]的肾脏保护作用受到关注,本研究探讨活性维生素D3对IgAN大鼠肾脏TLR4的表达的影响。现报道如下:
1 材料与方法
1.1试剂与药品
脂多糖(lipopolysaccharide,LPS)、牛血清蛋白(bovine serum protein,BSA)、四氯化碳(CCL4)(均购自美国Sigma公司),Anti-TLR4 antibody一抗、二抗(美国anbo公司),活性维生素D3由为上海罗氏制药有限公司提供。
1.2实验动物与饲养条件
本实验所采用的50只大鼠均为SPF级雄性SD大鼠,购自湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCXK(湘)2011-0003。体重均在180~200 g,保证饲养环境的适宜,定时定量饮水、喂食,待大鼠适应环境7 d后开始构建大鼠IgAN模型。
1.3动物模型的构建及分组
50只SPF级别的SD雄性大鼠按随机数字表法分为两组,正常对照组10只、造模组40只。造模组大鼠用BSA按400 mg/kg隔日灌胃,至造模结束共9周;在第6及8周末通过尾静脉注射脂多糖,每只每次0.05 mg;每周日通过皮下注射CCL4,每只每次蓖麻油0.5 ml+CCL4 0.1 ml,共9周[1];正常对照组(NC组)在相同时间给予正常对照组等体积蒸馏水灌胃,同体积生理盐水皮下注射及同等量的生理盐水尾静脉注射。实验第9周造模完成。造模完成后将40只模型组大鼠随机分为对照模型组(MC组)和干预组,每组各20只。MC组和干预组均继续予以BSA隔日灌胃(剂量同前),干预组给予1,25(OH)2D3溶于0.05 ml花生油以0.03μg/(kg·d)每日灌胃[2],期间每周称量体重,根据体重的变化计算药物用量并作出调整。NC组和MC组大鼠每日灌喂同等量花生油,共8周。
1.4标本采集
于成模后及用药4和8周末对各组大鼠采用眶静脉采血法收集血液2~3 ml,静置2 h,3 000 r/min离心5 min,取血清,-80℃冻存待测;并于各实验点前用代谢笼留取各组大鼠24 h尿待测。于成模后及用药4和8周末每组大鼠各处死一半,留取其肾组织待测。
1.5观察指标与检测方法
1.5.1相关因子检测于成模后及用药4和8周,检测血肌酐(serum creatinine,Scr)、血白蛋白,检测24 h尿蛋白定量。
1.5.2组织病理学观察检查采用HE染色。免疫荧光检查:对IgA的沉积情况进行观察,并关注荧光的强度及面积,在肾小球系膜区显示为绿色视为阳性。
1.5.3肾组织TLR4蛋白的表达取肾组织标本,采用免疫组织化学检测,4μm厚石蜡切片,脱蜡后微波修复(柠檬酸缓冲液,pH 6.0),3%过氧化氢H2O2孵育10 min,3%BSA封闭15 min,滴加羊抗TLR4抗体(英国abcam公司,1∶800)后4℃过夜,次日滴加二抗(英国abcam公司),37℃孵育30 min,磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次后,DAB显色,苏木素复染,透明,封片。以TLR4在肾小管上皮细胞、系膜细胞胞浆染成黄色或棕色为阳性。观察细胞染色阳性的强度及范围。以定量积分法对蛋白表达量进行评价,每张切片至少观察10个高倍镜视野。染色强度评分:浅黄色1分、棕黄色2分、棕褐色3分,染色阳性范围比例评分:1%~25%1分、26%~50%2分、51%~75%3分、76%~100%4分。以染色强度评分与阳性范围比例评分的乘积为TLR4阳性积分。
1.5.4IL-1蛋白表达取血清标本,采用酶联免疫吸附测定(emzyme-linked immuno sorbentassay,ELISA)法检测,将标准品、待测样本各50μl(待测样本10μl,再加样本稀释液40μl)加入到已包被的酶标板,37℃恒温箱温育30 min,洗涤除去未结合的成分,再加入酶标工作液50μl,37℃恒温箱温育30 min,洗涤除去未结合的成分,依次加入底物工作液50μl,每孔加终止液50μl混匀,450 nm波长下测定OD值。酶标仪的读数为每孔样品和标准品的OD值,且可测出具体浓度数值,根据标准品的浓度和所测OD值求得标准曲线,再根据所得样品OD值和标准曲线公式算出实测样品的浓度值。
1.6统计学方法
数据以均数±标准差(x±s)表示,应用SPSS 13.0统计学分析软件,单因素方差分析比较多组间均值的差异,以P<0.05为差异有统计学意义。
2 结果
2.1一般情况
MC组在造模第4周时死亡大鼠1只,造模第7周时死亡大鼠1只;干预组1,25(OH)2D3治疗4周时死亡大鼠1只。
在整个实验过程中,对照组大鼠精神、活动无明显异常,造模组部分大鼠在造模第6和8周尾静脉注射LPS后,出现食欲不振或精神萎靡等,但一般1周后可自行缓解。
2.2各组大鼠不同时间点Scr、血浆清蛋白和24 h尿蛋白比较
Scr、血浆清蛋白和24 h尿蛋白MC组各时间点与NC组比较差异有统计学意义(P<0.05);干预组第4和8周与MC组同时间点相比差异有统计学意义(P<0.05);干预组第8周与第4周相比差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠生化结果的比较(±s)
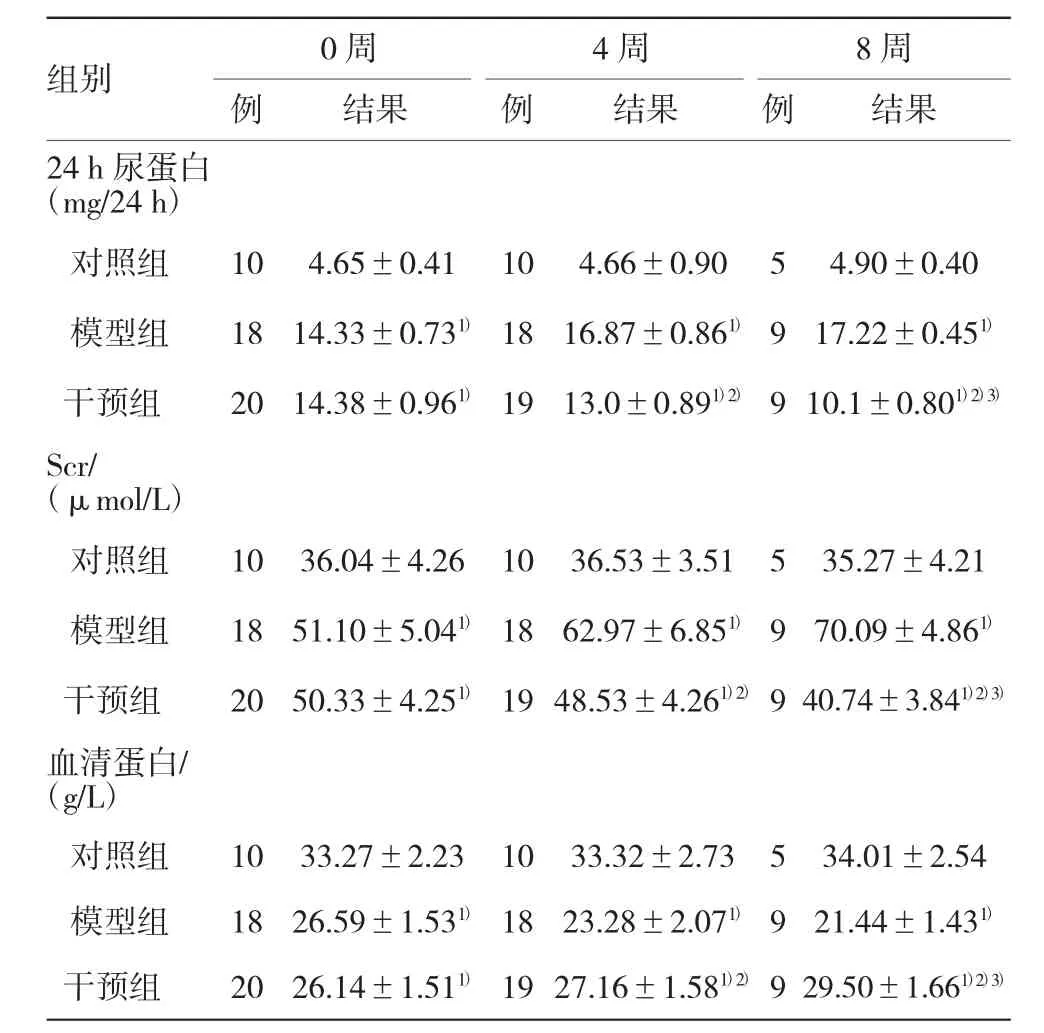
表1 各组大鼠生化结果的比较(±s)
注:1)同一时间点,与NC比较,P<0.05;2)同一时间点,与MC组相比,P<0.05;3)同一时间点,与干预组4周比较,P<0.05
8周例结果24 h尿蛋白(mg/24 h)对照组104.65±0.41104.66±0.9054.90±0.40模型组干预组组别0周例结果结果4周例18 20 14.33±0.731)14.38±0.961)18 19 16.87±0.861)13.0±0.891)2)9 9 17.22±0.451)10.1±0.801)2)3)Scr/(μmol/L)对照组模型组干预组10 18 20 36.04±4.26 51.10±5.041)50.33±4.251)10 18 19 36.53±3.51 62.97±6.851)48.53±4.261)2)5 9 9 35.27±4.21 70.09±4.861)40.74±3.841)2)3)血清蛋白/(g/L)对照组1033.27±2.231033.32±2.73534.01±2.54模型组干预组18 20 26.59±1.531)26.14±1.511)18 19 23.28±2.071)27.16±1.581)2)9 9 21.44±1.431)29.50±1.661)2)3)
2.3光镜和荧光显微镜下各组大鼠肾脏病理组织学观察
光镜下NC组大鼠未见病理改变,MC组在肾小球内可见明显的系膜细胞增多,系膜基质中到重度增生,毛细血管管腔狭窄,肾间质内可见明显的炎性细胞浸润,并可见肿胀变性的肾小管上皮细胞。见图1。荧光下NC组未见IgA沉积,MC组可见团块状或颗粒状绿色IgA荧光。见图2。
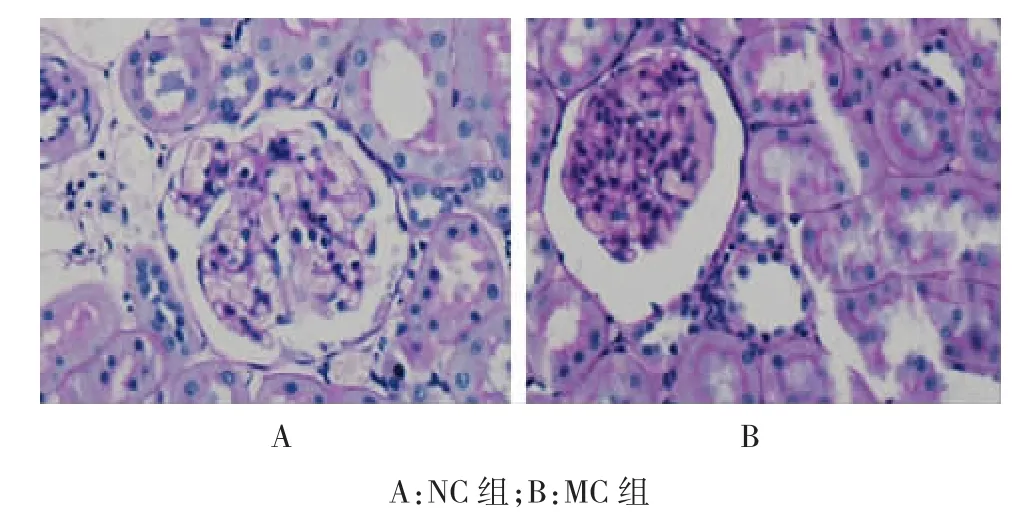
图1 NC组和MC组大鼠肾组织病理改变(光镜×400)

图2 NC组和MC组大鼠肾组织中IgA的沉积(免疫荧光×400)
2.4TLR4的免疫组织化学染色
TLR4蛋白表达MC组各时间点与NC组比较差异有统计学意义(P<0.05),干预组各时间点与MC组相比差异有统计学意义(P<0.05),干预组8周时TLR4的表达较4周时明显下降,差异有统计学意义(P<0.05)。见图3和表2。
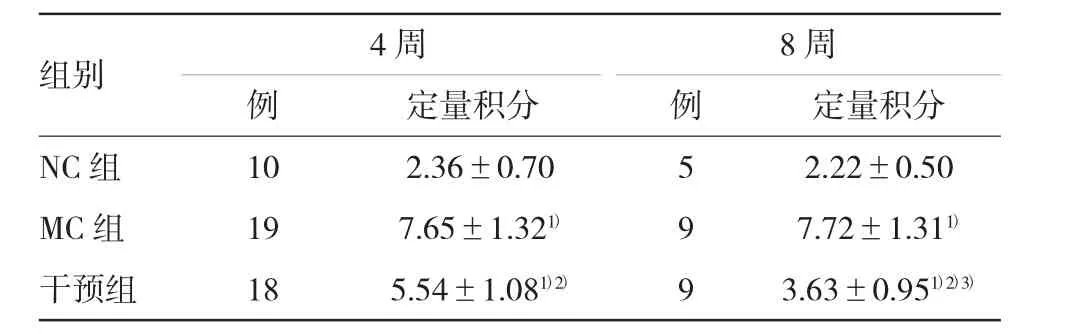
表2 各组大鼠TLR4蛋白定量的比较(分,x±s)
表3 各组大鼠不同时间点IL-1蛋白表达水平比较[ρ/(ng/L)±s]

表3 各组大鼠不同时间点IL-1蛋白表达水平比较[ρ/(ng/L)±s]
注:1)与NC组相比,P<0.05;2)与MC组相比,P<0.05;3)与干预组4周比较,P<0.05
组别4周8周例定量积分例定量积分NC组105.68±2.1257.13±3.24 MC组1961.15±35.461)975.31±59.121)干预组1841.13±15.21920.43±8.932)3)
2.5IL-1蛋白表达
大鼠IgAN模型构建成功后,炎性因子IL-1表达上调,并随着疾病进展表达进一步增加。MC组与NC组同时间点相比差异均具有统计学意义(P<0.05);干预组8周时IL-1表达较MC组同时间点有明显下降,差异具有统计学意义(P<0.05)。干预组8周时IL-1的表达较4周时明显下降,差异有统计学意义(P<0.05)。见表3。

图3 3组大鼠肾组织中TLR4的表达(免疫组织化学×400)
3 讨论
IgAN的典型临床表现是上呼吸道感染的短期内出现肉眼血尿或镜下血尿,可伴有不同程度的蛋白尿。研究报道,上呼吸道或扁桃体感染可增加IgAN患者的血尿和蛋白尿。扁桃体摘除可有效治疗某些IgAN患者,说明天然黏膜免疫异常可能参与了IgAN的发生发展过程。
TLR是一种模式识别受体,目前TLR家族有11个成员,可识别环境中的病原体,启动天然免疫和适应性免疫应答产生不同的效应分子,抵抗病原体的入侵,作为TLR家族中及其重要的成员TLR4在天然免疫反应中有十分重要的作用,黏膜感染时LPS可激活TLR4,其主要信号转导途径之一是通过一个衔接蛋白(MyD88)与TLRs细胞内TIR区域结合,导致转录因子(如NF-κB)的激活,从而促使大量细胞活性因子(IL-1、IL-6和IL-8)、黏附分子和炎症因子的合成及转录表达,最终影响免疫与炎症反应[3-6]。TLRs家族中TLR4除了介导细菌内毒素所致的炎症反应外,还可介导肺脏、肝脏及肾脏IRI等非感染性炎症反应,通过抑制TLR4活性可以起到一定的脏器保护作用[7-9]。
越来越多的研究表明:TLR4信号通路与肾脏疾病密切相关,对肾毒性肾炎模型的研究发现,TLR4配体通过对外周淋巴细胞及肾固有细胞的调控作用,在肾小球肾炎的发展中起重要作用[10]。COPPO等[11]发现IgAN患者外周血单核细胞中TLR4表达增加,且与尿蛋白及疾病活动时期相关。QIN等[12]发现细菌LPS激活TLR4可以导致Cosmc的甲基化,从而降低IgA1的糖基化程度,提示在IgAN的发生发展中,TLR4也起到一个重要的作用。
研究表明TLR4可能通过多种机制激活多种配体参与IgAN患者肾组织损伤[13-14]。TLR4信号通路激活后可引起相关细胞因子表达上调,导致肾组织炎症反应,损伤的肾组织又可暴露纤维蛋白原及黏连蛋白等TLR4内源性配体,诱导TLR4的表达,形成恶性循环[15]。本研究通过构建大鼠IgAN模型,检测TLR4在肾组织中表达较正常对照组明显增加,主要表达于肾小球系膜细胞及肾小管上皮细胞中,提示在IgAN的发病中,TLR4信号通路是一个重要途径。在2型糖尿病患者中研究发现TLR4表达增加,且与内毒素HSP60及HMGB1呈正相关,TLR4信号导致细胞因子水平升高,这其中就包括了IL-1[16]。本研究也观察到IgAN大鼠中IL-1和TLR4有较大关联,随着TLR4的表达增加上调了IL-1在体内的表达而引起炎症反应。
活性维生素D3不仅是调节体内钙磷代谢平衡的重要激素,活性维生素D3可通过通过阻断肾素-血管紧张素系统、直接抑制炎症因子分泌、调节免疫、减少细胞外基质沉积和保护足细胞等对肾脏起到保护作用[17-19]。LI[17]研究活性维生素D3也能抑制肾成纤维细胞的增殖和转化,具有抗系膜细胞增殖的活性,减轻肾间质纤维化,对肾脏起保护作用,延长患者生存率。BAEKE等[20]研究发现,活性维生素D3能够抑制单核细胞的TLR4 mRNA和蛋白的表达,且该作用呈时间和剂量依赖性。PANICHI等[21]的研究表明活性维生素D3具有抑制IL-1、IL-6及TNF-α等递质的作用,从而能够显著减少系膜增生性肾小球肾炎大鼠模型的蛋白尿。由上可知,活性维生素D3具有阻抑慢性肾脏疾病进行性发展的潜能。本研究结果显示,应用活性维生素D3干预治疗后可以减少IgAN大鼠尿白蛋白排泄率,改善肾功能,减轻肾脏的病理改变,肾组织中TLR4的表达较模型组明显下降,其炎性因子IL-1的表达同时间点较模型组有所下降。其作用机制可能是通过TLR4路径抑制炎性因子的表达。因此,可以进一步以TLR4为靶点,阻断或抑制其表达,观察TLR4的具体变化,寻找表达变化中的关键环节,并针对关键因素进行临床研究,可能为临床药物开发提供新的思路。
[1]汤颖,娄探奇,成彩联,等.实验性IgA肾病模型的改进[J].中山大学学报:医学科学版,2006,27(2):184-187.
[2]马丽娟,杜国利,赵琦英,等.活性维生素D3对大鼠早期糖尿病肾病相关炎性因子的影响[J].中华实用诊断与治疗杂志,2012,26(3): 234-237.
[3]HUA F,HA T,MA J,et al.Protection against myocardial ischemia/reperfusion injury in TLR4-deficient mice is mediated through a phosphoinositide 3-kinase-dependent mechanism[J].J Immunol,2007,178(11):7317-7324.
[4]LIN R,LIU J,PENG N,et al.Lovastatin reduces nuclear factor kappa B activation induced by C-reactive protein in human vascular endothelial cells[J].Biol Pharm Bull,2005,28(9):1630-1634.
[5]MORENO M,RAMALHO LN,SANCHO-BRU P,et al.Atorvastatin attenuates angiotensin II-induced inflammatory actions in the liver[J]. Am J Physiol Gastrointest Liver Physiol,2009,296(2):147-156.
[6]SHARYO S,YOKOTA-IKEDA N,MORI M,et al.Pravastatin improvesrenalischemia-reperfusioninjurybyinhibitingthe mevalonate pathway[J].Kidney Int,2008,74(5):577-784.
[7]SHIMAMOTO A,POHLMAN TH,SHOMURA S,et al.Toll-like receptor 4 mediates lung ischemia-reperfusion injury[J].Ann Thorac Surg,2006,82(6):2017-2023.
[8]WANG H,LI ZY,WU HS,et al.Endogenous danger signals trigger hepaticischemia/reperfusioninjurythroughtoll-likereceptor 4/nuclear factor-kappa B pathway[J].Chin Med J(Engl),2007,120(6): 509-514.
[9]WU H,CHEN G,WYBURN KR,et al.TLR4 activation mediates kidney ischemia/reperfusion injury[J].J Clin Invest,2007,117(10): 2847-2859.
[10]BROWN HJ,LOCK HR,WOLFS TG,et al.Toll-like receptor 4 ligation on intrinsic renal cells contributes to the induction of antibody-mediated glomerulonephritis via CTCL1 and CTCL2[J].J AM Soc Nephrol,2007,18(6):1732-1739.
[11]COPPO R,CAMILLA R,AMORE A,et al.Toll-like receptor 4 expression is increased in circulating mononuclear cells of patients with immunoglobulin a nephropathy[J].Clinical and Experimental Immunology,2010,159(1):73-81.
[12]QIN W,ZHONG X,FAN JM,et al.External suppression causes the low expression of the cosmc gene in IgA Nephropathy[J].Nephrol Dial Transplant,2008,23(5):1608-1614.
[13]LIM BJ,LEE D,HONG SW,et al.Toll-like receptor 4 signaling is invovled in IgA-stimulatde mesangial cell activation[J].Yonsei Med J, 2011,52(4):610-615.
[14]KWON J,PARK J,LEE D,et al.Toll-like recptor expression in patients with renal allograft dysfunction[J].Transplant Proc,2008,40 (10):3479-3480.
[15]FETEROWSKI C,EMMANUILIDIS K,MIETHKE T,et al.Effects of functional toll-like receptor-4 mutations on the immune response to human and experimental sepsis[J].Immunology,2003,109(3): 426-431.
[16]DASU MR,DEVARAJ S,PARK S,et al.Increased toll-like receptor (TLR)activation and TLR ligands in recently diagnosed type2 diabetic subjects[J].Diabetes Care,2010,33(4):861-868.
[17]LI YC.Vitamin D and diabetic nephropathy[J].Curr Diab Rep,2008, 8(6):464-469.
[18]VAN ETTEN E,STOFFELS K,GYSEMANS C,et al.Regulation of vitamin D homeostasis:implications for the immune system[J].Nutr Rev,2008,66(10 Supp1 2):S125-S134.
[19]LI Y,SPATARO BC,YANG J,et al.1,25-dihydroxyvitamin D inhibitsrenalinterstitialmyofibroblastactivationbyinducing hepatocyte growth factor expression[J].Kindey Int,2005,68(4): 1500-1510.
[20]BAEKE F,TAKIISHI T,KORF H,et al.Vitamin D:modulator of the immune system[J].Curr Opin Pharmacol,2010,10(4):482-496.
[21]PANICHIV,MIGLIORIM,TACCOLAD,etal.Effectsof1,25-Dihydroxyvi-tamin D3 in experimental mesangial proliferative nephritis in rats [J].Kidney Int,2001,60(1):87-95.
(张立芳 编辑)
Effects of 1,25-dihydroxyvitamin D3 on renal expression of TLR-4 in IgAN rats
Ying WANG,Guo-ping WANG,Bi-min LI
(Department of Nephrology,the First Affiliate Hospital of Nanchang University, Nanchang,Jiangxi 330006,P.R.China)
【Objective】To explore possible renal protective effect of 1,25-dihydroxyvitamin D3 on IgAN rats.【Methods】Fifty rats were randomized into 3 groups,the normal control group(group NC)(n=10),IgAN group (group MC)(n=20),IgAN rats treated with 1,25-dihydroxyvitamin D3(Intervention group)(n=20).After 4 and 8 weeks treatment,24 h urine protein,serum creatinine and serum albumin were detected.ELISA was used to monitor the expressions of interleukin-1(IL-1)protein in plasma.Immunohistochemical staining was used to monitor the expressions of Toll-like receptor 4(TLR4)protein in renal tissue.【Results】①24 h urine protein and serum creatinine in the intervention group were significantly lower than those in the MC group(P<0.05);②TLR4 protein expression in MC group was significantly higher than that in NC group(P<0.05),and the expression in the intervention group was significantly lower than that in MC group(P<0.05);③IL-1 expression in the MC group was significantly higher than that in NC group(P<0.05);IL-1 expression in the intervention group was significantly lower than that in MC group(P<0.05).【Conclusion】1,25-dihydroxyvitamin D3 has some renal protective effect on IgAN rats, partly by down-regulating TLR4 in renal tissue.
IgAN;1,25-dihydroxyvitamin D3;Toll-like receptor 4;interleukin-1;rat
R-332;R692
A
1005-8982(2015)25-0025-05
2014-12-17
李弼民,E-mail:lbmjx@163.com
