60例一氧化碳中毒患者脑电图分析及对迟发性脑病的预测价值*
2015-12-06刘力学樊双义夏学林
刘力学,樊双义,夏学林
军事医学科学院附属医院 神经内科(北京 100071)
一氧化碳(CO)中毒可造成患者以中枢神经系统损害为主的多器官功能病变,其中12%~30%的患者在急救“假愈期”后会出现以急性痴呆为主要表现的大脑皮质局部、锥体及锥体外系功能及精神意识障碍[1-2],即CO 中毒迟发性脑病(delayed enceph-alopathy after acute carbon monoxide poisoning,DEACMP)。该病发病涉及多种因素共同参与,具体机制尚未完全阐明,尽管经过积极治疗,DEACMP仍具有较高的致残率[3-4]。因此早期预测和预防DEACMP的发生对改善患者预后意义重大。研究[5]提示,脑电图(EEG)监测有助于判断DEACMP病情和评价预后。本研究以60例急性CO中毒患者为研究对象,观察DEACMP患者EEG特异性表现,现报道如下。
1 资料与方法
1.1 临床资料
选取2012年2月至2014年12月军事医学科学院附属医院收治的CO中毒患者60例,其中男27例,女33例;年龄(42.5±8.1)岁。入选患者符合本病诊断标准[6];排除存在代谢或神经病变、既往有脑血管病史、脑外伤或死亡患者。中毒程度分类:轻度11例(18.3%),表现为头晕、头痛、心慌但未昏迷;中度32例(53.3%),其中28例昏迷患者瞳孔对光反射和角膜反射减弱,肌张力下降;重度17例(28.3%),表现为深度昏迷或伴有阵发性抽搐。45例昏迷患者昏迷时间持续(13.8±4.5)h。所有患者家属均签署知情同意书。
1.2 治疗及检查方法
患者入院后均给予高压氧、扩血管药物、糖皮质激素、能量合剂和维生素等对症治疗,早期给予20%甘露醇、地塞米松等治疗,以降低颅内压、改善微循环。高压氧治疗采用NG90-IIC型医用高压氧舱,200kPa加压35min,20kPa连续洗舱5min,稳压30min,减压25min,1次/d,10d为1个疗程。
所有患者于入院24h内首次检查EEG及头颅CT,参照《临床脑电图学》标准,采用美国Nicolet One公司生产的32通道数字化视频脑电分析仪,按照国际10/20系统放置头皮电极,单、双极导联描记,描记时走纸速度30cm/s,定标电压10μV/mm,电极电阻<5kΩ;单个导联描记2~3min,整个描记持续时间≥20min。随后所有患者每隔7~14d复查直至出院。
1.3 观察指标
根据治疗结果,将患者分为DEACMP组及对照组,比较两组首次和第14天的EEG及CT表现。分析DEACMP患者急性CO中毒期、假愈期、DEACMP发病期和临床治愈期4个阶段EEG变化情况。
1.4 统计学方法
采用SPSS 17.0软件对数据进行分析处理,定量资料以均数±标准差(±s)描述,两组间均数比较采用t检验或秩和检验;定性资料采用率(%)描述,组间比较采用χ2检验,检验水准α设定为0.05。
2 结果
2.1 治疗及随访结果
患者紧急治疗后意识逐渐恢复,随访过程中,24例发生DEACMP,设为DEACMP组,“假愈期”7~55d,平均24.2d,临床表现为:1)精神和智能障碍23例(95.8%):痴呆伴不同程度记忆力、计算力或定向力下降、谵妄或去大脑皮层状态;2)锥体外系功能障碍15例(62.5%):肌张力增高伴或不伴震颤、帕金森综合征表现;3)锥体系功能障碍9例(37.5%):偏瘫、强哭强笑、病理反射阳性等;4)大脑皮层局灶性功能障碍2例(8.3%):失语或继发癫痫。其余36例未发生精神症状,设为对照组。两组年龄、性别、中毒分类、昏迷持续时间比较,差异无统计学意义(P>0.05),而对照组高压氧治疗次数高于DEACMP组,差异有统计学意义(t=5.1491,P<0.001)(表1)。
2.2 CO中毒患者EEG、CT表现及检查结果
60例患者共计进行EEG检查175次,平均2.9次。CO轻度中毒者EEG异常表现为1~3.5Hz的中-高波幅慢波增加,以额区或额颞区突出,弥漫性δ波,或间有数量不等的θ波为主;两侧大脑波形明显不对称,调幅、调节不佳。中、重度异常者EEG表现为基本节律消失,α波所占比例减少,出现广泛的慢波化和平坦化,少数患者出现尖波、棘波或尖慢、棘慢复合波。脑电地形图表现为弥漫性局限性慢波频段功率值增高,θ、δ频带所占比率明显增加,α频带比率明显降低。
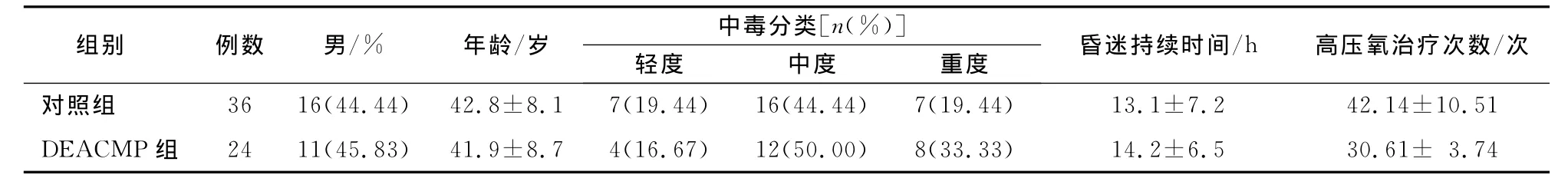
表1 两组一般资料比较
60例患者中,CT异常者29例,主要表现为大脑白质区及基底节区低密度灶改变。其中对照组9例,异常率25.00%(9/36);DEACMP组20例,异常率83.33%(20/24)。两组CT异常率比较,差异有统计学意义(χ2=19.628,P<0.001)。
对照组及DEACMP组第2次EEG检测结果均较首次明显改善,两次异常率比较,差异有统计学意义(χ2=4.5315,5.7789;P=0.0333,P=0.0068)。 对照组首次EEG总异常率66.67%(24/36),中、重度异常率为36.11%(13/36);DEACMP组首次EEG总异常率91.67%(22/24),中、重度异常率为70.83%(17/24),两组首次总异常率(χ2=6.9444,P=0.0249)及中、重度异常率(χ2=5.0311,P=0.0084)比较,差异均有统计学意义(表2)。
2.3 DEACMP组EEG变化情况
DEACMP患者急性CO中毒期EEG表现为广泛出现的弥漫性高幅δ波或θ波,以额或额颞区最明显,呈持续性或较长程出现。急性CO中毒期EEG异常率为91.67%(22/24),其中中、重度 EEG异常占70.83%(17/24)。DEACMP发病后异常率为95.83%(23/24),与急性期比较差异无统计学意义(χ2=0.0000,P=0.9850),主要为中、重度 EEG异常患者比例增加(75.00%,18/24)(表3)。
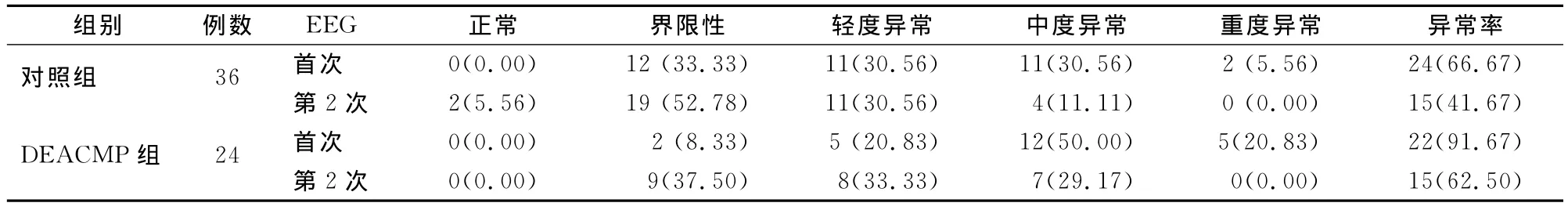
表2 两组EEG检查结果比较[n(%)]

表3 DEACMP组EEG检测结果比较[n(%)]
3 讨论
CO中毒后可形成大量的碳氧血红蛋白(HbCO),造成低氧血症和脑组织缺氧,引发脑局灶性缺血坏死[6]。DEACMP是CO中毒患者常见的神经系统并发症,主要引起大脑弥漫性损害,患者出现精神、智力和运动障碍[7]。关于其发病机制,多数学者认为与细胞毒性、脑微循环障碍、再灌注和自由基损伤、脑组织变态反应、一氧化氮(NO)介导的损伤机制等多因素协同作用有关[8-9]。此外,免疫功能紊乱和多巴胺、5-羟色胺、乙酰胆碱等神经递质代谢异常也参与了CO介导的病理损伤[10-11]。研究[12]报道,DEACMP患者反应迟钝等首发症状与大脑皮质、深部灰质核团及海马对缺血缺氧敏感有关。本研究CO中毒患者中有24例发生DEACMP,以精神、智力障碍为主要临床表现,与上述研究一致。另外,本研究发现,对照组与DEACMP组在中毒程度及昏迷时间方面的差异无统计学意义(P>0.05),提示昏迷时间长短只能说明中毒程度,而根据中毒程度无法判断是否会发生DEACMP,应在症状缓解或消失后,及时进行EEG以及CT跟踪检查,以排除“假愈”现象。
急性CO中毒后,大脑半球广泛性缺血,血管内皮细胞损伤,大脑白质区由于血管分布较少,受损更严重,发生微血栓,最终导致白质弥漫性缺血缺氧,这一过程大约需要4周。高压氧治疗可加速体内CO清除,恢复血红蛋白携氧能力,加速脑组织恢复,而此过程较缓慢,部分患者由于治疗无进展或症状暂时缓解即停止高压氧治疗,因此极易造成DEACMP。本研究DEACMP患者脑部CT异常率明显高于对照组,表明DEACMP患者脑部损伤较非DEACMP患者严重,而高压氧治疗次数又少于非DEACMP患者,提示DEACMP可能与脑部损伤严重却终止治疗有关。
EEG是反映脑损害的常用电生理检测手段,其α节律频率减缓和α指数减小往往提示大脑功能异常。EEG轻度异常以θ慢波异常多见,其出现形式和持续时间能一定程度反映患者意识状态。中、重度中毒患者则以广泛性的δ波多见,以额、颞部为主,少部分慢波左右不对称,此时患者脑电活动低平,提示脑组织缺氧严重,广泛受累[13]。本研究DEACMP组和对照组首次EEG异常率分别为91.67%和66.67%,中、重度 EEG 异常率分别为70.83%和36.11%,提示中、重度EEG异常患者更易发生DEACMP。影像学研究[14]提示,CO中毒后并发DEACMP患者的大脑皮层和皮层下损害程度较未发生DEACMP患者严重。经过急救治疗后,两组EEG异常率均下降,中、重度患者δ慢波减少,以θ慢波占优势。DEACMP组“假愈期”除4例轻、中度EEG异常外,其余基本恢复正常,但DEACMP发病时EEG异常率明显上升,有广泛的慢波化和平坦化出现,少数患者出现棘波、棘慢复合波等,与曹月敏等[15]报道一致,提示患者预后差。因此若急性CO中毒患者症状缓解或消失,而EEG和头颅CT表现仍异常,则应高度警觉DEACMP的发生。
综上所述,EEG为无创、安全且价廉的检查方法,急性CO中毒EEG改变以广泛性不规则高幅慢波活动为主,部分患者经急救治疗后仍可发生DEACMP,其EEG表现与临床病程发展平行。对于CO中毒患者在高压氧治疗过程中,应加强中、重度异常患者的EEG动态检测,做到早期干预,有助于判断预后及指导治疗。
[1]Guzman JA.Carbon monoxide poisoning[J].Crit Care Clin,2012,28(4):537-548.
[2]Kudo K,Otsuka K,Yagi J,et al.Predictors for delayed encephalopathy following acute carbon monoxide poisoning[J].BMC Emerg Med,2014,14:3.
[3]王德军.急性一氧化碳中毒迟发性脑病发病机制研究进展[J].预防医学论坛,2007,39(18):345-347.
[4]Roohi F,Kula RW,Mehta N.Twenty-nine years after carbon monoxide intoxication [J].Clin Neurol Neurosurg,2001,103(2):92-95.
[5]杜好瑞,顾仁骏,李拴荣,等.急性一氧化碳中毒后迟发性脑病的危险因素及脑电图变化[J].临床神经病学杂志,2010,23(6):451-452.
[6]Betterman K,Patel S.Neurologic complications of carbon monoxide intoxication[J].Handb Clin Neurol,2014,120:971-979.
[7]Ozyurt G,Kaya FN,Kahveci F,et al.Comparison of SPECT findings and neuropsychological sequelae in carbon monoxide and organophosphate poisoning[J].Clin Toxicol(Phila),2008,46(3):218-221.
[8]Akyol S,Erdogan S,Idiz N,et al.The role of reactive oxygen species and oxidative stress in carbon monoxide toxicity:an in-depth analysis[J].Redox Rep,2014,19(5):180-189.
[9]Chang DC,Lee JT,Lo CP,et al.Hyperbaric oxygen ameliorates delayed neuropsychiatric syndrome of carbon monoxide poisoning[J].Undersea Hyperb Med,37(1):23-33.
[10]冯凯,郑志东,许贤豪,等.一氧化碳中毒迟发性脑病免疫学机制研究进展[J].中国现代神经疾病杂志,2014,14(10):858-860.
[11]Cakir Z,Aslan S,Umudum Z,et al.S-100beta and neuronspecific enolase levels in carbon monoxide-related brain injury[J].Am J Emerg Med,2010,28(1):61-67.
[12]丛树艳,吕丹,佡剑非,等.一氧化碳中毒迟发性脑病临床和MRI特点分析[J].中华神经医学杂志,2012,11(5):512-515.
[13]唐学军,曾小虎,杨红霞,等.对急性CO中毒后迟发性脑病脑电图的观察及其临床意义探讨[J].中国医师杂志,2010,12(4):530-531.
[14]周伟,王晓莉,吴永斌.急性一氧化碳中毒后迟发性脑病的临床与头颅磁共振变化[J].疑难病杂志,2011,10(1):53.
[15]曹月敏,王小强,白丽华,等.脑电图对一氧化碳中毒迟发脑病的诊断与预后判断的临床分析[J].现代中西医结合杂志,2012,21(2):161-162.
