流式细胞术分析比较癌症患者新鲜和冻存复苏后外周血淋巴细胞亚群的实验研究
2015-12-02魏天雪于鸿何春莹刘玉侠
魏天雪 于鸿 何春莹 刘玉侠
[摘要] 目的 建立标准化的实验和分析方法,采用流式细胞术比较分析癌症患者新鲜和冻存复苏后的外周血淋巴细胞亚群的差异。 方法 于2014年6~12月收集肺恶性肿瘤患者静脉血样本(2 mL/样本),每个样本取300 μL全血用于淋巴细胞亚群分析;剩余全血经裂解红细胞后冻存 (40%或90%胎牛血清)。30 d后复苏细胞,流式细胞术分析淋巴细胞亚群变化。 结果 复苏并培养24 h后,癌症患者PBMC的存活率分别为(67.70±2.80)%(90% FCS) 和(80.47±3.32)% (40% FCS,P=0.0069)。新鲜和冻存的的外周血CD3+、CD3+CD4+、CD3+CD8+、CD3-CD16+56+、CD3+CD16+56+和CD4+CD25+ T細胞的百分率之间无显著差异(P>0.05,n=8,40%FCS)。 结论 短期冻存癌症患者的PBMC可用于后续检测T淋巴细胞亚群,尤其对于晚期癌症患者而言,可避免多次采血造成的负担同时提高实验的一致性。此外,本实验建立的方法也可用于临床抗肿瘤免疫治疗和其他免疫监测。
[关键词] PBMC;细胞冻存和复苏;淋巴细胞亚群;流式细胞术
[中图分类号] R329.2;R697.3 [文献标识码] A [文章编号] 1673-9701(2015)29-0029-03
Comparative analysis of lymphocyte subsets between fresh and frozen cancer patients PBMC by flow cytometry
WEI Tianxue YU Hong HE Chunying LIU Yuxia
Jilin Tumor Institute, Changchun 130012,China
[Abstract] Objective To develop a protocol to comparative analysis of lymphocyte subsets between fresh and cryopreserved cancer patients PBMC for immunological studies by flow cytometry. Methods Blood samples (2 mL/sample) from lung malignant tumor patients were collected by venipuncture from June to December 2014. For each sample, 300 μL of fresh whole blood was immediately used for lymphocyte subsets analysis. While the remaining were lysed and the isolated PBMC were cryopreserved with 40% or 90% FCS. Following storage for 30 days, the samples were removed and quickly thawed in 37℃ water bath. After cultured for 24 h, the cells were stained with antibodys. The analysis was performed using an Epics XL/MCL flow cytometry(Beckman Coulter). Results After separating, the cell recovery of PBMC was(67.70±2.80)% of 90% FCS vs (80.47±3.32)% of 40% FCS(P=0.0069). There were no significant differences in the frequencies of CD3+,CD3+CD4+,CD3+CD8+,CD3-CD16+56+,CD3+CD16+56+,and CD4+CD25+ T cells between the fresh and frozen PBMC(P>0.05,n=8,40% FCS). Conclusion The results of the present study suggest that frozen PBMC may be used to evaluate T cell subset frequencies and facilitate longitudinal assays on the same subject,especially in elderly frail malignant tumor patients. This protocol allows assays to be performed in batches with an adequate control. In addition, the approach we developed here can be further applied to clinical use involved in antitumor immunotherapy and immunosurveillance.
[Key words] Peripheral blood mononuclear cell; Cell cryopreservation and recovery; Lymphocyte subsets; Flow cytometry
恶性肿瘤患者常伴有免疫功能紊乱[1],临床检测患者的各淋巴细胞亚群的表型和功能,对于评估患者的自身免疫状态、配合制定临床治疗方案,具有重要的实践意义[2]。此外,检测淋巴细胞亚群也可以帮助深入分析免疫细胞的分化途径及其免疫反应中的作用,对于从基础研究到临床应用免疫治疗也具有重要的指导作用[1]。本研究采用流式细胞技术检测癌症患者外周血中CD3+、CD4+、CD8+及NK细胞(自然杀伤细胞),调节性T细胞(CD4+ CD25+)的百分比,并与同一样本经冻存复苏后的检测结果进行比较,旨在建立简便可行的方法动态监测淋巴细胞亚群变化,进而将这一技术方法应用于临床免疫治疗中,以减轻肿瘤患者在接受治疗和监测过程中的负担[3]。
1 材料与方法
1.1 实验材料
IMDM培养基(Gibco)、DMSO (Gibco)、胎牛血清 (Hyclone)、CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5 (6607013)、CD3-FITC/CD16+56-PE(A07735)、CD4-FITC(A07750)、CD25-PE (A07774),OptiLyse@C Lysis Solution(A11895)均为Beckman Coulter公司产品。
1.2 标本采集和处理
血液样本来自吉林省肿瘤醫院于2014年6~12月的住院患者,取经诊断为肺腺癌的患者静脉血2 mL,EDTA(乙二胺四乙酸)钾盐抗凝,立即送检。实验室做好样本的登记和编号,在流式试管内加相应抗体10 μL,加入待测血100 μL,混匀后室温避光20~30 min充分反应。加OptiLyse@C Lysis Solution震荡混匀,加磷酸盐缓冲液和甲醛固定液,震荡混匀后上机检测。采用Beckman Coulter Epics XL-MCL流式细胞仪检测外周血中CD3+、CD3+CD4+、CD3+CD8+、CD3+CD16+56+、CD3-CD16+56+、CD4+ CD25+细胞的百分率。Expo32 ADC软件获取数据,收集5000~10000个细胞,Expo32 V1.2软件分析数据。
1.3 PBMC的冻存[4]
将上述每个样本中剩余的外周血在无菌条件下,置于10 mL无菌离心管中,加入8 mL红细胞裂解液 (自制),混匀待红细胞裂解后,300×g离心5 min,弃上清,用生理盐水洗1遍,计数并调整细胞浓度为5×106/mL,用配置好的冻存液(40%/90% FCS,10% DMSO)悬浮细胞,-20℃中放置4 h后,-80℃冻存备用。
1.4 PBMC的复苏
冻存1个月的外周血PBMC于37℃水浴迅速复苏,生理盐水洗一遍后,用含有10%胎牛血清的IMDM培养基悬浮细胞,37℃、5%CO2饱和湿度条件下培养24 h,300×g离心5 min,台盼蓝拒染法计数活细胞并调整细胞浓度为1×106/mL,按1.2所述方法标记细胞并上机检测。
1.5 统计学方法
采用SPSS17.0统计学软件分析采用,计量资料比较采用配对t检验,组间比较采用t检验,以(x±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 PBMC冻存前后细胞存活率的比较
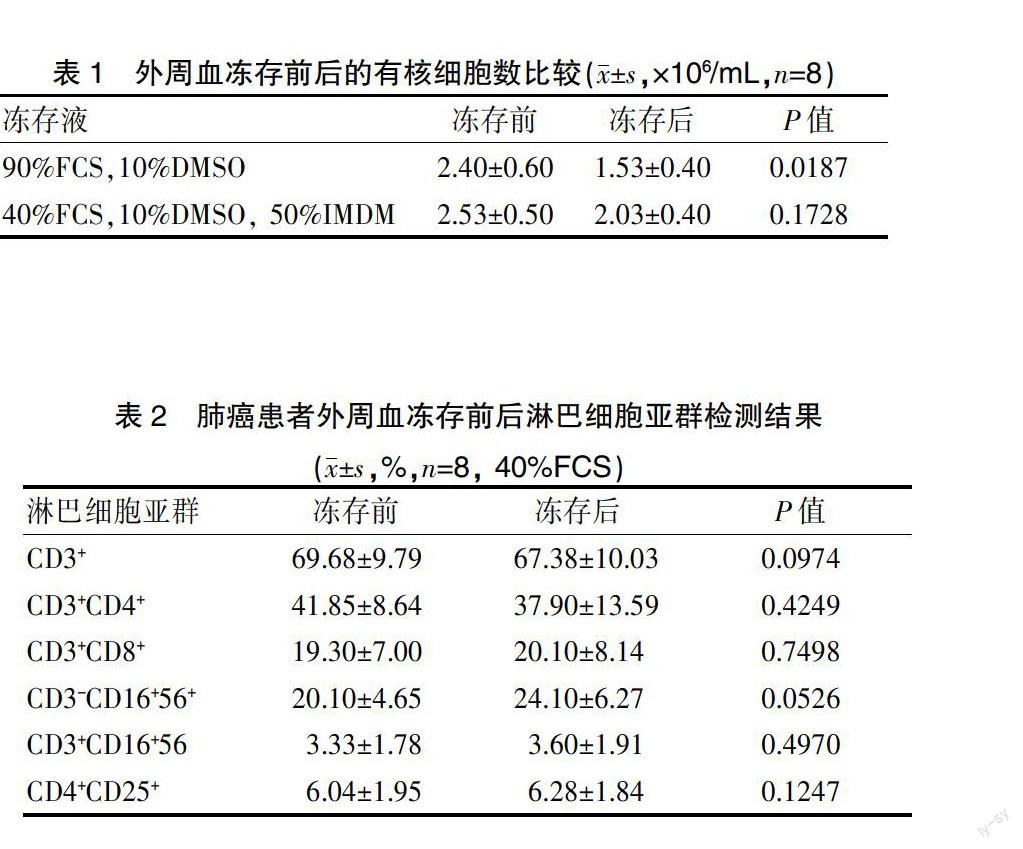
本研究中冻存PBMC所用的FCS浓度分别为40%和90%,本实验比较了含两种浓度FCS的冻存液对PBMC的保护作用。表1总结了肺癌患者外周血冻存前后的有核细胞数变化情况。细胞复苏并培养24 h后,癌症患者PBMC的存活率分别为 (67.70±2.80)% (90% FCS)和(80.47±3.32)%(40% FCS),二者比较差异有统计学意义(P=0.0069),提示40℅FCS+10%DMSO+50%IMDM冻存液对于短期保存PBMC效果较好,可应用于后续的其他实验。
表1 外周血冻存前后的有核细胞数比较(x±s,×106/mL,n=8)
2.2 PBMC冻存前后淋巴细胞亚群分布的比较
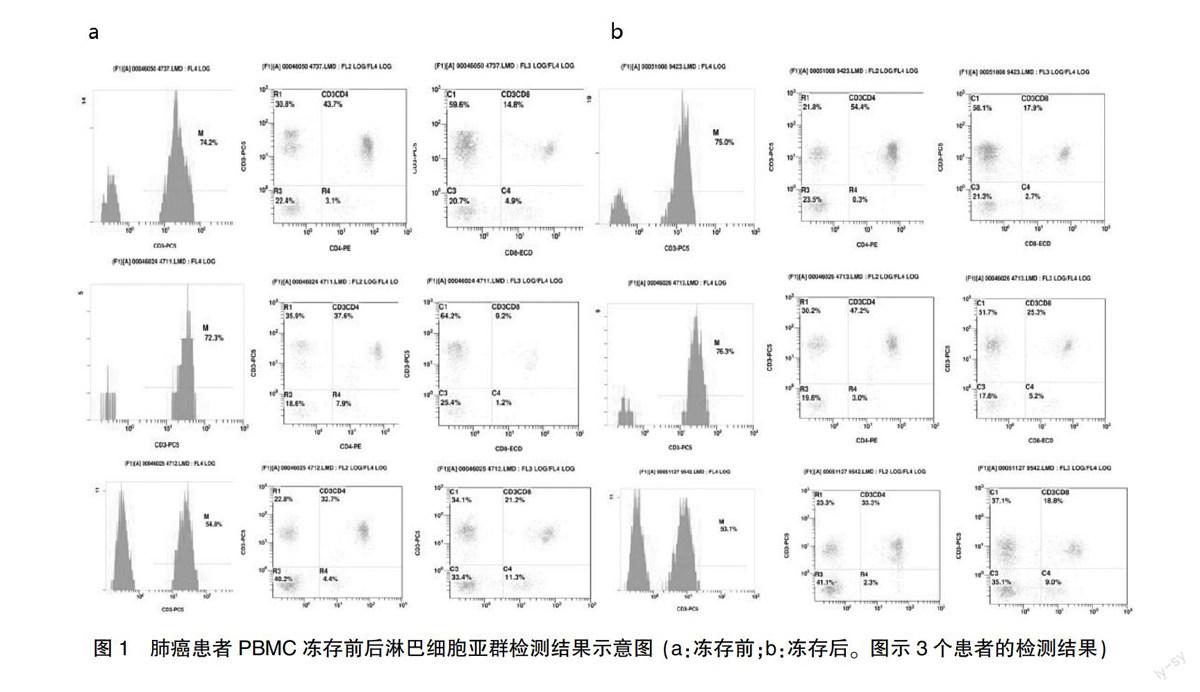
表2总结了新鲜和冻存复苏后的肺癌患者外周血CD3+总T淋巴细胞、CD3+CD4+ T辅助/诱导细胞、CD3+CD8+ 抑制/细胞毒细胞、CD3-CD16+56+ NK细胞、CD3+CD16+56+ NK样T淋巴细胞、调节性T细胞(CD4+ CD25+)的百分率,经统计分析冻存前后各项检测指标之间无显著差异。各参数的平均荧光强度之间也没有显著差异 (图1)。
表2 肺癌患者外周血冻存前后淋巴细胞亚群检测结果
(x±s,%,n=8, 40%FCS)
3 讨论
机体的免疫功能异常与恶性肿瘤的发生、发展、转移及预后密切相关,在抗肿瘤免疫应答中也起着重要作用[5]。淋巴细胞亚群是反映细胞免疫功能的重要指标,其中T细胞起中心调控作用,CD3+总T细胞又分为CD4+辅助/诱导细胞和CD8+抑制/细胞毒细胞。此外,NK细胞、巨噬细胞等其他细胞也具有重要的免疫调节作用。临床检测癌症患者各淋巴细胞亚群的表达水平,可以动态分析临床治疗过程中患者机体免疫功能的变化,尤其对于应用免疫疗法的患者而言,客观评价免疫治疗的临床疗效一直是我们需要面对的关键问题[6]。
细胞冻存是细胞保存的主要方法之一,利用冻存技术可以使细胞保持生长活力和特性不变。已有的报道对于PBMC的冻存方法有多种,本实验在查阅大量文献的基础上[7-10],采用90%FCS+10%DMSO和40%FCS+10%DMSO+50%IMDM这两种不同的冻存液对外周血PBMC进行冻存,一个月后复苏细胞,经活细胞计数和流式检测分析淋巴细胞亚群在冻存前后的变化,结果表明40℅FCS+10℅DMSO+50℅IMDM冻存液回收细胞效率较好,冻存对外周血细胞数没有明显影响,并且冻存前后CD3+、CD3+ CD4+、CD3+ CD8+和NK等细胞百分率也没有明显变化。说明我们建立的方法简便易行,可后续用于实际临床监测和抗肿瘤免疫治疗中。
近年来肿瘤生物治疗研究得到广泛关注,主要集中在树突状细胞、细胞因子诱导的杀伤细胞(CIK)、NK细胞、TIL细胞(肿瘤浸润细胞)、CAR-T细胞(嵌合抗原受体T细胞)等抗肿瘤免疫效应细胞的诱导、扩增和回输等。临床治疗能否有效首先在于获得足量、高活性的免疫效应细胞。肿瘤患者往往免疫系统受到抑制,细胞免疫功能低下,尤其是晚期患者,自体的PBMC在数量和质量上都难以体外扩增免疫效应细胞,影响了生物治疗的进行。本研究建立的方法可用于冻存患者PBMC,在患者状况良好时采集和冻存PBMC,然后按照临床治疗方案,适时复苏用于诱导扩增免疫效应细胞;也可以用此方法冻存经诱导、扩增后的各种免疫效应细胞,择机回输,为肿瘤患者实施个体化治疗[11]。本实验在此基础上检测了肿瘤患者诱导培养的CIK细胞冻存前后表型和体外抗肿瘤活性变化,也获得了预期实验结果(另文报道)。
目前,臨床还没有特定的预测免疫反应的参数和分析方法,根据SITC/FDA/NCI的推荐和共识,现在主要的免疫学评价包括评价抗原特异性T细胞的存在、频率和功能;非抗原特异性淋巴细胞,如NK细胞的频率和活化;调节性细胞,如Tregs和MDSCs的频率和功能以及抗体的检测等。具体指标包括T细胞亚群、T细胞分化状态、T细胞浸润的瘤内标记、免疫抑制分子(诱导型一氧化氮合酶、PD-L1/B7H1和STAT3等)、IFN-γ(γ干扰素)、VEGF(血管内皮生长因子)、LDH(乳酸脱氢酶)、趋化因子等[12-14]。本实验只是检测了各淋巴细胞亚群的相对比例,没有分析其绝对值和功能,因此尚需进一步完善实验设计、建立标准化操作规程、扩大检测指标范围、延长PBMC冻存时间、培训出有经验的技术人员,以尽早为临床免疫治疗和免疫监测提供方法和实验依据。
[参考文献]
[1] Shah W,Yan X,Jing L,et al. A reversed CD4/CD8 ratio of tumor-infiltrating lymphocytes and a high percentage of CD4(+)FOXP3(+) regulatory T cells are significantly associated with clinical outcome in squamous cell carcinoma of the cervix[J]. Cell Mol Immunol,2011,8(1):59-66.
[2] Chattopadhyay PK,Gierahn TM,Roederer M,et al. Single-cell technologies for monitoring immune systems[J]. Nat Immunol,2014,15(2):128-135.
[3] Aghaeepour N,Finak G,FlowCAP Consortium,et al. Critical assessment of automated flow cytometry data analysis techniques[J]. Nat Methods,2013,10(3):228-238.
[4] Stanke J,Hoffmann C,Erben U,et al. A flow cytometry-based assay to assess minute frequencies of CD8+ T cells by their cytolytic function[J]. J Immunol Methods,2010, 360(1-2):56-65.
[5] Domagala-Kulawik J. The role of the immune system in non-small cell lung carcinoma and potential for therapeutic intervention[J]. Transl Lung Cancer Res,2015,4(2):177-190.
[7] Nishino M,Jagannathan JP,Krajewski KM,et al. Personalized tumor response assessment in the era of molecular medicine:Cancer-specific and therapy-specific response criteria to complement pitfalls of RECIST[J]. AJR Am J Roentgenol,2012,198(4):737-745.
[8] Dey-Hazra E,Hertel B,Kirsch T,et al. Detection of circulating microparticles by flow cytometry:influence of centrifugation,filtration of buffer,and freezing[J]. Vasc Health Risk Manag,2010,6:1125-1133.
[9] Cao LF,Krymskaya L,Tran V,et al. Development and application of a multiplexable flow cytometry-based assay to quantify cell-mediated cytolysis[J]. Cytometry A,2010,77(6):534-545.
[10] Kalina T,Flores-Montero J,van der Velden VH,et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols[J]. Leukemia,2012,26(9):1986-2010.
[11] Wang WJ,Tao Z,Gu W,et al. Variation of blood T lymphocyte subgroups in patients with non- small cell lung cancer[J]. Asian Pac J Cancer Prev,2013,14(8):4671-4673.
[12] Zaritskaya L,Shafer-Weaver KA,Gregory MK,et al. Application of a flow cytometric cytotoxicity assay for monitoring cancer vaccine trials[J]. J Immunother,2009,32(2):186-194.
[13] Britten CM,Gouttefangeas C,Welters MJ,et al. The CIMT-monitoring panel:a two-step approach to harmonize the enumeration of antigen-specific CD8+ T lymphocytes by structural and functional assays[J]. Cancer Immunol Immunother,2008,57(3):289-302.
[14] Karag?觟z B,Bilgi O,Gümüs M,et al. CD8+CD28-cells and CD4+CD25+ regulatory T cells in the peripheral blood of advanced stage lung cancer patients[J]. Med Oncol,2010,27(1): 29-33.
[15] Chen C,Chen D,Zhang Y,et al. Changes of CD4+CD25+FOXP3+ and CD8+CD28-regulatory T cells in non-small cell lung cancer patients undergoing surgery[J]. Int Immunopharmacol,2014,18(2):255-261.
(收稿日期:2015-06-26)
