腹腔注射血必净对脓毒症急性肾损伤大鼠肾功能的影响及机制探讨
2015-12-02程星曹丽萍乔佑杰王永明
程星,曹丽萍,乔佑杰,王永明
(1天津医科大学,天津 300070;2天津市人民医院;3天津医院)
脓毒症是危重病患者常见死亡病因,而急性肾损伤是脓毒症常见及严重的并发症,脓毒症合并急性肾损伤时病死率明显增加[1]。研究[2]表明,脓毒症并发急性肾损伤的病死率为74.5%,而不伴有急性肾损伤的病死率为45.2%。脓毒症是严重的全身炎症反应综合征,是促炎反应与抑炎反应失衡的结果。巨噬细胞移动抑制因子(MIF)是一种重要的炎症因子,参与脓毒症多脏器功能不全综合征(MODS)及急性肾损伤的发病过程。2013年6~12月,我们观察了血必净对脓毒症急性肾损伤大鼠肾功能的影响,并探讨其可能机制。
1 材料与方法
1.1 主要试剂及仪器 大鼠MIF酶联免疫吸附试验(ELISA)试剂盒、TRIzol购自天津灏洋有限公司,实时定量PCR仪购自杭州博日科技有限公司。
1.2 实验动物及分组 雄性SD大鼠80只,8~10周龄,体质量200~220 g,购自北京大学医学部实验动物中心。按照随机原则分为对照组16只、模型组32只、干预组32只。
1.3 模型制备及血必净干预 动物购置后适应性饲养1周,实验前禁食过夜,自由饮水。模型组及干预组依照Chaudrv等报道的方法进行盲肠结扎穿孔术复制脓毒症动物模型。10%水合氯醛腹腔注射麻醉,麻醉后固定,常规消毒,铺无菌洞巾,沿腹正中线作1.5 cm切口,找到盲肠,在盲肠根部进行结扎,避免结扎回肠以及盲肠系膜血管,用16号穿刺针贯通穿刺盲肠2次,并留置一条橡皮片贯通盲肠,防止针孔闭合,最后将盲肠还纳腹腔,逐层缝合腹壁切口。术毕立即在动物皮下注射生理盐水5 mL,以补充术中体液丢失并防止休克,术后自由饮水。对照组麻醉固定后,常规消毒,铺无菌洞巾沿腹部正中线作1.5 cm切口,打开腹腔,找到盲肠,翻动肠管,然后还纳腹腔,其他与模型组、干预组操作一致。对照组及模型组于术后开始腹腔注射生理盐水4 mL/kg,干预组于术后开始腹腔注射血必净4 mL/kg,均为每12 h给药1次,直至动物死亡或实验结束。
1.4 血清肌酐(Cr)、MIF及肾组织MIF mRNA检测 实验动物分别在术后2、8、24、48 h处死(对照组每个时点处死4只,模型组及干预组每个时点处死8只),留取心脏血5 mL,静置20 min,台式离心机以3 000 r/min离心15 min,收集血清,-80℃冰箱保存,使用Beckman CoulterDxc800型自动生化分析仪测定血清Cr,采用ELISA法测定血清MIF。称取肾组织100 mg作为组织标本,用磷酸盐缓冲液进行冲洗,用液氮保存标本,并制备肾组织匀浆,应用实时定量PCR反应检测肾组织MIF mRNA。引物由上海生物工程有限公司合成。首先进行肾组织总RNA的制备,然后制备cDNA模板,确定目的基因退火温度,进行实时定量 PCR反应,反应条件:95℃预变性10 min;94℃变性20 s,59℃退火20 s,40个循环;57~96℃绘制熔解曲线。按RTQ-PCR说明书将各个标本的实时定量PCR结果以经β-actin校正后,应用2-ΔΔCt计算后的比率值表示基因表达的相对变化。
1.5 统计学方法 采用SPSS17.0统计软件。连续型数据服从正态分布者以±s表示,组内不同时间点比较及组间同一时间点比较均采用单因素方差分析,两两比较采用SNK检验,对检测指标做Pearson直线相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠术后不同时点血清Cr、MIF水平及肾组织MIF mRNA表达比较 结果见表1。
表1 各组大鼠术后不同时点血清Cr、MIF水平及肾组织MIF mRNA 表达比较( ± s)
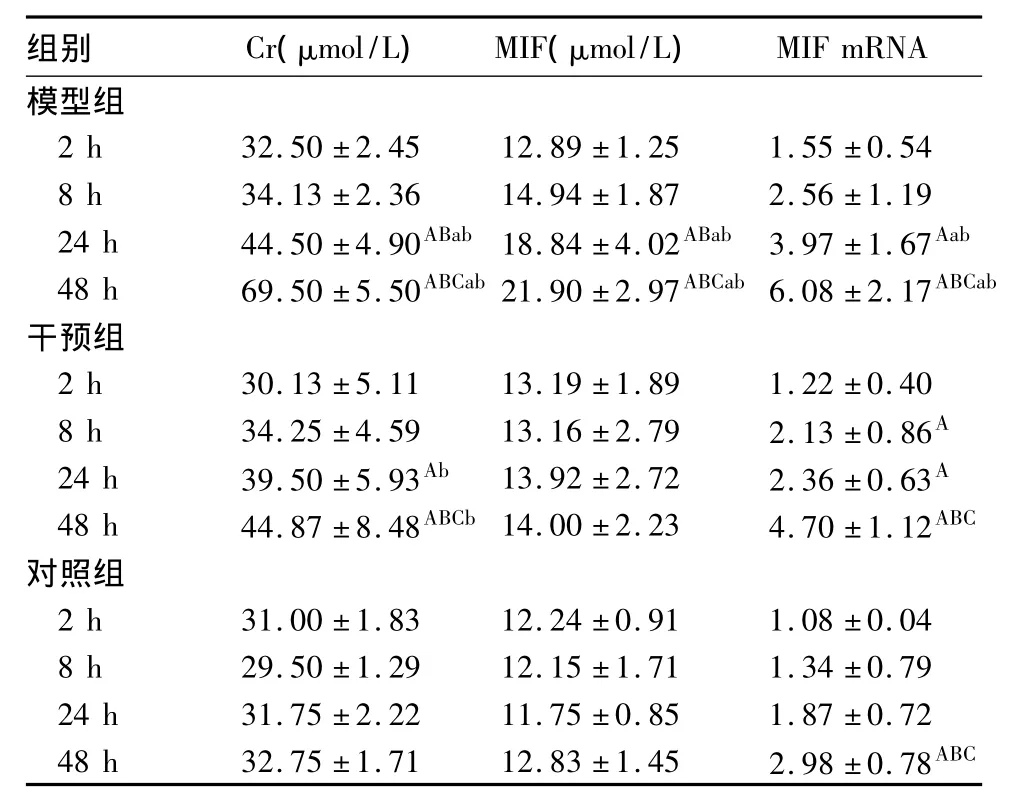
表1 各组大鼠术后不同时点血清Cr、MIF水平及肾组织MIF mRNA 表达比较( ± s)
注:与同组术后2 h比较,AP<0.05;与同组术后8 h比较,BP<0.05;与同组术后24 h比较,CP <0.05;与干预组比较,aP <0.05;与对照组比较,bP <0.05。
组别 Cr(μmol/L) MIF(μmol/L)MIF mRNA模型组2 h 32.50 ±2.45 12.89 ±1.25 1.55 ±0.54 8 h 34.13 ±2.36 14.94 ±1.87 2.56 ±1.19 24 h 44.50 ±4.90ABab 18.84 ±4.02ABab 3.97 ±1.67Aab 48 h 69.50 ±5.50ABCab21.90 ±2.97ABCab6.08 ±2.17ABCab干预组2 h 30.13 ±5.11 13.19 ±1.89 1.22 ±0.40 8 h 34.25 ±4.59 13.16 ±2.79 2.13 ±0.86A 24 h 39.50 ±5.93Ab 13.92 ±2.72 2.36 ±0.63A 48 h 44.87 ±8.48ABCb14.00 ±2.23 4.70 ±1.12ABC对照组2 h 31.00 ±1.83 12.24 ±0.91 1.08 ±0.04 8 h 29.50 ±1.29 12.15 ±1.71 1.34 ±0.79 24 h 31.75 ±2.22 11.75 ±0.85 1.87 ±0.72 48 h 32.75 ±1.71 12.83 ±1.45 2.98 ±0.78ABC
2.2 大鼠血清MIF、肾组织MIF mRNA与血清Cr水平的关系 血清MIF水平与血清Cr水平呈正相关(r=0.641,P<0.05),肾组织 MIF mRNA 与血清Cr水平呈正相关(r=0.696,P<0.05)。
3 讨论
脓毒症是胰腺炎、创伤、烧伤等临床危重患者的严重并发症之一,也是诱发MODS的重要病因。脓毒症的发病与感染、炎症反应、免疫功能紊乱、凝血功能障碍等因素密切相关,其中炎症反应是最主要环节。机体产生大量炎症介质,形成炎症瀑布效应,造成MODS。多种因素可导致急性肾损伤,包括肾血流量的减少、肾脏毒性药物的使用及近端小管的细胞损伤或细胞凋亡以及肾脏细胞的炎症反应[3],其中脓毒症导致的急性肾损伤约占50%[4]。脓毒症时,中性粒细胞、单核巨噬细胞、血管内皮细胞发生复杂的免疫应答反应,释放出大量炎症介质,从而造成肾脏损害。2005年9月在阿姆斯特丹举行的急性肾衰竭国际研讨会提出了急性肾损伤分期[5],以血Cr水平为标准,分为3期,即1期为血清Cr升高>0.3 mg/dL或增加 >50%,2期为 Cr升高 >200% ~300%,3期为 Cr增加 >300% 或 >4.0 mg/dL(急性升高 >0.5 mg/dL),表明 Cr水平可评价急性肾损伤严重程度。本研究显示,模型组术后24、48 h血清Cr水平高于对照组,提示模型组大鼠已存在急性肾损伤。血必净具有清除炎症介质的作用,有研究表明血必净可通过抑制MIF的合成与释放,降低MIF水平[6],有效地防止肾组织炎症反应的发生、发展,进而减轻急性肾损伤程度[7]。本研究显示,干预组术后24、48 h Cr水平低于模型组,提示术后经血必净干预后,脓毒症急性肾损伤大鼠肾功能得到改善。
多项研究表明,MIF是一种晚期促炎因子,参与脓毒症MODS的发病过程[8],且与脓毒症的严重程度及预后有关,并可预测患者死亡及预后[9,10]。敲除了MIF基因的小鼠对炎症的免疫应答则明显减弱[11],使用抗 MIF因子可明显降低脓毒症大鼠MODS 的发生率及病死率[12]。张振辉等[13]研究表明,MIF作为晚期炎性介质参与脓毒症急性肾损伤的发病过程。Payen[5]研究也表明,脓毒症患者中,MIF水平随着肾损伤严重程度的加重而升高。本研究显示,模型组术后24、48 h血清MIF水平及肾组织MIF mRNA高于对照组,而干预组术后24、48 h血清MIF水平及肾组织MIF mRNA低于模型组,且血清MIF水平、肾组织MIF mRNA均与血清Cr水平呈正相关,提示急性肾损伤严重程度与血清MIF、肾组织MIF mRNA水平有密切关系,血必净可能是通过降低血清MIF及肾组织MIF mRNA而达到改善脓毒症急性肾损伤大鼠肾功能的作用。
[1]Kim WY,Huh JW,Lim CM,et al.A comparison of acute kidney injury classications in patients with severe sepsis and septic shock[J].Am J Med Sci,2012,344(5):350-356.
[2]Van Biesen W,Van Massenhove J,Lameire N,et al.Does urinary neutrophil gelatinase-associated lipocalin really solve the issue of discriminating prerenal from intrinsic acute kidney injury[J].Kidney Int,2012,81(3):321-322.
[3]Dennen P,Douglas IS,Anderson R.Acute kidney injury in the intensive care unit:an update and primer for the intensivist[J].Crit Care Med,2010,38(1):261-275.
[4]Chvojka J.New developments in septic acute kidney injury[J].Physiol Res,2010,59(6):859-869.
[5]Payen D.Lukaszewicz AC,Leqrand M,et al.A multicentre study of acute kidney injury in severe sepsis and septic shock:association with inflammatory phenotype and HLA genotype[J].PLoS One,2012,7(6):e35838.
[6]急性肾损伤专家共识小组.急性肾损伤诊断与分类专家共识[J].中华肾脏病杂志,2006,22(11):661-663.
[7]王文欣,李志军.血必净对脓毒症SD大鼠巨噬细胞移动抑制因子的影响[J].黑龙江医学,2014,38(12):1341-1343.
[8]马艳梅.脓毒症大鼠肺损伤时肺组织巨噬细胞移动抑制因子变化及丙酮酸乙酯的干预作用[J].中华老年多器官疾病杂志,2009,8(2):161-165.
[9]Brenner T,HoferS,Rosenhagen C,et al.Macrophage migration inhibitory factor(MIF)and manganese superoxide dismutase(Mn SOD)as early predictors for survival in patients with severe sepsis or septic shock[J].J Surg Res,2010,164(1):163-171.
[10]Chuang TY,Chang HT.High levels of serum macrophage migration inhibitory factor and interleukin 10 are associated with a rapidly fatal outcome in patients with severe sepsis[J].Int J Infect Dis,2014,20(3):13-17.
[11]Ohkawara T.Lack of macrophage migration inhibitory factor suppresses innate immune response in murine dextran sulfate sodiuminduced colitis[J].Scand J Gastroenterol,2008,43(12):1497-1504.
[12]Tohyama S.A novel DNA vaccine-targeting macrophage migration inhibitory factor improves the survival of mice with sepsis[J].Gene Ther,2008,15(23):1513-1522.
[13]张振辉,林珮仪,陈晓辉,等.脓毒症小鼠心和肾组织中巨噬细胞移动抑制因子的表达[J].中国急诊医学杂志,2009,18(11):1159-1162.
