顺铂与紫杉醇联合应用对小鼠宫颈癌组织中Bcl-2、Bax、Caspase-9 表达的影响
2015-12-02黄彤辉
黄彤辉
(南华大学附属南华医院,湖南 衡阳 421001)
联合化疗可显著提高单个化疗药物的抗肿瘤效力,同时可明显减轻化疗药物的毒性反应。紫杉烷类与铂类之间存在交互作用,其合并效应呈现出不同程度的相加。目前,顺铂(DDP)和紫杉醇(TXL)联合化疗已成为治疗宫颈癌常用的化疗方案。小剂量DDP和TXL联合化疗方案的抗癌作用与肿瘤细胞凋亡是否有关未见相关报道。以往研究显示,DDP和TXL联合化疗对小鼠宫颈癌细胞有促凋亡作用,但其相关机制鲜有报道。本研究观察了DDP联合TXL化疗对小鼠宫颈癌细胞Bcl-2、Bax、半胱氨酸蛋白酶9(Caspase-9)表达的影响,进一步讨论DDP、TXL联合化疗对小鼠宫颈癌细胞促凋亡作用的可能机制。
1 材料与方法
1.1 细胞株及实验动物 小鼠宫颈癌U14细胞株。实验用615小鼠32只,雌性13只,雄性19只;18~22 g,4~6周;DDP每支 10 mg、TXL每支30 mg;小鼠Bcl-2、Bax单克隆抗体及兔 Caspase-9多克隆抗体。
1.2 模型制备及顺铂、紫杉醇干预 每只小鼠右腋窝皮下接种0.1 mL(1×106个宫颈癌U14细胞),接种10 d后,可扪及皮下结节状瘤体。当小鼠皮下结节状瘤体直径约6 mm(100 mm3)且无并发症即可入选注药。小鼠随机分为A组9只、B组9只、C组10只、D组10只。A组小鼠皮下注射生理盐水0.2 mL,每6天1次。B组小鼠皮下注射DDP 4 mg/(kg·mL),每6天1次。C组小鼠腹腔注射TXL 50 mg/(kg·mL),每周1次。D组小鼠皮下注射DDP 4 mg/(kg·mL),每6 天1 次;TXL 50 mg/(kg·mL),每周1次;第1次注射时先注射TXL后注射DDP,其后两药序贯用药。待各组中出现第1只小鼠死亡为治疗终止时间点,处死全部实验用小鼠,切除完整肿瘤组织,用10%中性甲醛溶液浸泡固定,乙醇梯度脱水后石蜡包埋,常规切片(4 μm 厚)。
1.3 宫颈癌组织Bcl-2、Bax、Caspase-9检测 采用免疫组化SP法。用PBS液代替一抗作阴性空白对照。Bcl-2、Bax及Caspase-9一抗工作浓度分别为1∶150、1∶100、1∶100。以 PBS 代替一抗作为空白对照。一抗孵育4℃过夜,镜下控制染色,Bcl-2、Bax及Caspase-9阳性反应均表现为定位于胞膜和胞质内棕黄色或棕褐色细小颗粒。每张免疫组化片随机选取10个高倍视野,使用免疫组化图像分析软件测其积分光密度值并取其平均值,以积分光密度值反映 Bcl-2、Bax、Caspase-9 表达情况。
1.4 统计学方法 采用SPSS13.0统计软件。计量资料以±s表示,多组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
各组宫颈癌组织Bcl-2、Bax、Caspase-9表达比较见表1。
表1 各组宫颈癌组织Bcl-2、Bax、Caspase-9表达比较( ± s)
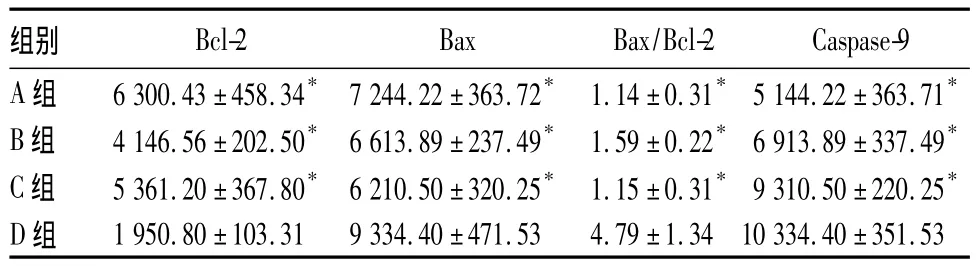
表1 各组宫颈癌组织Bcl-2、Bax、Caspase-9表达比较( ± s)
注:与 D 组比较,*P <0.05。
组别Bcl-2 Bax Bax/Bcl-2 Caspase-9 A 组 6 300.43 ±458.34* 7 244.22±363.72* 1.14 ±0.31* 5 144.22 ±363.71*B 组 4 146.56 ±202.50* 6 613.89±237.49* 1.59 ±0.22* 6 913.89 ±337.49*C 组 5 361.20 ±367.80* 6 210.50±320.25* 1.15 ±0.31* 9 310.50 ±220.25*D 组 1 950.80 ±103.31 9 334.40±471.53 4.79 ±1.34 10334.40 ±351.53
3 讨论
联合、间隙、持续化疗为目前恶性肿瘤主要的抗癌方案。2014年FIGO指南指出,DDP和TXL联合化疗为宫颈癌的常用化疗方案[1]。目前研究认为,TXL通过结合到微管蛋白上,从而促进微管蛋白的聚合。DDP于1978年首先在美国批准于临床应用,为第一代铂类抗肿瘤药物,具有广谱的抗肿瘤作用,迄今为止是被公认为最有效的化疗药物之一,并被推荐用于复发或远处转移宫颈癌患者的一线单药化疗,DDP阻碍DNA合成及复制,从而抑制肿瘤细胞的生长[2]。细胞凋亡是一种或多种刺激因素诱发的程序性破坏过程,是由相关基因介导的细胞生理死亡方式,它对维持机体内外环境的恒定具有重要意义。生理性细胞凋亡对维持正常的生命活动是必需的,而药物诱导的病理性凋亡同样具有重要的临床意义。凋亡诱导产生的Caspase级联反应有两条信号转导途径,即内源性线粒体途径和外源性死亡受体途径。多数抗肿瘤药物即通过内源性线粒体途径发挥细胞毒性作用,最终导致细胞凋亡。
Bcl-2家族分为Bal-2和Bax两大亚族,Bal-2家族中包括Bax、Bak、Bad、Bid和 Bim,通过形成一个通道启动线粒体通透性转变孔改变膜对一些离子、小分子或蛋白质的通透性而参与细胞凋亡的调控。定位于内质网膜上的Bcl-2为公认的Bcl-2家族蛋白成员中主要抗凋亡分子。Bcl-2通过干扰细胞色素C及Ca2+的释放,降低核酸内切酶活性,导致细胞色素C无法达到激活下游胱冬肽酶的阈值,从而保护细胞器功能,抑制细胞凋亡。而Bax是促凋亡基因,Bax的N端暴露,引起细胞色素C和各种促凋亡因子的释放,最终导致细胞凋亡[3~7]。Bax/Bcl-2的比值决定了细胞是否凋亡。Caspase-9是天门冬氨酸蛋白酶家族中13种Caspase的主要成员之一,是线粒体凋亡途径的关键蛋白酶,处于凋亡的始动阶段,一旦被激活,即发生下游的级联反应,导致细胞凋亡[8~11]。Caspase-9主要在内源性细胞凋亡途径中活化,从而激活效应Caspase-3导致细胞凋亡。从阳性信号分布来看,Caspase-9主要位于肿瘤细胞质,从阳性表达率来看,Caspase-9在肿瘤细胞中的表达率与正常组织无差异。说明Caspase-9在正常组织中的表达也是一个经常性的事件。但是Caspase-9在抗癌治疗过程中表达量增加可能有助于此肿瘤的治疗,Caspase-9的高表达在促进细胞的凋亡中发挥重要作用[12,13]。本研究显示,与单用 DDP 或 TXL 相比,DDP联合TXL化疗可降低Bcl-2水平,增加Bax、Caspase-9表达及Bax/Bcl-2。
[1]FIGO committee on gynecologic oncology.FIGO staging for carcinoma of the vulva,cervix,and corpus uteri[J].Int J Gynecol Obstet,2014,125(8):97-98.
[2]Randina G,Distefano MG,De Vincenzo R,et al.Paclitaxel,epirubicin,andcisplatin(TEP)regimen as neoadjuvant treatment in locally advanced cervical cancer:long-term results[J].Gynecol Oncol,2013,128(3):518-523.
[3]Heiser D,Labi V,Erlacher M,et al.The Bcl-2 protein family and its role in the development of neoplastic disease[J].Exp Gerontol,2004,39(8):1125-1135.
[4]Eskes R,Desagher S,Antonsson B,et al.Bid induces theoligomerization and insertion of Bax into the outer mitochondrial membrane[J].Mol Cell Biol,2000,20(3):929-935.
[5]Kataoka T,Holler N,Micheau O,et al.Bcl-rambo,a novel Bcl-2 homologue that induces apoptosis via its unique C-terminal extension[J].J Biol Chem,2011,276(22):19548-19554.
[6] Cagnol S.Raf-1 activation prevents caspase 9 processing downstream of apoptosome formation[J].J Signal Transduct,2011,(2011):834948.
[7]胡向阳,孟刚,鲍扬漪,等.紫杉醇诱导Hela细胞凋亡及其与凋亡相关蛋白的关系[J].中国药理学通报,2004,20(9):1063.
[8]张斌,宋国华,王海龙.氟对体外培养的小鼠睾丸间质细胞增殖和细胞凋亡的影响[J].中国实验动物学报,2011,19(15):437-440.
[9]曹双双,苏安平,杜晓炯,等.Bcl-2在胰腺癌中的表达及其相关性研究[J].四川大学学报(医学版),2012,43(2):156-160.
[10]Fan TJ,Xia L,Han YR.Mitochondrion and apoptosis[J].Acta Biochim Biophys Sin,2011,33(1):7-12.
[11]岳原亦,张扬.Caspases家族与细胞凋亡[J].中国医疗前沿,2011,6(7):25-26.
[12]Singh SS,Kang PM.Mechanisms and inhibitors of apoptosis in cardiovascular diseases[J].Curr Pharm Des,2011,17(8):1783-1793.
[13]Brooks C,Dong Z.Regulation of mitochondrial morphological dynamics during apoptosis by Bcl-2 family proteins:a key in Bak[J].Cell Cycle,2007,6(11):30-43.
