Henderson-Hasselbalch方程在氨基酸盐两性解离教学中的应用
2015-12-02周向军
周向军
(天水师范学院 生物工程与技术学院,甘肃 天水 741001)
Henderson-Hasselbalch方程在氨基酸盐两性解离教学中的应用
周向军
(天水师范学院 生物工程与技术学院,甘肃 天水 741001)
分别以亮氨酸盐、组氨酸、谷氨酸及组氨酸盐酸盐的两性解离为例,利用Henderson-Hasselbalch方程对其不同离子形式的溶液pH、不同离子形式的浓度或相对比例及缓冲溶液的配置进行分析,为进一步理解氨基酸盐的解离过程及相关计算提供参考.
Henderson-Hasselbalch;氨基酸盐;两性解离
氨基酸的两性解离不仅是理解蛋白质众多理化性质和功能的基础,同时也是氨基酸分离和分析的基础,而氨基酸分离、分析则是氨基酸序列测定的必要步骤,[1]因此,正确理解氨基酸及其盐的两性解离,对于掌握蛋白质分离和分析、序列测定、结构和功能等具有一定的基础性作用.由于现有生物化学[1]和有机化学[2]教材对此部分内容的介绍较为模糊,学生对Henderson-Hasselbalch(HH)方程在不同氨基酸盐离子形式的溶液pH、浓度或相对比例及缓冲溶液的配置中的应用存在较大困难,因此,有必要对HH方程在氨基酸盐两性解离中的应用做进一步分析.
HH方程是化学中有关酸碱平衡的一个方程,该方程广泛应用于化学、医学和药学等方面,如缓冲液pH计算、弱电解质的各种离子的离子化程度、临床血液气体分析、输液药物溶解度与pH的关系及药物在机体内的吸收分布关系等生物药剂学领域.[3-4]李隽群[5]利用HH方程分析氨基酸、肽、蛋白质在溶液中带电状态,进一步解释其两性解离的原理;同时该作者认为正确理解氨基酸等两性物质带电状态,对相应的电泳图谱分析、离子交换层析或电泳分离分析均具有一定的指导作用.作者以亮氨酸盐、组氨酸、谷氨酸及组氨酸盐酸盐的两性解离为例,利用HH方程对不同氨基酸盐离子形式的溶液pH、浓度或相对比例及缓冲溶液的配置进行分析,希望能解决生物化学教学中存在的相关问题,为学生掌握不同氨基酸盐离子形式的溶液pH、浓度或相对比例及缓冲溶液的配置中的应用提供帮助.
1 利用HH方程分析0.3mol/L亮氨酸盐酸盐溶液、亮氨酸钠盐及等电点亮氨酸溶液pH[1]
α-COOH的pK1=2.36,α-NH2的pK2=9.60.
Leu解离简式为:

1.1亮氨酸盐酸盐溶液pH
亮氨酸盐酸盐为二元酸,此时-COOH的酸性远强于质子化-N+H3,故溶液的pH几乎完全取决于-COOH的解离程度,[H+]=[Leu0],[Leu+]=0.3-[H+].
根据解离平衡方程,
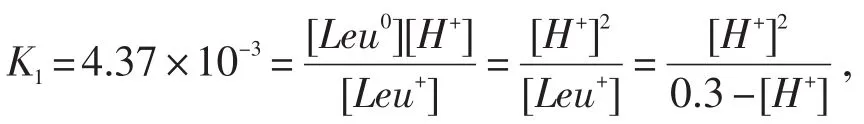
[H+]≈3.39×10-2mol/L,pH=1.47.同时也可知,亮氨酸盐酸盐在0.3mol/L溶液中解离11.3%.该过程也可简化为:即当以亮氨酸盐酸盐存在时,[Leu+]≫[Leu0],可认为[Leu+]=0.3mol/L,代入上式,得pH≈(pK1+lg0.3)/ 2=1.44.

1.2亮氨酸钠盐pH
亮氨酸钠盐为二元碱,此时-NH2的碱性远强于-COO-,故溶液的pH几乎完全取决于-NH2的解离程度,[OH-]=[Leu0],[Leu-]=0.3-[OH-].
根据解离平衡方程,
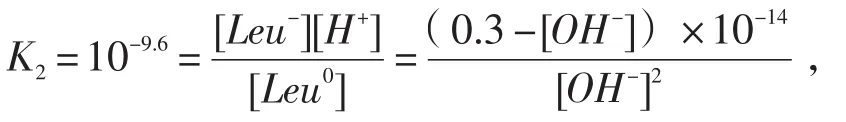
p[OH-]≈2.46,pH=14-2.46=11.54.可知亮氨酸钠盐在0.3mol/L溶液中解离1.16%.该过程也可简化为:即当以亮氨酸钠盐存在时,[Leu-]≫[Leu0],可认为[Leu-]= 0.3mol/L,代入上式,得p[OH-]≈-lg(0.3×10-14/10-9.60)/ 2≈2.46,pH=14-2.46=11.54.两种方法计算结果相同,这表明当以亮氨酸钠盐存在时,-COO-的碱性几乎可以完全忽略.
1.3等电点亮氨酸溶液pH
氨基酸的pI是指其解离生成的阳离子和阴离子程度相等时的溶液pH,也即两性离子达到最大值时的溶液pH,与浓度无关;而氨基酸水溶液的pH是指氨基酸在水溶液中解离生成的H+的负对数,与浓度有关.[7]利用下列公式[8]计算,[Leu0]水溶液的pH约为5.98.
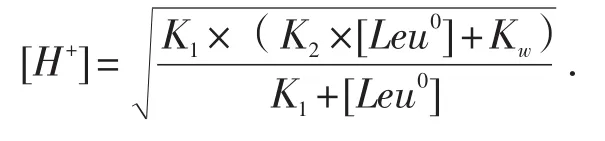
2 利用HH方程分析0.25mol/L pH6.4组氨溶液各种离子形式浓度[1]
在pH6.4时,可认为α-COOH完全未被质子化,同时携带一个单位负电荷,α-NH2被完全质子化且携带一个单位正电荷.因此,His的离子形式主要由咪唑基提供.当咪唑基被质子化时,His携带一个单位净正电荷,当其不被质子化时,His净电荷为零. α-COOH的pK1=1.82,咪唑基的pK2=6.0,α-N+H3的pK3=9.17,His解离简式为:

根据HH方程,可得出:
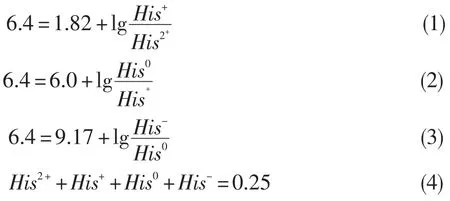
根据(1)、(2)、(3)和(4),求得His0=0.179mol/L,His+=0.071mol/L,His2+=1.87×10-6mol/L,His-=3.04× 10-4mol/L.同时可知,在pH6.4时,His不同离子形式的比例为His0=71.6%,His+=28.4%,His2+=0.00075%,His-=0.122%.
3 利用HH方程分析0.1mol/L Glu在等电点时的主要离子浓度
α-COOH的 pK1=2.19,α-NH2的 pK2=9.67,γ-COOH的pK3=4.25,pI=3.22.Glu解离简式为:

根据HH方程,可得出:

根据(5)、(6)、(7)和(8),求得Glu+=0.00786mol/L,Glu00.08427mol/L,Glu-=0.00786mol/L,Glu2-=2.79× 10-9mol/L.在Glu等电点时,不同离子形式的比例为Glu+=7.86%,Glu0=84.27%,Glu-=7.86%,Glu2-=0.01%.
4 利用HH方程分析用含一个结晶水的固体组氨酸盐酸盐(相对分子质量209.6;咪唑基pKa=6.0)和1mol/LKOH配制1LpH6.5mol/L组氨酸盐缓冲液[1]
His解离简式为:

配制1L pH6.5的浓度为0.2mol/L的组氨酸盐缓冲液,需要固体组氨酸盐酸盐的量为:209.6×0.2= 41.92g.加入KOH中和的H+主要来自His羧基的全部解离和咪唑基的部分解离.pH6.5时-COOH全部解离,故中和组氨酸盐酸盐的-COOH所释放的H+所需KOH的量等于His的物质的量,为0.2mol,即需1mol/ L的KOH溶液200mL;pH6.5时,咪唑基部分解离,其释放H+等于生成的His0的物质的量,所需KOH的物质的量可用HH方程计算:

5 总 结
1.3中等电点亮氨酸溶液pH的计算方法可行,与赵堂[9]的计算结果相吻合,即当[Leu0]=0.3>101.70× K1=10-0.66时,中性氨基酸水溶液pH=pI.赵堂[9]经过推导认为,中性氨基酸水溶液pH=pI所需满足的条件:两性离子的浓度大于101.70×K1.对于某一种给定的氨基酸,K1为定值,因此,浓度成为决定因素,即同等条件下有较大浓度或较高溶解度的氨基酸,其溶液的pH才有可能等于pI,否则其溶液的pH略大于pI.3的计算结果表明酸性氨基酸处于等电点时主要以两性离子为主,其两侧的离子浓度含量较低且相等,Glu2-含量可忽略不计.该结论同样适用于中性氨基酸和碱性氨基酸的相应分析,这对于进一步从具体事例角度理解酸性氨基酸和碱性氨基酸的pI只选择两性离子两侧的pKa具有一定意义.
以亮氨酸盐、组氨酸、谷氨酸及组氨酸盐为例,利用HH方程分别对其不同离子形式的溶液pH、不同离子形式的浓度或相对比例及缓冲溶液的配置进行分析.一般可按如下方法进行:首先查表获得各解离基团pK,然后根据可解离基团pK的大小,按照pK1<pK2<pK3正确书写氨基酸两性解离简式,即那个基团的pK越小,那个基团先解离.最后根据HH方程写出关系式并分析计算.
[1]王镜岩,朱圣庚,徐长法.生物化学[M].3版.北京:高等教育出版社,2002.
[2]汪小兰.有机化学[M].4版.北京:高等教育出版社,2004.
[3]杨左海.Henderson-Hasselbalch方程及其应用[J].大学化学,1997,12(1):56-59.
[4]曾令泽,高鸿慈,丁祯录.HH方程在生物药剂学中的应用[J].中国药学杂志,1985,20(5):287-290.
[5]李隽群.氨基酸、肽、蛋白质在溶液中带电状况分析[J].黔西南民族师范高等专科学校学报,2003,(1):72-77.
[6]南京大学《无机及分析化学》编写组.无机及分析化学[M]. 4版.南京:高等教育出版社,2004,344.
[7]张曙光,肖玉梅,赵士铎.氨基酸等电点与氨基酸水溶液pH的区别[J].大学化学,2005,20(5):47-51.
[8]彭崇慧,冯建章,张锡瑜,等.定量化学分析简明教程[M].2版.北京:北京大学出版社,1997.
[9]赵堂,韩晓霞.中性氨基酸水溶液pH值等于其pI的浓度条件及原因[J].固原师专学报(自然科学版),1998,19(3):37-39.
〔责任编辑 高忠社〕
The Application of Henderson-Hassebalch Equation in the Teaching of Amino Acid Salt Amphoteric Dissociation
Zhou Xiangjun
(School of Bioengineering and Technology,Tianshui Normal University,Tianshui Gansu741001,China)
Taking examples of amphoteric dissociation of leucine salt,histidine salt,glutamic acid salt,the paper analyses the ph,concentration,and relative proportion of solution of different types of icon forms,and the allocation of buffered solution with Henderson-Hasselbalch equation,providing references for further understanding of the amino acid salt sissociation process and the relevant calculation.
Henderson-Hasselbalch;amino acid salt;amphoteric dissociation
O6-041
A
1671-1351(2015)05-0118-03
2015-06-11
周向军(1980-),男,甘肃镇原人,天水师范学院生物工程与技术学院讲师,硕士。
