P27RF-Rho基因沉默对肝癌Bel7402细胞增殖的影响
2015-11-29邢光远谢淑丽王广义吕国悦郝恩源李丁洋
邢光远,谢淑丽,邱 伟,王广义,吕国悦,郝恩源,李丁洋
(吉林大学第一医院肝胆胰外科,吉林 长春 130021)
P27RF-Rho(p27kip1releasing factor from Rho A)是新近发现的调控肿瘤细胞中Rho GTPases(RhoA和RhoC)活性的分子,其由161个氨基酸组成,在N端有共同的NH2-MGCCY结构。在多种侵袭性肿瘤中呈高表达状态,主要分布在与基质接触部位细胞膜的内表面[1]。Hoshino等[2]通过大量实验证实:P27RFRho通过与P27kip1结合,解除P27kip1对RHO蛋白的抑制,从而活化RHO蛋白。P27kip1和RHO蛋白与肝脏肿瘤的增殖能力有密切关联[2-3]。但P27RF-Rho在肝癌的发生发展过程中的作用及机制还缺少深入的实验研究。本实验通过靶向沉默P27RF-Rho基因,观察其对肝癌细胞增殖能力影响。
1 材料与方法
1.1 细胞和主要试剂 人肝癌细胞株Bel7402和293T细胞由吉林大学第一医院肝胆胰外科实验室保 存,U6-shRNA-CMV-copGFP-PGK-Puro-P27RF-Rho基因沉默病毒真核表达载体 U6-shRNA-CMV-copGFP-PGK-Puro-Scramble及基因沉默病毒真核表达阴性对照载体自行构建,E.coli DH5α感受态细胞购自美国Invetrogen公司。限制性内切酶、DNA连接酶(thermo)、DNA回收试剂盒及质粒提取试剂盒(中国美基生物公司),RT-PCR试剂盒及DNA Marker DL2000(日本Takara公司)。
1.2 RNAi慢病毒载体的构建和提取 shRNA引物退火形成带黏性末端的双链片段,shRNA序列见表1。反应体系:shRNA-F(100pmol)2μL、shRNA-R(100pmol)2μL、10× 退火缓冲液2μL、ddH2O 14μL,共20μL。反应条件:95℃、5min,72℃、10min,放室温60min。取5μL加水95μL制备退火产物溶液。
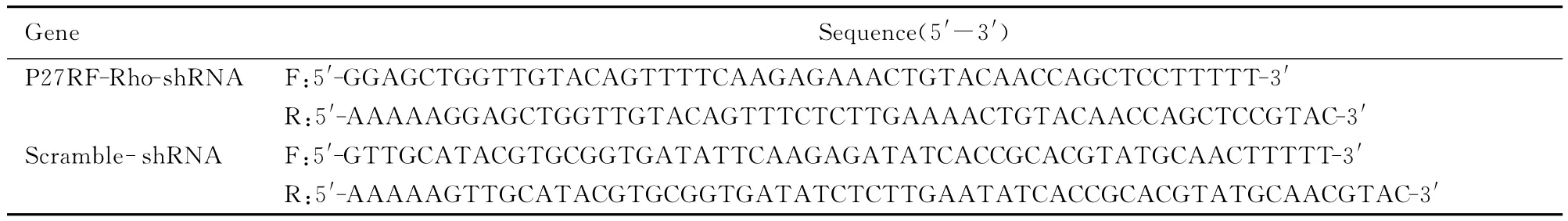
表1 shRNA分析的引物序列Tab.1 Sequences of primers for shRNA analysis
表达载体的制备:10×buffer 6μL、慢病毒干扰载体10μL、KpnⅠ 1μL、HpaⅠ 1μL、ddH2O 42μL,共60μL。于37℃酶切3h。干扰片段连接入表达载体:退火产物3μL、载体片段3μL、T4连接酶1μL、10×T4Buffer 2μL、ddH2O 11μL,配成20μL体系,16℃连接过夜,构建成U6-shRNA-CMV-copGFP-PGK-Puro 载体。感受态细胞的转化:从-80℃冰箱取出1管100μL E.coli DH5α感受态细胞,冰上解冻后取10μL重组产物加到感受态中混匀,静置30min,42℃水浴热激1min,再放冰上静置2min。加预先复温的SOC溶液500μL,放摇床摇1h,涂板过夜37℃培养。挑取数个菌落提取质粒测序验证,测序引物 LKO5:5′-GACTATCATATGCTTACCGT-3′。
质粒的提取:吸取菌液培养基于1.5μL离心管中,12000r·min-1离心1min,弃上清,吸取培养基重复离心,弃上清离心,留取少量菌液作为菌种保存,可直接置于-20℃,加Buffer S1悬浮细菌250μL,悬浮均匀,加Buffer S2250μL温和充分地上下翻转6次混合均匀,使菌体裂解。加Buffer S3350μL温和上下翻转,12000r·min-1离心10min。取上清液转移到专用的制备管(2mL),12000r·min-1离心1min,弃滤液。加500μL Buffer W1,12000r·min-1离心1min,弃滤液。加Buffer W2500μL,12000r·min-1离心1min,弃滤液,重复1次。将制备管置回2mL离心管,12000r·min-1离心1min。将制备管移入新的1.5mL离心管中,加60~80μL Eluent或离子水,室温1min,12000r·min-1离心1min。移去制备管,将有质粒的离心管于4℃或-20℃保存。
1.3 病毒包装和P27RF-Rho基因沉默效果的检测质粒DNA与psPAX2和pMD2G质粒共转染293T细胞病毒包装。第1天:转染前24h,用胰蛋白酶消化对数生长期的293T细胞,以含10%血清的培养基调整细胞密度为1.2×107细胞/20mL,重新接种于15cm细胞培养皿,于37℃、5%CO2培养箱内培养。24h待细胞密度达70%~80%时转染。第2天:500μL无血清培养基稀释2μg表达质粒+1.5μg psPAX2+1.5μg pMD2G;500μL无血清培养基稀释15μL脂质体2000;5min后,将DNA溶液和脂质体溶液混合,室温静止20min。从6孔板中吸出1mL无血清培养基,然后滴加入1mL质粒和脂质体混合物。6~10h后,移除含有DNA-脂质体复合物的培养基,代之以正常培养液DMED+10%FBS(从此刻开始计算时间)。第3天:转染24h后,荧光显微镜下观察,转染效率应达到70%以上。第4天:转染后48和72h分别收获含病毒的上清,3000r·min-1离心20min,0.45nm 滤膜过滤,去除细胞沉淀。12000r·min-1离心浓缩细胞、分装,-80°C贮存;滴度测定。
本实验分为空白对照Bel7402组、阴性对照Scramble-siRNA组(感染U6-shRNA-CMV-copGFP-PGK-Puro-Scramble)和P27RF-RhosiRNA组(感染 U6-shRNA-CMV-copGFP-PGKPuro-P27RF-Rho),48h 荧光显微镜及RT-PCR法检测P27RF-Rho基因沉默效果。P27RF-Rho:F,5′-TGTGACCGGAAGGGCTCCT-3′;R,5′-GAGGAGAAGAGCTGTCCAAG-3′,长 度 为580bp。反应条件:94℃、5min,94℃、30s,56℃、30s,72℃、1min,35 个循环;72℃、10min。
1.4 MTT比色法检测细胞生长曲线 细胞感染24h后各组细胞按0.5×104个/孔密度接种于96孔板,每组接种3孔。共铺6块板,置孵育箱中培养。自接种24h后起,每天随机取1块板,进行MTT比色实验,在酶标仪上波长570nm处测定吸光度(A)值,取平均值,连续6d,绘制生长曲线。以A值表示细胞生长速度,A值越大,细胞生长速度越快。
1.5 细胞平板克隆形成实验 取对数生长期的各组细胞悬液,进行梯度倍数稀释,每组细胞分别以每皿50、100和200个细胞的梯度密度分别接种含10mL、37℃预温培养液的皿中,置37℃、5%CO2及饱和湿度的细胞培养箱中培养2~3周。当培养皿中出现肉眼可见的克隆时,加4%多聚甲醛固定细胞5mL固定15min。加适量GIMSA应用染色液染色30min,然后用流水缓慢洗去染色液,空气干燥。将平皿倒置在显微镜计数大于10个细胞的克隆数,计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%。
1.6 半定量RT-PCR法检测细胞增殖、侵袭和迁移相关基因表达 提取各组总RNA,半定量RTPCR法检测P16、CyclinE、基质金属蛋白酶9(MMP-9)、周期素依赖性激酶5(CDK-5)的表达。以α-tublin为内参照。α-tublin、P16、CyclinE、MMP-9、CDK-5的引物序列见表2。反应条件:α-tublin,94℃、30s,57℃、30s,72℃、60s,25个循环;P16,94℃、30s,60℃、30s,72℃、40s,35个循环;CyclinE,94℃、30s,62℃、30s,72℃、1min,35个循环;CDK-5,94℃、30s,58℃、30s,72℃、1min,35个循环;MMP-9,94℃、30s,63℃、30s,72℃、1min,35个循环。产物经1.5%琼脂糖凝胶电泳,凝胶成像系统下拍照并进行灰度值扫描,对各组mRNA相对内参照水平变化进行比较,mRNA相对表达水平=目的基因灰度值/内参照灰度值。

表2 α-tublin、P16、CyclinE、MMP-9和CDK-5基因的引物序列Tab.2 Primer sequences ofα-tublin,P16,CyclinE,MMP-9 and CDK-5genes
1.7 统计学分析 采用SPSS 13.0软件进行统计学分析。各组Bel7402细胞中P27RF-Rho、P16、CyclinE、MMP-9和CDK-5相对表达水平以表示,组间比较采用t检验。
2 结 果
2.1 细胞转染效果观察 慢病毒感染细胞72h后荧光显微镜下观察结果显示:阴性对照ScramblesiRNA组和P27RF-Rho-siRNA组Bel7402细胞均出现绿色荧光蛋白表达,病毒感染效果良好。见图1(插页六)。
2.2 RT-PCR法检测 P27RF-Rho mRNA 表达P27RF-Rho-siRNA组Bel7402细胞中 P27RF-Rho mRNA表达水平(0.21±0.10)较空白对照Bel7402组(0.90±0.23)和阴性对照 ScramblesiRNA组(0.86±0.18)明显降低(P<0.01),各组内参照基因α-tublin表达良好。见图2。
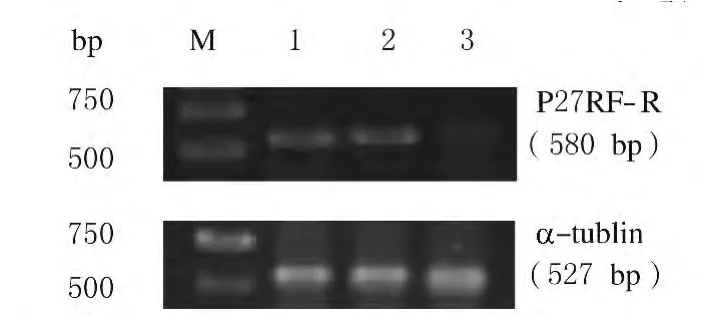
图2 RNAi质粒沉默Bel7402细胞中P27RF-Rho mRNA表达电泳图Fig.2 Electrophoregram of expressions of P27RF-Rho mRNA in Bel7402cells silenced by RNAi plasmid
2.3 各组Bel7402细胞生长曲线 各组细胞在培养3d时生长速度无明显差异,从第4天开始,P27RF-Rho-siRNA组细胞生长速度明显低于空白对照Bel7402组和阴性对照Scramble-siRNA组(P<0.05)。见图3。
2.4 各组细胞平板克隆形成率 空白对照Bel7402组和阴性对照Scramble-siRNA组细胞的克隆形成率分别为(50.12±3.14)%和(48.87±5.69)%,P27RF-Rho-siRNA组Bel7402细胞克隆形成率为(15.14±0.78)%,P27RF-Rho-siRNA组Bel7402细胞克隆形成率明显低于空白对照Bel7402组和阴性对照组(P<0.01)。见图4(插页六)。
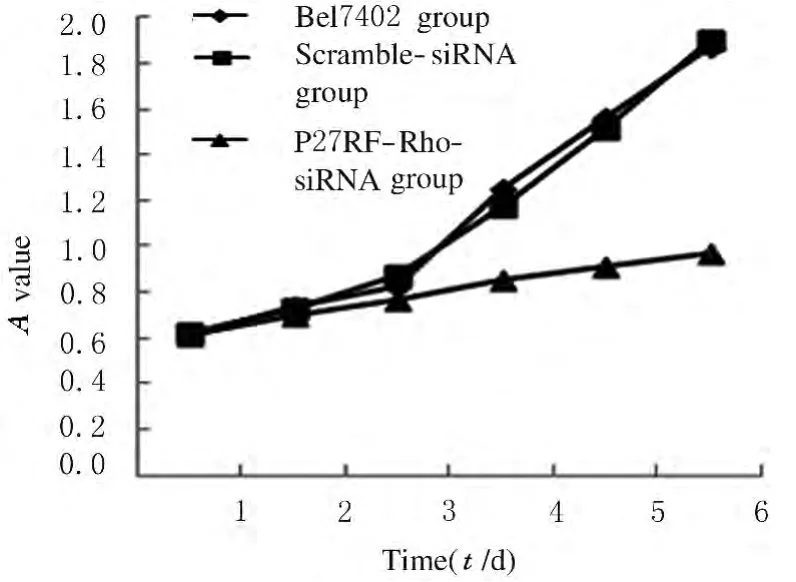
图3 各组Bel7402细胞生长曲线Fig.3 Growth curves of Bel7402cells in various groups
2.5 各组Bel7402细胞中P16、CyclinE、MMP-9和CDK-5mRNA 表达水平P27RF-Rho-siRNA组P16mRNA表达水平高于空白对照Bel7402组和阴性对照组(P<0.01),而空白对照Bel7402组与阴性对照组比较P16mRNA表达水平差异无统计学意义(P>0.05);P27RF-Rho-siRNA组CyclinE、MMP-9和CDK-5mRNA表达水平低于空白对照Bel7402组和阴性对照Scramble-siRNA组(P<0.01),而空白对照Bel7402组与阴性对照Scramble-siRNA组比较差异无统计学意义(P>0.05)。见表3和图5。
表3 各组Bel7402细胞中P16、MMP-9、CDK-5和CyclinE mRNA表达水平Tab.3 Expression levels of P16,MMP-9,CDK-5,and CyclinE mRNA in Bel7402cells in various groups(n=3,)

表3 各组Bel7402细胞中P16、MMP-9、CDK-5和CyclinE mRNA表达水平Tab.3 Expression levels of P16,MMP-9,CDK-5,and CyclinE mRNA in Bel7402cells in various groups(n=3,)
*P<0.01compared with Bel7402group;△P<0.01compared with Scramble-siRNA group.
Group P16 MMP-9 CDK-5 Cy 0.13 Scramble-siRNA 0.18±0.22 0.79±0.17 0.88±0.19 0.81±0.16 P27RF-Rho-siRNA 0.65±0.11*△ 0.32±0.11*△ 0.35±0.14*△ 0.22±0.12*clinE Bel7402 0.21±0.14 0.83±0.15 0.91±0.21 0.78±△
3 讨 论
肝癌是临床上最常见的恶性肿瘤之一,在我国其死亡率已位于恶性肿瘤的第2位。抑癌基因的低表达与癌基因的高表达是患者病情进展的重要原因[4]。
图5 RT-PCR法检测各组Bel7402细胞中P16、CyclinE、MMP-9和CDK-5mRNA表达电泳图Fig.5 Electrophoregram of expressions of P16,CyclinE,MMP-9,and CDK-5mRNA in Bel7402cells in various groups detected by RT-PCR method
Rho A和Rho C分子在多种肿瘤中高表达,与肿瘤的增殖能力有密切关联。其中Rho A促进生长作用较Rho C明显,而Rho C有更强大的促进肿瘤转移作用[5-6]。Rho A和Rho C分子在细胞内受到多种途径的调控,鸟嘌呤核苷酸交换因子(GEFs)是其中最重要的调控途径,控制Rho蛋白的三磷酸鸟苷(guanosine triphosphate,GTP)交换,使Rho A或Rho C在与二磷酸鸟苷(guanosine diphosphate,GDP)的失活状态与GTP的活化状态之间循环。鸟嘌呤核苷酸交换因子催化GDP转化为GTP,从而活化Rho A或Rho C。P27kip1在被AKT磷酸化后部分由细胞核转移至细胞浆中,通过与GDP-Rho结合,抑制Rho A和Rho C分子的活性[2]。实验[1]证实:过表达P27kip1的细胞中,Rho A或Rho C的表达减少,且活性降低;P27RF-Rho通过与P27kip1结合,解除P27kip1对Rho蛋白的抑制,增加了GDP-Rho蛋白对鸟嘌呤核苷酸交换因子的敏感度,从而活化Rho蛋白。Hoshino等[2]发现:侵袭性高的鼠黑色素瘤细胞中的P27RF-Rho和与GTP结合的Rho A表达水平较无侵袭性的黑色素瘤细胞和正常组织中要明显增高,且过表达P27RF-Rho后,Rho A的表达较正常对照组增加了50%,而基因沉默P27RF-Rho后,Rho A的表达较正常对照组降低了40%。此外,还有研究[7]表明:P27RF-Rho通过MAPK、mTORC1信号通路及依赖P53分子的细胞凋亡影响肿瘤细胞的增殖能力。
CDK是细胞周期调控网络的核心蛋白,其表达活性的改变直接影响到细胞周期的长短,决定着细胞的进程,与集体细胞的生长、分化、运动、凋亡以及肿瘤的发生发展、转移关系密切[8]。CDK-5是CDK家族中的一员,主要是通过引起细胞增殖和凋亡异常引起肿瘤的发生发展的。研究[9]表明:CDK-5在包括肝癌在内的多种肿瘤组织中高表达。P16是近年发现的一种抑癌基因,正常情况下其通过阻止细胞由G1期进入S期(DNA合成期),使细胞增殖受阻[10]。P16蛋白表达减少可引起细胞周期失控而诱发癌变。实验[11]表明:肝癌组织中P16呈低表达。肿瘤浸润是肿瘤组织与细胞外基质(extracelluar matrix,ECM)相互作用的过程,包括黏附、降解及移动3个步骤,实现这一过程首先必须具备降解基底膜及细胞外基质的能力。MMPs是一类能分解细胞外基质与基底膜的蛋白水解酶,MMP-9能降解明胶、层黏连蛋白和巢蛋白,与肿瘤的增殖和发展有密切关系[12]。研究[13]表明:MMP-9在肝癌、胃癌、食管癌、子宫内膜癌、乳腺癌和骨肉瘤等恶性组织中呈高表达特性。CyclinE是重要的细胞周期调节因子,CyclinE基因的低表达可使细胞阻滞在G1期,使G1细胞数目增多,S期细胞减少,进而抑制细胞恶性增殖、恶性转化和肿瘤的发展[14]。CyclinE基因在低分化及肝内转移的肝癌组织中呈过度表达,在正常肝组织中无过度表达[15-19]。
本实验通过靶向沉默P27RF-Rho基因使肝癌细胞的增殖能力明显下降,RT-PCR检测结果显示:P16mRNA表达水平明显升高,CyclinE、MMP-9和CDK-5mRNA表达水平降低。
综上所述,靶向沉默P27RF-Rho基因可以明显抑制肝癌细胞的增殖能力,其机制仍需进一步研究,P27RF-Rho基因将可能成为一个极有前途的肝癌肿瘤生物治疗的新靶点。
[1]Hoshino D,Koshikawa N,Seiki M.A P27kip1-binding protein,P27RF-Rho,promotes cancer metastasis via activation of RhoA and RhoC [J].J Biol Chem,2011,286(4):31,39-48.
[2]Hoshino D,Tomari T,Nagano M,et al.A novel protein associated with membrane-type 1matrix metalloproteinase binds P27kip1and regulates RhoA activation,actin remodeling,andmatrigel invasion[J].J Biol Chem,2009,284(40):27315-27326.
[3]Xie SL,Zhu MG,Lv GY,et al.The role of RhoC in the proliferation and apoptosis of hepatocellular carcinoma cells[J].Med Oncol,2011,24(31):24-32.
[4]金立鹏,王广义,谢淑丽,等.雷帕霉素联合阿霉素对肝癌细胞BEL-7402增殖及迁移的影响及其作用机制 [J].吉林大学学报:医学版,2011,37(1):30-34.
[5]Malissein E,Meunier E,Lajoie-Mazenc I,et al.RhoA and RhoC differentially modulate estrogen receptorαrecruitment,transcriptional activities,and expression in breast cancer cell(MCF-7) [J].Cancer Res Clin Oncol,2013,139(12):2079-2088.
[6]Xie S,Zhu M,Lü G,et al.Overexpression of Ras homologous C(RhoC)induces malignant transformation of hepatocytes in vitro and in nude mouse xenografts [J].PLoS One,2013,8(1):54493-54513.
[7]Nada S,Mori S,Takahashi Y,et al.P18/LAMTOR1:A Late endosome/lysomome-specific anchor protein for the mTORC1/MAPK signaling pathway[J].MethodsEnzymol,2014,535:249-263.
[8]Liu L,Schwartz B,Tsubota Y,et al.Cyclin-dependent kinase inhibitors block leukocyte adhesion and migration [J].J Immunol,2008,180(3):1808-1817.
[9]刘 冲,赵浩亮.索拉菲尼对肝癌细胞的抑制作用及其对CDK5表达水 平的影响 [J].中国 医 药 科学,2012,2(17):34-36.
[10]Grønhøj Larsen C,Gyldenløve M,H Jensen D,et al.Correlation between human papillomavirus and p16overexpression in oropharyngeal tumours:a systematic review[J].Br J Cancer,2014,110(6):1587-1594.
[11]麦 丽,杨 林,邝建玉,等.乙型肝炎病毒X蛋白抑制P16蛋白表达及其促进HepG2肝癌细胞生长 [J].中华肝脏病杂志,2013,21(8):614-618.
[12]李明意,姚金科,周晓华,等.MKK-4、MMP-9基因的表达与原发性肝癌肿瘤侵袭转移的关系 [J].中国病理生理杂志,2006,22(8):1480-1483.
[13]刘 敏,曾 霞,侯 恩 存,等.Glypican3、MMP-9和MMP-14在原发性肝癌中的表达和临床意义 [J].重庆医学,2014,43(2):173-176.
[14]贾海全.RNAi cyclin E对肝癌细胞生长的影响 [J].河南医学研究,2014,23(5):11-14.
[15]Bassiouny AE,Nosseir MM,Zoheiry MK,et al.Differential expression of cell cycle regulators in HCV-infection and related hepatocellular carcinoma [J].World J Hepatol,2010,2(1):32-41.
[16]徐同磊,谢淑丽,王广义.肝癌细胞信号转导通路研究的最新进展 [J].中国老年学杂志,2013,33(7):1724-1726.
[17]孙 炜,宋祥和,卞勇华,等.索拉菲尼联合紫杉醇对HepG2细胞的抑制作用及其对CyclinD1表达水平的影响 [J].中国老年学杂志,2015,35(2):438-440.
[18]许 力,马珂歆,董 兵,等.肝细胞癌中micro RNA对细胞凋亡、转移和周期的调控作用 [J].临床肝胆病杂志,2013,29(7):554-557.
[19]冯 洁,汤正好,余永胜.转录因子Sp1在肝细胞癌中的表达 [J].临床肝胆病杂志,2013,29(1):65-67.
