PDGF/ROCK通路在AcSDKP抑制大鼠矽肺纤维化形成中的作用
2015-11-29张丽娟李淑钰张文丽
张丽娟,李 倩,徐 洪,李淑钰,裴 鑫,张文丽,杨 方
(华北理工大学医学实验研究中心 华北理工大学老年医学国际科技合作基地,河北 唐山 063000)
尘肺病是我国最严重的职业病,2013年尘肺病报告病例数占职业病报告总例数的87.72%,给国家、社会和群众健康带来了极大的危害[1]。而目前尚无治疗尘肺病的特效方法。尘肺病以肺组织的弥漫性纤维化为其主要病理特征,探索尘肺病发病的分子机制以延缓或阻断肺纤维化的发展进程仍具有重要的实际意义。在矽肺形成过程中,吞噬二氧化硅(SiO2)的肺泡巨噬细胞可释放大量细胞因子,包括转化生长因子β(transforming growth factor-β,TGF-β),血小板源性生长因子(platelet-derived growth factor,PDGF)等,其中TGF-β/Smad促进肌成纤维细胞转化构成了器官纤维化发病过程中一个较为明确的机制[2-5]。肌成纤维细胞已经被认为是器官纤维化最主要和最重要的效应细胞,特异表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)[6-7]。研究[8-9]显示:Rho-ROCK信号通路可通过复杂的磷酸化/脱磷酸化级联反应调控α-SMA的表达,但其具体机制仍有待进一步研究。本研究探讨肺纤维化过程中Rho相关卷曲螺旋形成蛋白激酶(Rho-associated coiledcoil-forming protien kinase,ROCK)和另一重要的促纤维化因子—PDGF在肌成纤维细胞转化以及矽肺大鼠肺组织内胶原沉积中的作用。
1 材料与方法
1.1 实验动物 SPF级健康成年雄性Wistar大鼠60只,体质量(180±10)g,购于北京维通利华动物技术有限公司,动物许可证号:SLXK京20090008于河北联合大学实验动物中心屏障实验室饲养,温度20~26℃,湿度50%~70%,昼夜交替,自由饮食进水。
1.2 材料、主要试剂和仪器 标准α石英粉尘(中国疾病预防控制中心)。AcSDKP(瑞士Bachem AG公司),兔抗大鼠α-SMA 、ROCK、PDGFR-β和phospho-PDGFR-β多克隆抗体(美国Epitomics公司),小鼠抗大鼠Ⅰ型和Ⅲ型胶原单克隆抗体(美国Sigma公司),兔抗大鼠GAPDH多克隆抗体(美国Santa Cruz公司),羊抗小鼠二抗、羊抗兔二抗、DAB显色试剂盒和BCIP/NBT显色试剂盒(武汉博士德生物有限公司)。药物释放微渗泵(美国DURECTCorporation公司)。
1.3 矽肺动物模型建立[10]将大鼠随机分为6组,每组10只,乙醚麻醉后采用非暴露式气管插管,按照实验分组支气管内一次性灌注生理盐水或浓度为50g·L-1的生理盐水SiO2混悬液。①模型对照4周组:大鼠支气管内灌注灭菌生理盐水1.0mL/只,腹腔内埋入注入生理盐水的微量药物释放泵,4周后处死;②模型对照8周组:同模型对照4周组处理后于8周后处死;③矽肺模型4周组:大鼠支气管内灌注SiO2混悬液1.0mL/只,腹腔内埋入注入生理盐水的微量药物释放泵,4周后处死;④矽肺模型8周组:同矽肺模型4周组处理后于8周后处死;⑤N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸(N-acetyl-seryl-aspartyl-lysylproline,AcSDKP)治疗组:支气管内灌SiO2混悬液1.0mL/只,4周后腹腔内埋入含有AcSDKP(800μg·kg-1·d-1)的微量药物释放泵,4周后处死;⑥AcSDKP预防治疗组,先于腹腔内埋入含有AcSDKP的微量药物释放泵48h,而后支气管内灌SiO2混悬液1.0mL/只,持续至8周后处死。各组大鼠腹主动脉采血后处死取肺组织,右下叶肺组织经多聚甲醛固定后常规石蜡包埋以备免疫组织化学染色,其余肺组织迅速冻于液氮中保存以备Western blotting检测。
1.4 免疫组织化学染色法检测大鼠肺组织中phospho-PDGFR-β的表达 染色步骤按免疫组织化学试剂说明书进行,其中phospho-PDGFR-β抗体滴度为1∶150,实验中设置阴性对照(PBS替代一抗)。采用专业图像分析软件Image-pro plus进行图像采集。
1.5 Western blotting法检测大鼠肺组织中α-SMA、PDGFR-β、phospho-PDGFR-β和ROCK以及Ⅰ型、Ⅲ型胶原蛋白的表达水平 按照文献 [11]的方法提取并测定蛋白浓度后,每孔90μg上样,SDS-PAGE电泳并转膜。采用5%的牛血清白蛋白37℃封闭1h,一抗(PDGFR-β、phospho-PDGFR-β抗体、Ⅰ型和Ⅲ型胶原抗体1∶1000稀释;α-SMA 抗体、ROCK 抗体和β-actin抗体1∶500稀 释),4℃ 孵育过夜;二抗(1∶3000稀释)37℃ 孵育1h;碱性磷酸酶显色。用图像扫描后以Image J软件对蛋白表达条带进行吸光度(A)值的定量分析,目的蛋白条带A值经内参平衡后,以各组A值与模型对照4周组A值的比值作为蛋白相对表达水平。
1.6 统计学分析 应用SPSS 13.0统计软件进行统计学处理。各组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、Rock、α-SMA 以及Ⅰ型、Ⅲ型胶原蛋白表达水平均以表示,组间样本均数比较采用单因素方差分析。
2 结 果
2.1 各组大鼠肺组织中phospho-PDGFR-β蛋白的表达 免疫组织化学染色结果显示:在模型对照4和8周组,phospho-PDGFR-β阳性表达细胞散在分布于肺泡壁;而在矽肺模型4和8周组,可见较多phospho-PDGFR-β阳性表达的细胞分布在矽结节与间质纤维化区域。当给予AcSDKP干预治疗时,phospho-PDGFR-β蛋白表达无论是从分布面积还是染色强度来看,phospho-PDGFR-β阳性表达细胞均明显减少。见图1(插页四)。
2.2 各组大鼠肺组织 中 PDGFR-β、phospho-PDGFR-β、ROCK和α-SMA蛋白表达水平 与模型对照组比较,矽肺模型组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、ROCK和α-SMA蛋白表达水平增强。其中矽肺模型4周组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、ROCK和α-SMA蛋白表达水平分别为模型对照4周组的2.01、3.89、2.46和1.53倍,矽肺模型8周组大鼠肺组织 中 PDGFR-β、phospho-PDGFR-β、ROCK和α-SMA蛋白表达水平分别为模型对照8周组的1.99倍、3.81倍、2.07 倍和1.48倍。AcSDKP治疗组和AcSDKP预防治疗组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、ROCK和α-SMA蛋白表达水平均较矽肺模型组降低,其中AcSDKP治疗组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、ROCK和α-SMA 蛋白表达水平分别为矽肺模型4周组的80.60%、47.30%、60.57%和84.96%,为矽肺模型8周组 的69.50%、 47.79%、 73.40%和86.09%;AcSDKP预防治疗组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、ROCK和α-SMA 蛋白表达水平为矽肺模型8周组的 73.40%、45.97%、69.46%和84.11%,差异均有统计学意义(P<0.05)。见表1和图2。
2.3 各组大鼠肺组织中Ⅰ型胶原与Ⅲ型胶原蛋白表达水平 Western blotting法结果显示:与模型对照组比较,矽肺模型组大鼠肺组织中Ⅰ型胶原与Ⅲ型胶原蛋白表达增强。其中矽肺模型4周组大鼠肺组织中Ⅰ型与Ⅲ型胶原蛋白表达水平(以灰度值表示)分别为模型对照4周组的1.73和1.99倍,矽肺模型8周组大鼠肺组织中Ⅰ型与Ⅲ型胶原蛋白表达水平分别为模型对照8周组的1.97和2.02倍。AcSDKP治疗组和AcSDKP预防治疗组大鼠肺组织中Ⅰ型与Ⅲ型胶原蛋白表达均较矽肺模型组表达减弱,其中AcSDKP治疗组Ⅰ型与Ⅲ型胶原蛋白表达水平分别为矽肺模型4周组的81.50%和66.83%,为矽肺模型8周组 的78.77%和61.00%;AcSDKP预防治疗组大鼠肺组织中Ⅰ型胶原和Ⅲ型胶原蛋白表达水平为矽肺模型8周组的83.79%和63.30%,差异均有统计学意义(P<0.05)。见表1和图2。
3 讨 论
矽肺病是长期吸入二氧化硅粉尘所致的以肺组织弥漫性纤维化和矽结节形成为主要病理改变的常见职业病。在矽肺形成过程中,被激活的内皮细胞、吞噬二氧化硅的肺泡巨噬细胞等可释放大量的细 胞因子(包括TGF-β和PDGF等)。TGF-β和PDGF在矽肺病患者血清中的水平明显升高[2]。ROCK通过控制细胞骨架肌动蛋白的排列和细胞收缩调节细胞的黏附、迁徙、增殖和凋亡,在器官纤维化的发生和发展过程中发挥着重要作用[12-13]。本课题组前期研究[14]证实:TGF-β可以通过激活ROCK信号通路刺激大鼠肺成纤维细胞向肌成纤维细胞分化。PDGFR-β属酪氨酸激酶受体,能够被PDGF激活并和EGFR形成异二聚体,配体结合能诱发受体的二聚化并激活受体胞质部分的酪氨酸激酶,催化ATP的γ-磷酸基转移至受体的酪氨酸磷酸并并影响细胞的生长、肌动蛋白重塑、迁移和分化[16-17]。徐惠等[18]在研究中发现:单侧输尿管梗阻模型大鼠肾间质中α-SMA和Ⅲ型胶原的表达与肾小管PDGFR-β和PDGF-BB的表达呈正相关。以上研究结果提示:PDGF/ROCK通路可能在矽肺大鼠肺纤维化过程中发挥着重要作用。
表1 各组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、ROCK、α-SMA以及Ⅰ型、Ⅲ型胶原蛋白表达水平Tab.1 Expression levels of PDGFR-β,phospho-PDGFR-β,ROCK,α-SMA,typeⅠcollagen,and typeⅢcollagen in lung tissue of rats in various groups (n=10,)

表1 各组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、ROCK、α-SMA以及Ⅰ型、Ⅲ型胶原蛋白表达水平Tab.1 Expression levels of PDGFR-β,phospho-PDGFR-β,ROCK,α-SMA,typeⅠcollagen,and typeⅢcollagen in lung tissue of rats in various groups (n=10,)
Quantitative data was as fold for model control 4weeks group.*P<0.05 vs model control 4weeks group;△P<0.05 vs model control 8weeks group;#P<0.05 vs silicosic model 4weeks group;▲P<0.05 vs silicosic model 8weeks group.
Group PDGFR-β phospho-0±0.00 1.00±0.00 1.00±0.00 1.00±0.00 Model control 8weeks 1.17±0.17 1.01±0.11 0.98±0.10 1.02±0.09 0.91±0.08 1.08±0.15 Silicosic model 4weeks 2.01±0.13* 3.89±0.19* 2.46±0.41* 1.53±0.07* 1.73±0.24* 1.99±0.15*Silicosic model 8weeks 2.33±0.17△ 3.85±0.23△ 2.03±0.28△ 1.51±0.07△ 1.79±0.14△ 2.18±0.27△AcSDKP post-treatment 1.62±0.15#▲ 1.84±0.17#▲ 1.49±0.20#▲ 1.30±0.10#▲ 1.41±0.07#▲1.33±0.13#▲AcSDKP pre-treatment 1.71±0.12# 1.77±0.19# 1.41±0.04# 1.27±0.09# 1.50±0.11# 1.38±0.17 en Model control 4weeks 1.00±0.00 1.00±0.00 1.0 PDGFR-β ROCK α-SMA TypeⅠcollagen TypeⅢcollag#
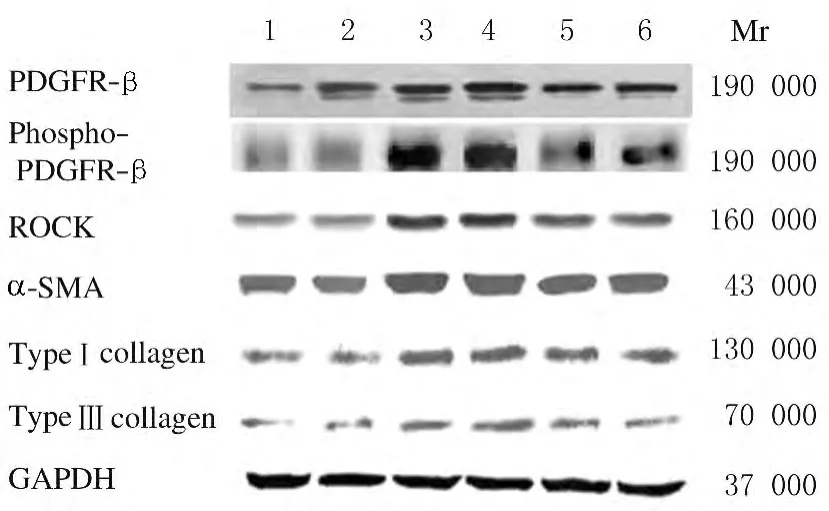
图2 Western blotting法检测各组大鼠肺组织中PDGFR-β、phospho-PDGFR-β、ROCK、α-SMA、Ⅰ型胶原和Ⅲ型胶原蛋白表达电泳图Fig.2 Electrophoregram of expressions of PDGFR-β,phospho-PDGFR-β,ROCK,α-SMA,typeⅠcollagen,and typeⅢcollagen in lung tissue of rats in various groups detected by Western blotting method
本研究观察了PDGFR-β、phospho-PDGFR-β、ROCK、α-SMA以及Ⅰ型、Ⅲ型胶原蛋白在矽肺模型大鼠肺组织中的表达,结果再次证实了本课题组的前期研究[6]结果,即AcSDKP可降低矽肺大鼠肺组织内Ⅰ型、Ⅲ型胶原蛋白的表达。而与此同时,本文作者发现:矽肺模型组矽结节与间质纤维化区域有较多phospho-PDGFR-β阳性表达细胞分布。当给予 AcSDKP干预治疗时phospho-PDGFR-β蛋白表达无论是从分布面积还是染色强度来看,均明显减少。此外,Western blotting结果也进一步证实,当给予AcSDKP干预治疗时,大 鼠 肺组织 中 α-SMA、PDGFR-β、phospho-PDGFR-β和ROCK表达水平均较矽肺模型组明显降低。提示PDGF可能通过激活ROCK信号转导通路促进大鼠肌成纤维细胞转化,进而促进矽肺大鼠肺组织内胶原的合成。AcSDKP可能通过抑制PDGF/ROCK诱导的肌成纤维细胞分化,减少胶原的合成,进而发挥抗矽肺纤维化的作用。
本研究进一步探讨了AcSDKP抗矽肺纤维化的可能作用机制,但矽肺的形成过程是复杂的细胞因子网络相互作用的结果,因此AcSDKP对其他细胞因子以及在细胞因子 “对答”中的作用仍需进一步探讨。
[1]中国疾病预防控制中心.2013年全国职业病报告情况报告 [EB/OL].http://www.chinacdc.cn/mtdx/cn/mtdx/wdwsdxgbd/201407/t20140701_98951.htm.2014-07-01.
[2]姚 武,冯斐斐,焦 洁,等.TGF-β1、PDGF、CTGF在尘肺病患者血清中的表达水平变化及意义 [J].四川大学学报:医学版,2006,30(5):754-756.
[3]Park IH,Park SJ,Cho JS,et al.Effect of simvastatin on transforming growth factor beta-1-induced myofibroblast differentiation and collagen production in nasal polyp-derived fibroblasts[J].Am J Rhinol Allergy,2012,26(1):7-11.
[4]纪 辉,迟宝荣,张一宁.肝纤维化与肝星状细胞 [J].吉林大学学报:医学版,2008,34(3):538-542.
[5]于天水,官大威,马 勇,等.肌成纤维细胞在纤维化疾病中的研究进展 [J].中国组织化学与细胞化学杂志,2013,2(2):167-171.
[6]Fausther M,Dranoff JA.Integrins myofibroblasts,and organ fibrosis [J].Hepatology,2014,60(2):756-758.
[7]Hu B,Phan SH.Myofibroblasts [J].Curr Opin in Rheumatol,2013,25(1):71-77.
[8]扈彩霞,郑加生,王玉珍,等.大鼠肝纤维化组织内ROCKI、磷酸化 MBS、Thr-697和α-SMA表达增强 [J].基础医学与临床,2010,30(4):355-359.
[9]Manickam N,Patel M,Griendling KK,et al.RhoA/Rho kinase mediates TGF-β1-induced kidney myofibroblast activation through Poldip2/Nox4-derived reactive oxygen species[J].Am J Physiol Renal Physiol,2014,307(2):159-171.
[10]闫静波,张丽娟,李 倩,等.N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸抗大鼠矽肺纤维化的实验研究 [J].中华劳动卫生职业病杂志,2008,26(7):401-405.
[11]杨 方,吉子言,李丹丹,等.TGF-β1介导Smad通路调节在大鼠矽肺纤维化形成中的作用 [J].现代预防医学,2011,38(23):4930-4932.
[12]柳 飞,付 平.RhoA/Rho相关卷曲螺旋形成的蛋白激酶信号通路与慢性肾脏疾病 [J].华西医学,2011,26(5):781-783.
[13]Wang S,Sun A,Li L,et al.Up-regulation of BMP-2 antagonizes TGF-β1/ROCK - enhanced cardiac fibrotic signalling through activation of Smurf1/Smad6complex [J].J Cell Mol Med,2012,16(10):2301-2310.
[14]马文东,袁 媛,杨 奕,等.TGF-β1 介 导 的 RhoA/ROCK通路在大鼠肺肌成纤维细胞分化中的调节作用 [J].中国病理生理杂志,2013,29(10):1758-1763.
[15]Ostman A,Heldin CH.Involvement of platelet-derived growth factor in disease:development of specific antagonists[J].Adv Cancer Res,2001,80:1-38.
[16]Nakagawa T,Inoue H,Sasahara M.Platelet-derived growth factor and renal disease [J].Curr Opin Nephrol Hyper,2012,21(1):80-85.
[17]Jang SW,Ihm SH,Choo EH,et al.Imatinib mesylate attenuates myocardial remodeling through inhibition of platelet-derived growth factor and transforming growth factor activation in a rat model of Hypertension [J].Hypertension,2014,63(6):1228-1234.
[18]徐 惠,官 阳,杨木兰,等.PDGF及PDGF-BB在大鼠肾间质纤维化过程中的作用 [J].中国现代医学杂志,2007,17(19):2354-2358.
