精氨酸-甘氨酸-天冬氨酸多肽表面修饰多孔钽对软骨细胞黏附、增殖和分泌功能的促进作用
2015-11-29甘洪全赵宏坤宋会平王志强李琪佳
甘洪全,王 茜,张 辉,赵宏坤,王 辉,宋会平,毕 成,王志强,李琪佳
(1.河北联合大学附属医院骨科,河北 唐山 063000;2.河北联合大学基础医学院人体解剖学系,河北 唐山 063000;3.河北省唐山市第二医院关节科,河北 唐山 063000;4.河北省唐山市第二医院手外科,河北 唐山 063000;5.河北联合大学实验中心,河北 唐山 063000)
多孔钽是近年来出现的一种比较理想的骨科植入金属材料,其有与人类松质骨类似的三维立体网架孔隙结构,相互连通。多孔钽有利于细胞的黏附、增殖和较好地向组织长入[1-2]。尽管多孔钽作为金属移植材料优点诸多,但仍存在象其他金属材料一样在细胞亲和力、亲水性和细胞黏附性不如天然衍生骨植入材料的缺点,需要对其进行表面修饰或改性以改善其生物学性能[3-4]。
本实验通过物理吸附的方法将含有精氨酸-甘氨酸-天冬氨酸(arg-gly-asp,RGD)片段多肽及Ⅱ型胶原(ColⅡ)分别吸附于国产多孔钽表面进行修饰形成RGD(或ColⅡ)/多孔钽;同时与新西兰乳兔软骨细胞复合培养形成RGD/软骨细胞/多孔钽复合物。扫描电镜观察多孔钽形貌特征、RGD/软骨细胞/多孔钽复合物软骨细胞生长、黏附及分泌细胞外基质情况;MTT法检测修饰前后多孔钽对软骨细胞增殖的影响;沉淀法检测多孔钽修饰前后软骨细胞黏附率;羟脯氨酸法测定软骨细胞分泌功能,进而探讨RGD/软骨细胞/多孔钽复合物做为软骨组织工程支架材料修复软骨缺损、促进软骨再生的可行性。
1 材料与方法
1.1 实验动物、实验材料、主要试剂和仪器 健康新西兰幼兔8只,2周龄,体质量200~300g,由河北联合大学实验动物中心提供,许可证号:Scxk(京)010-0001。多孔钽材料由重庆润泽医疗器械有限公司提供。RGD多肽(上海吉尔生化有限公司),ColⅡ和DMEM F12(美国 Gibco公司),MTT试剂、DMSO和甲苯 胺蓝(美国Sigma公司),PV-6001免疫组织化学试剂盒(北京中杉金桥生物技术有限公司),羟脯氨酸测定试剂盒(南京建成生物工程研究所)。TS100倒置相差显微镜(日本Nikon公司),S-4800扫描电镜(美国Thermo公司),BIO-RAD 680伯乐酶标仪(美国BIO-RAD公司)。
1.2 RGD多肽和ColⅡ表面修饰多孔钽及实验分组直径15mm、厚3mm圆盘形多孔钽材料用去离子水超声清洗,蒸汽灭菌器灭菌,干燥。物理吸附方法将多孔钽(Ta)分别置于不同浓度RGD多肽及ColⅡ溶液中,使多孔钽材料孔隙内充分浸入修饰溶液。移液器吸除多孔钽上多余的修饰溶液,室温干燥24h。经紫外线照射再次消毒,备用。每组均为6个样本。根据2种修饰物浓度的不同共分为7组:1.0g·L-1RGD(Ta-RGD组)、1.0g·L-1ColⅡ(Ta-ColⅡ组)、0.2g·L-1RGD+1.0g · L-1ColⅡ(Ta-RGD/ColⅡ0.2g·L-1组)、1.0g·L-1RGD+1.0g·L-1Col Ⅱ(Ta-RGD/Col Ⅱ 1.0g · L-1组)、5.0g·L-1RGD+1.0g·L-1ColⅡ(Ta-RGD/ColⅡ5.0g·L-1组)、10.0g· L-1RGD和1.0g·L-1ColⅡ(Ta-RGD/ColⅡ10.0g·L-1组)及纯Ta组。
1.3 软骨细胞的分离培养 新西兰幼兔耳缘静脉空气栓塞处死,无菌条件下取四肢关节软骨,生理盐水漂洗,剪成1mm3小碎块,置于10mL离心管中,加入5倍软骨体积的1g·L-1ColⅡ酶,于37℃消化约10h,1000r·min-1离心5min,去上清液,所得白色沉淀物加入体积分数10%的胎牛血清、青霉素和链霉素各100U·mL-1、DMEM/F12培养基,吹打成细胞悬液,调整细胞浓度为1×105mL-1,种植于细胞培养瓶,在37℃、体积分数5%的CO2孵箱中培养2d后全量换液,去除未贴壁细胞,之后每2~3d换液1次,1周后可见细胞长满瓶底,传代。
1.4 软骨细胞与多孔钽复合培养及扫描电镜观察RGD/软骨细胞/多孔钽复合物 根据张岭等[5]方法将预先修饰处理好的各组多孔钽(每组6个)置入24孔板中,每孔钽支架加入200μL DMEM/F12于培养箱内预湿过夜,取生长状态良好的第2代软骨细胞,调整浓度为1×105mL-1的单细胞悬液200μL接种到多孔钽表面,2h后于支架周边轻柔缓慢加入含10%胎牛血清的DMEMF12培养液,培养液稍浸没支架。放入培养箱内培养,每2d更换培养液1次。
扫描电镜观察RGD/软骨细胞/多孔钽复合物,分别取修饰后培养4和7d的各组软骨细胞-钽支架复合物,PBS液轻柔漂洗后,25g·L-1戊二醛溶液固定4h,梯度乙醇逐级脱水各30min,临界点干燥,最后喷金。扫描电镜观察比较软骨细胞在各组多孔钽支架上的形态特点及黏附状态。
1.5 沉淀法检测软骨细胞黏附率 将各组RGD(或ColⅡ)/多孔钽置于24孔板,每孔支架滴加DMEM/F12200μL,于培养箱中预湿过夜,吸取浓度为1×105mL-1软骨细胞悬液100μL接种到各组支架表面,2h后每孔再次缓慢加入DMEM培养液1mL,防止材料表面变干,继续培养2h。于2和4h时分别取出各组支架材料,PBS轻柔冲洗,转移至新24孔板内,每孔加2.5g·L-1胰酶500μL消化5min。终止消化后计数板计数,取平均值,计算细胞黏附率。细胞黏附率=黏附细胞数/接种细胞数×100%。
1.6 MTT法检测RGD/软骨细胞/多孔钽复合物软骨细胞增殖水平 MTT比色分析检测活细胞数量。24孔板中各组多孔钽复合物培养1、3、5、7、10和13d时取出,吸出培养液,无菌PBS清洗复合物,去除未贴壁细胞,再将其转入新的24孔板,加入无血清DMEM/F12培养液800μL和MTT溶液100μL,置于37℃孵箱中孵育4h后,小心吸去培养液,各孔加入DMSO 800μL,低速振荡10min,使蓝紫色结晶充分溶解,吸取各孔溶液200μL至96孔板,在酶标仪以490nm波长测定各孔吸光度(A)值,取其平均值,以A值反映细胞的增殖水平,A值越大,细胞增殖水平越高。
1.7 RGD和ColⅡ/软骨细胞/多孔钽复合物软骨细胞分泌羟脯氨酸水平测定 RGD/软骨细胞/多孔钽复合物软骨细胞中羟脯氨酸水平能够间接反映软骨细胞分泌ColⅡ的功能状态。此项检测中增加软骨细胞组以对比其他各组羟脯氨酸分泌功能。将预先处理好的各组多孔钽复合物(每组6个)置入24孔板中,取第2代软骨细胞,接种于多孔钽表面,培养液浸没支架。培养7d时收集培养液,离心,取上清。按羟脯氨酸检测试剂盒说明书方法进行操作,于550nm波长处用酶标仪测定A值,根据标准品A值计算各测定管中羟脯氨酸的水平。羟脯氨酸水平(mg·L-1)=(测定管A值-空白管A值)/(标准管A值-空白管A值)×标准管浓度。
1.8 统计学分析 采用SPSS 18.0软件包对实验数据进行分析。各组细胞黏附率、细胞增殖水平以及羟脯氨酸水平均以表示,两组比较采用单因素方差分析,组间两两比较采用Student-Newman-Keuls(SNK)检验。
2 结 果
2.1 RGD多肽和ColⅡ表面修饰多孔钽 肉眼观察多孔钽结构为15mm×15mm×3mm圆片状、灰黑色,均匀多孔状结构,孔隙相互连通。扫描电镜下可见互相连通的微孔状结构,直径为200~700μm。RGD多肽及ColⅡ修饰后多孔钽支架各组外观为灰色,表面及断面与修饰前无明显改变。扫描电镜观察修饰后多孔钽表面均可见一层均匀、薄膜样涂层覆盖。见图1。
2.2 RGD和ColⅡ修饰多孔钽后对软骨细胞黏附性的变化 幼兔软骨细胞分离培养 原代细胞为大小均一的圆形细胞,有折光,初期生长缓慢;大部分细胞约在24h内伸展贴壁,多角形,原代细胞7~10d可长满培养瓶底。传代培养后细胞增殖速度加快,细胞形态三角形、梭形,胞浆丰富,胞核大而圆,有1~2个核仁。传代软骨细胞培养约5d即可长满培养瓶底,单层、不规则样改变。见图2(插页五)。

图1 多孔钽肉眼观和扫描电镜观察Fig.1 Appearance and observation of porous tantalum by SEM
各组钽支架软骨细胞黏附率:软骨细胞接种于修饰前后各组多孔钽后2和4h,细胞黏附率依次为 Ta-RGD/ColⅡ组>Ta-ColⅡ组>Ta-RGD组>纯Ta组,组间比较差异均有统计学意义(P<0.05)。提示RGD多肽及ColⅡ修饰多孔钽可明显促进软骨细胞在材料表面的吸附;二者混合后的黏附率高于各自分别修饰后的黏附率;其中高浓度RGD修饰多孔钽(Ta-RGD/ColⅡ 5.0g·L-1组及Ta-RGD/ColⅡ 10.0g·L-1组)强于低浓度RGD修饰多孔钽(Ta-RGD/ColⅡ 0.2g·L-1组及Ta-RGD/ColⅡ1.0g·L-1);同时各组细胞黏附率在2和4h时比较差异均有统计学意义(P<0.05)。见表1和图3(插页三)。
表1 RGD和ColⅡ修饰多孔钽与软骨细胞复合培养后细胞黏附率Tab.1 Adhesion rate of chondrocytes attached to porous tantalum modified by RGD and ColⅡ(n=6,,η/%)
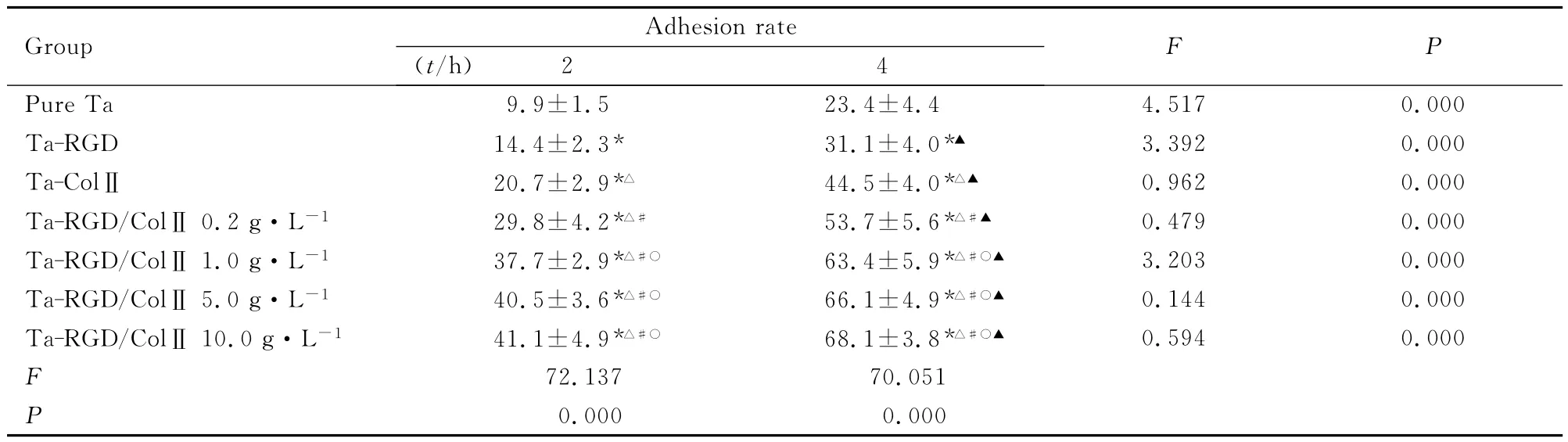
表1 RGD和ColⅡ修饰多孔钽与软骨细胞复合培养后细胞黏附率Tab.1 Adhesion rate of chondrocytes attached to porous tantalum modified by RGD and ColⅡ(n=6,,η/%)
*P<0.05compared with pure Ta group;△P<0.05compared with Ta-RGD group;#P<0.05compared with Ta-ColⅡ group;○P<0.05compared with Ta-RGD/ColⅡ0.2g·L-1group;▲P<0.05compared with 2hin the same group.
Group Adhesion rate(t/h)2 4F P Pure Ta 9.9±1.5 23.4±4.4 4.517 0.000 Ta-RGD 14.4±2.3* 31.1±4.0*▲ 3.392 0.000 Ta-ColⅡ 20.7±2.9*△ 44.5±4.0*△▲ 0.962 0.000 Ta-RGD/ColⅡ 0.2g·L-1 29.8±4.2*△# 53.7±5.6*△#▲ 0.479 0.000 Ta-RGD/ColⅡ1.0g·L-1 37.7±2.9*△#○ 63.4±5.9*△#○▲ 3.203 0.000 Ta-RGD/ColⅡ5.0g·L-1 40.5±3.6*△#○ 66.1±4.9*△#○▲ 0.144 0.000 Ta-RGD/ColⅡ10.0g·L-1 41.1±4.9*△#○ 68.1±3.8*△#○▲ 0.594 0.000 F 72.137 70.051 P 0.0000.000
2.3 RGD和ColⅡ修饰多孔钽后软骨细胞生长及增殖水平 MTT法测定各组软骨细胞1~13d时A值,结果显示:第1、3、5、7、10和13天时各组细胞增殖水平依次为Ta-RGD/ColⅡ1g·L-1组>Ta-ColⅡ组>Ta-RGD组>纯 Ta组。除第1天Ta-ColⅡ组与Ta-RGD组比较差异无统计学意义(P>0.05)外,其余各组组间比较差异均有统计学意义(P<0.05)。见表2。
2.4 扫描电镜观察RGD/多孔钽/软骨细胞复合物形态结构 RGD/多孔钽/软骨细胞复合培养4d,各组软骨细胞在多孔钽表面生长状态良好,胞质伸展、多角形并有伪足突起;7d时软骨细胞在多孔钽表面及孔隙内生长,细胞伸展,胞体嵌入孔隙内,细胞分泌细胞外基质与相邻细胞接触。有RGD修饰的多孔钽表面细胞数量明显增多并与钽结合紧密;细胞伪足跨越钽表面微孔,与其他细胞相互融合并广泛覆盖钽表面。见图3。
表2 MTT法检测RGD修饰多孔钽后软骨细胞的增殖水平Tab.2 Proliferation levels of chondrocytes on RGD-modified porous tantalum defected by MTT(n=6,)
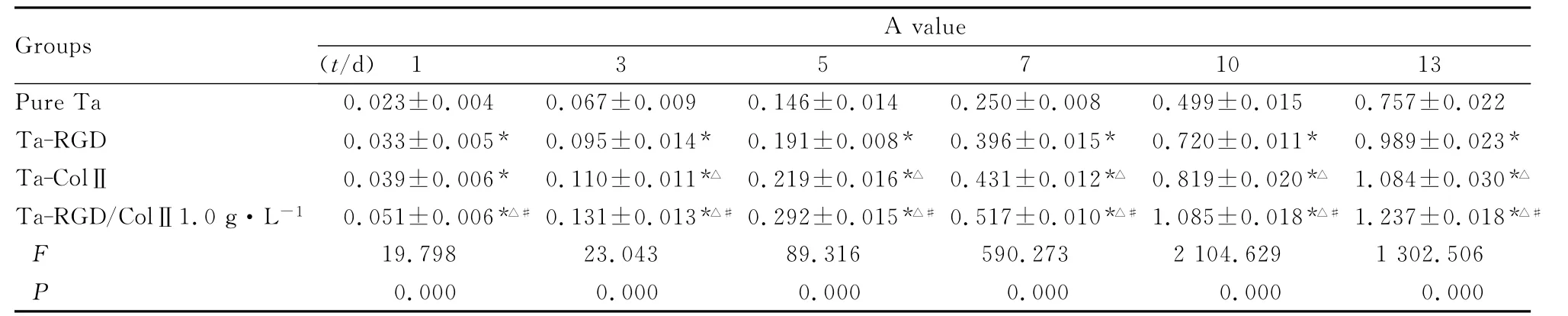
表2 MTT法检测RGD修饰多孔钽后软骨细胞的增殖水平Tab.2 Proliferation levels of chondrocytes on RGD-modified porous tantalum defected by MTT(n=6,)
*P<0.05compared with pure Ta group;△P<0.05compared with Ta-RGD group;#P<0.05compared with Ta-ColⅡgroup.
1 3 5 7 10 13 Groups A value(t/d)Pure Ta 0.023±0.0040.067±0.0090.146±0.0140.250±0.0080.499±0.0150.757±0.022 Ta-RGD 0.033±0.005*0.095±0.014*0.191±0.008*0.396±0.015*0.720±0.011*0.989±0.023*Ta-ColⅡ 0.039±0.006*0.110±0.011*△0.219±0.016*△0.431±0.012*△0.819±0.020*△1.084±0.030*△Ta-RGD/ColⅡ1.0g·L-10.051±0.006*△#0.131±0.013*△#0.292±0.015*△#0.517±0.010*△#1.085±0.018*△#1.237±0.018*△#F 19.798 23.043 89.316 590.273 2104.629 1302.506 P 0.000 0.000 0.000 0.000 0.000 0.000
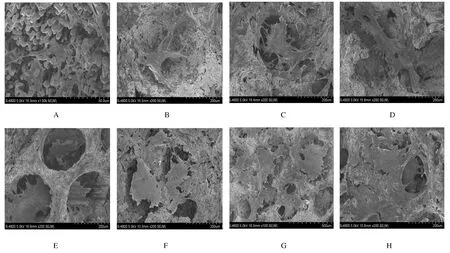
图3 RGD/软骨细胞/多孔钽复合物扫描电镜观察Fig.3 Observation of RGD/chondrocytes/tantalum composites by SEM
2.4 RGD和ColⅡ修饰多孔钽后软骨细胞中羟脯氨酸水平 按羟脯氨酸检测试剂盒说明书方法,经酶标仪测定A值,根据标准品A值计算第7天各组软骨细胞中羟脯氨酸水平。结果显示:各组软骨细胞分泌羟脯氨酸水平依次为 Ta-RGD/ColⅡ1.0g·L-1组>Ta-ColⅡ组>Ta-RGD组>软骨细胞组>纯Ta组,差异均有统计学意义(P<0.05);软骨细胞组较纯Ta组略高,二者比较差异无统计学意义(P>0.05)。见表3。
3 讨 论
当骨移植材料植入体内,材料表面与骨接触的界面对于成骨起到了决定性的作用。其影响因素诸多,如材料的理化性质(亲水性、氢键数量)、材料的空间构型(材料表面粗糙度、三维空间构型)等[6-7]。良好的移植材料在体内可以吸引体液各种成分在其表面渗透并吸附层黏连蛋白、纤维蛋白原等促进多种细胞在材料表面聚集、黏附,合成细胞外基质,最终成骨[8]。但是对于骨质较差或存在骨量流失(如骨质疏松)的人来说会存在骨结合过程减慢或骨结合强度不足,需要对移植材料表面进行不同涂层或修饰的方法来改善骨生成速度及结合强度使其具有更优越的生物相容性和骨传导作用[9]。
表3 RGD修饰多孔钽后各组软骨细胞中羟脯氨酸水平Tab.3 Levels of hydroxyproline in chondrocytes on RGD-modified porous tantalum in various groups[n=6,,ρB/(mg·L-1)]
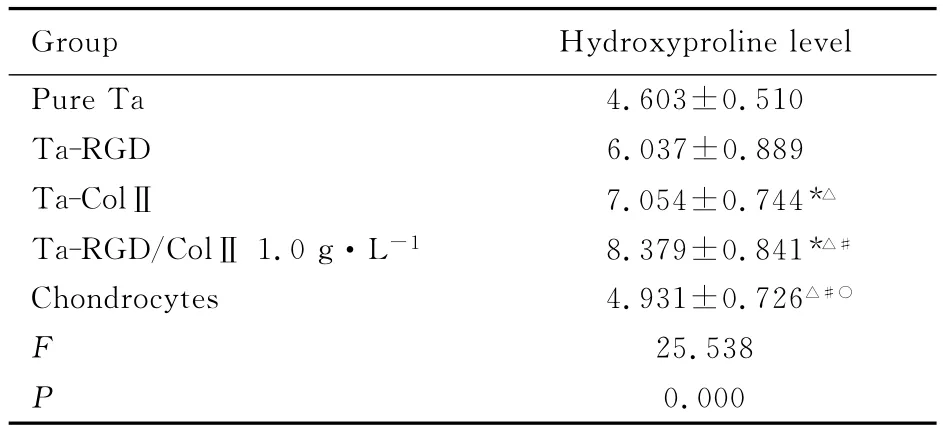
表3 RGD修饰多孔钽后各组软骨细胞中羟脯氨酸水平Tab.3 Levels of hydroxyproline in chondrocytes on RGD-modified porous tantalum in various groups[n=6,,ρB/(mg·L-1)]
*P<0.05compared with pure Ta group;△P<0.05 compared with Ta-RGD group;#P<0.05compared with Ta-ColⅡgroup;○P<0.05compared with Ta-RGD/ColⅡ1.0g·L-1group.
Group Hydroxyproline level Pure Ta 4.603±0.510 Ta-RGD 6.037±0.889 Ta-ColⅡ 7.054±0.744*△Ta-RGD/ColⅡ1.0g·L-1 8.379±0.841*△#Chondrocytes 4.931±0.726△#○F 25.538 P 0.000
多孔钽具有良好的抗腐蚀性、骨传导性、高表面摩擦力及稳定的力学结构,其力学性能接近人体自然骨。在提供足够生理支持的情况下,可以促进骨的再生、降低应力遮挡,利于骨质再生及重建,目前已广泛应用于早期股骨头坏死、关节置换、关节翻修及椎体融合等[10-11]。本实验所使用的国产多孔钽肉眼观孔径0.1~0.5mm,灰黑色,表面光洁。扫描电镜下可见材料表面及断面为孔径400~800μm的孔隙结构,分布均匀、相互连通。
RGD多肽是由精氨酸、甘氨酸和天冬氨酸组成的肽段,存在于人体ColⅠ、纤维黏连蛋白、骨桥蛋白及骨涎蛋白中,该序列能识别并结合到细胞表面整合蛋白,是细胞跨膜蛋白中整合素的特异性配体,可以介导细胞间的黏附作用,从而促进细胞黏附[12-13]。本实验体外通过物理吸附的方法将环状RGD多肽结合于多孔钽表面,与已成功应用于多种生物材料表面修饰的ColⅡ作为对照,二者与新西兰幼兔软骨细胞共同培养形成RGD/软骨细胞/多孔钽复合物,以证实其作为软骨组织工程支架材料修复软骨缺损、促进软骨再生的可行性。肉眼观察RGD修饰多孔钽后外观仍为灰黑色,表面及断面均匀分布蜂窝状孔隙,形态结构较修饰前无明显改变。扫描电镜观察多孔钽表面及断面为分布均匀的微孔结构,孔径为400~800μm,表面可见薄层状涂层覆盖。软骨细胞在其表面生长状态良好并随时间的延长细胞由单层结构变为多层,胞浆突起,伸出伪足彼此相连,细胞由多孔钽表面向内部延伸并贯穿孔与孔之间,分泌细胞外基质覆盖大部分多孔钽表面。研究[14]证明:细胞在材料表面的黏附及增殖活性是判断植入材料生物相容性的重要指标之一。Hsu等[15]体外将软骨细胞接种到RGD肽修饰的壳聚糖/藻酸盐/透明质酸钠复合支架上,不同时间点检测软骨细胞的黏附性,结果显示:软骨细胞分泌的糖胺聚糖和ColⅡ水平均较未修饰前升高;又将该细胞支架复合物植入兔关节软骨缺损处,8周后软骨缺损区完全修复。
本实验中经RGD修饰的多孔钽表面细胞增殖程度优于未修饰的纯钽组。各组间修饰效果比较:RGD修饰多孔钽后细胞黏附及增殖效果虽不及ColⅡ,但是二者混合后的修饰作用却远远大于二者各自的修饰效果;时间上比较,各组4h时细胞黏附率均大于2h;同时细胞增殖效果也随着时间的的延长而增强;不同剂量RGD修饰后细胞黏附率比较,Ta-RGD/ColⅡ5.0g·L-1组细胞修饰效果较好,细胞黏附率高,虽然 Ta-RGD/ColⅡ10.0g·L-1组细胞黏附率稍有增加,但与前者比较差异无统计学意义。以上结果证实:多孔钽经RGD修饰后可促进细胞黏附及增殖。研究[16-17]表明:RGD与材料表面稳定的结合程度是促进细胞黏附的至关重要的原因。
RGD通过与材料表面生长的细胞整合素受体结合,继而调控细胞的黏附、增殖以及各种功能。目前整合素的信号传导作用已得到实验佐证,其中纤维黏连蛋白在细胞表面的修饰作用能调节细胞黏附,这个过程是依赖RGD序列多肽与细胞外基质特异性相结合而完成的。本研究中由于RGD对多孔钽的修饰作用使其具有了更为良好的生物相容性,赋予了软骨细胞适宜的黏附和增殖环境,同时软骨细胞的分泌功能也得到了进一步的加强,软骨细胞中羟脯氨酸的分泌水平在多孔钽修饰后均大于修饰前,以Ta-RGD/ColⅡ组的效果最为明显。
综上所述,多孔钽骨移植材料经RGD修饰后促进了细胞黏附、增殖及分泌功能,使多孔钽被赋予了生物活性,为获得良好的软骨组织工程支架材料修复软骨缺损、促进软骨再生提供了可能性。
[1]Kim DG,Huja SS,Tee BC,et al.Bone in growth and initial stability of titanium and porous tantalum dental implants:a pilot canine study [J].Implant Dent,2013,22(4):339-405.
[2]Zhao C,Tan A,Pastorin G,et al.Nanomaterial scaffolds for stem cell proliferation and differentiation in tissue engineering[J].Biotechnol Adv,2013,31(5):654-668.
[3]李琪佳,王 茜,甘洪全,等.多孔钽材料细胞毒性、生物相容性及体内成骨性研究 [J].中华骨科杂志,2014,34(9):954-961.
[4]Park SY,Kim HS,Kim JH,et al.Effects of anodized titanium implant coated with RGD peptides via chemical fixation on osseointegration and bone regeneration [J].Tissue Engin Regenerat Med,2012,9(4):194-202.
[5]张 岭,李琪佳,赵季华,等.医用多孔钽材料复合大鼠软骨细胞的生长特性及功能变化 [J].解放军医学杂志,2014,39(6):464-469.
[6]汪 皖,吴海珍.RGD肽在种植体表面涂层的成骨作用 [J].中国口腔种植学杂志,2011,16(3):183-187.
[7]Rezania A,Healy KE.The effect of peptide surface density on mineralization of a matrix deposited by osteogenic cells[J].J Biomed Mater Res,2000,52(4):595-600.
[8]Lee CH,Singla A,Lee Y.Biomedical applications of collagen [J].Int J Pharm,2001,221(1):1-22.
[9]Sverzut AT,Crippa GE,Morra M,et al.Effects of typeⅠcollagen coating on titanium osseointegration:histomorphometric,cellular and molecular analyses [J].Biomed Mater,2012,7(3):035007.
[10]Amanatullah DF,Farac R,McDonald TJ,et al.Subtrochanteric fracture following removal of a porous tantalum implant [J].Case Rep Orthop,2013,2013:946745.
[11]Levine B,Sporer S,Della Valle CJ,et al.Porous tantalum in reconstructive surgery of the knee:a review [J].J Knee Surg,2007,20(3):185-194.
[12]Cavalcanti-Adam EA,Shapiro IM,Composto RJ,et al.RGD peptides immobilized on a mechanically deformable surface promote osteoblast differentiation [J].J Bone Mineral Res,2002,17(12):2130-2140.
[13]Verrier S,Pallu S,Bareille R,et al.Function of linear and cyclicRGD-containing peptides in osteoprogenitor cell adhesion process[J].Biomaterials,2002,23(2):585-596.
[14]Sawyer AA,Hennessy KM,Bellis SL,et al.Regulation of mesenchymal stem cell attachment and spreading on hydroxyapatite by RGD peptides and adsorbed serum proteins [J].Biomaterials,2005,26(13):1467-1475.
[15]Hsu S,Whu SW,Hsieh SC,et al.Evaluation of chitosanalginate-hyaluronate complexes modified by an RGD-containing protein as tissue-engineering scaffolds for cartilage regeneration [J].Artificial Organs,2004,28(8):693-703.
[16]张 弛,蒋 垚.纤维连接蛋白表面修饰对促进新型PET材料人工韧带(LARS)细胞黏附的实验研究 [J].生物骨科材料与临床研究,2009,6(5):16-20.
[17]Brian E,Joan EB,Kjeld S.In vivo study of the effect of RGD treatment on bone ongrowth on press-fit titanium alloy implant[J].Biomaterials,2005,26(17):3521-3526.
