N-乙酰半胱氨酸对纳米二氧化硅所致细胞毒性的抑制作用
2015-11-29耿维佳于永波段军超杨玉梅孙志伟
耿维佳,李 阳,于永波,于 洋,段军超,杨玉梅,邹 洋,3,孙志伟
(1.首都医科大学公共卫生学院卫生毒理与卫生化学学系,北京 100069;2.首都医科大学环境毒理学北京市重点实验室,北京 100069;3.首都医科大学附属北京友谊医院 北京热带医学研究所,北京 100050)
纳米材料(nanomaterials)是指在三维空间中至少有一个维度处于纳米尺度(1~100nm)或由其作为基本单元构成的材料。近年来,随着纳米材料在生产、生活中的广泛应用,人们对其可能导致的有害生物学效应也越加重视[1-3]。纳米二氧化硅(silica dioxide,SiO2)是应用最广泛的一种工程化纳米材料。已有研究[4]表明:纳米SiO2颗粒可通过多种暴露途径进入人体,如呼吸道和皮肤等。进入人体后,可进入血液循环,主要作用于肝、脾等网状内皮组织。有研究[5-6]表明:纳米材料致细胞毒性的主要原因是引起细胞中过量的活性氧(reactive oxygen species,ROS)产生。N-乙酰半胱氨酸(N-acetyl-cysteine,NAC)是谷胱甘肽的前体,是一种硫醇类化合物,常作为抗氧化剂被应用于细胞实验中。国内外研究[7-9]表明:NAC对纳米材料所致的细胞毒性和遗传毒性有一定的抑制作用。然而,关于NAC对纳米SiO2颗粒保护作用最适浓度的研究尚未见报道。本研究选用人正常肝细胞L-02,观察NAC对纳米SiO2颗粒导致细胞毒性的抑制作用,确定最适NAC浓度,为纳米SiO2颗粒细胞毒性的研究提供实验依据,以期能对纳米SiO2颗粒的安全性评价和合理应用提供帮助。
1 材料与方法
1.1 细胞、主要试剂和仪器 L-02细胞购自中国科学院上海生命科学研究院细胞资源中心。粒径为68nm的纳米SiO2颗粒由吉林大学化学学院惠赠,RPMI-1640培养基购自美国 Hyclone公司,胎牛血清购自美国Gibco公司,胰蛋白酶购自南京凯基生物科技发展有限公司,四甲基偶氮唑蓝(MTT)购自美国Sigma公司,NAC粉末购自北京索莱宝生物有限公司,二甲基亚砜购自沈阳试剂五厂,DCFH-DA荧光探针购自碧云天生物技术研究所,本实验所用化学试剂均为分析纯。超净工作台(NUNR公司,美国),CO2细胞培养箱(SANYO公司,日本),酶标仪(Thermo公司,美国),倒置生物显微镜(Olympus公司,日本),高速离心机(Beckman公司,美国),荧光酶标仪(Bio-Tek公司,美国)。
1.2 细胞培养 L-02细胞培养于含10%胎牛血清的RPMI-1640培养液中,加入100U·mL-1青霉素和100mg·L-1链霉素,置于37℃、5%CO2的恒温恒湿培养箱中培养。2~3d传代1次。取对数生长期细胞进行实验。
1.3 细胞存活率检测 取对数生长期细胞,用37℃水浴处理的胰蛋白酶消化后,1000r·min-1离心5min,以1×105mL-1密度接种于96孔板中,每孔100μL,并设空白孔,在37℃、5%CO2的培养箱中贴壁培养。24h后,用PBS洗细胞1次,加入用RPMI-1640稀释的不同浓度NAC工作液(1、2、5和10mmol·L-1),阴性对照组为RPMI-1640培养液,每孔100μL,每组6个复孔。37℃预处理1h后,用PBS洗细胞2次,加入无血清RPMI-1640培养液继续培养24h,每孔加入浓度为5g·L-1MTT溶液10μL,37℃孵育4h。吸去孔内液体,每孔加入二甲基亚砜100μL,摇床震荡20min。用酶标仪在490nm波长下测定各孔吸光度(A)值,计算细胞存活率。细胞存活率=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。纳米SiO2颗粒暴露组在加入NAC预处理1h后,用PBS洗细胞2次,加入用RPMI-1640稀释的50mg·L-1纳米SiO2颗粒,继续培养24h后加入MTT 10μL,在37℃条件下孵育4h,吸净液体后加入二甲基亚砜100μL,震荡20min后用酶标仪测定。
1.4 细胞形态学观察 在倒置显微镜下观察用5mmol·L-1NAC预处理后、暴露于50mg·L-1纳米SiO2颗粒的L-02细胞的数目及形态学改变。
1.5 细胞中ROS水平检测 取对数生长期细胞,用37℃水浴处理的胰蛋白酶消化后,1000r·min-1离心5min,以1×105mL-1密度接种于96孔白板中,每孔100μL,在37℃、5%CO2的培养箱中贴壁培养。24h后,先用PBS洗细胞1次,然后加入5mmol·L-1NAC工作液,在37℃预处理细胞1h,不加NAC组加入RPMI-1640培养液。用PBS洗2次,加入用RPMI-1640稀释的不同浓度纳米SiO2颗粒(10、20、50和100mg·L-1),对照组加入 RPMI-1640培养液,每孔100μL,每组6复孔,37℃染毒24h。弃培养液,用PBS洗细胞1次,加入用RPMI-1640稀释的DCFH-DA工作液,每孔100μL,在37℃避光孵育30min之后用PBS洗3次,使用荧光酶标仪测定荧光强度(激发波长488nm,发射波长525nm)。结果用6个复孔的荧光强度均值表示。
1.6 统计学分析 采用SPSS 17.0软件进行统计学分析。各组细胞存活率和荧光强度均以表示,组间比较采用方差分析。
2 结 果
2.1 不同浓度NAC预处理后细胞的存活率MTT检测结果表明:用浓度为1、2、5和10mmol·L-1NAC处理细胞1h后,细胞存活率均高于对照组,但差异无统计学意义(P>0.05)。当NAC浓度为5mmol·L-1时,细胞存活率最高,为 108.80%;当NAC浓度达到10mmol·L-1时,细胞存活率较5mmol·L-1NAC处理组有所下降,为106.87%。见表1。
2.2 不同浓度NAC预处理后暴露于纳米SiO2颗粒的细胞存活率 MTT检测结果表明:细胞暴露于50mg·L-1纳米SiO2颗粒24h后,细胞存活率下降至72.79%,与对照组比较差异有统计学意义(P<0.05)。加入不同浓度 NAC预处理,再用50mg·L-1纳米SiO2颗粒染毒24h,细胞存活率呈现随NAC浓度先升高后降低的趋势,并在5mmol·L-1时达到峰值。加入浓度为5mmol·L-1NAC对纳米SiO2颗粒所致细胞毒性的抑制作用最明显,与不加NAC的纳米SiO2暴露组比较差异有统计学意义(P<0.05)。见表2。
2.3 细胞形态学变化 在不加入纳米SiO2颗粒组中,NAC预处理组的细胞形态与不加NAC组比较无明显变化,均可见数目较多的不规则形状细胞,细胞边界清晰。加入50mg·L-1纳米SiO2颗粒后,与不加纳米SiO2颗粒的对照组比较,细胞数目明显减少,圆形固缩细胞增多,边界不清。与不加NAC组比较,NAC预处理的50mg·L-1纳米SiO2颗粒暴露组细胞数目有所增加,细胞边界较明显。见图1(插页四)。
2.4 细胞中ROS水平 细胞暴露于不同浓度纳米SiO2颗粒(10、20、50和100mg·L-1)后,随纳米SiO2颗粒浓度的升高,细胞中ROS水平呈升高趋势,50和100mg·L-1纳米SiO2颗粒暴露组与对照组比较差异有统计学意义(P<0.05)。在相同纳米SiO2颗粒浓度下,加入5mmol·L-1NAC处理组与不加NAC处理组细胞中ROS水平比较,差异均有统计学意义(P<0.05)。见表3。
表1 不同浓度NAC预处理后L-02细胞存活率Tab.1 Cell viabilities of L-02cells after pretreatment of different concentrations of NAC (,η/%)

表1 不同浓度NAC预处理后L-02细胞存活率Tab.1 Cell viabilities of L-02cells after pretreatment of different concentrations of NAC (,η/%)
Group Concentration(mmol·L-1)Cell viabilit y Control 0 100.00±13.94 NAC 1 104.51±8.082 102.31±11.545 108.80±7.6810 106.87±8.50
表2 不同浓度NAC预处理后暴露于纳米SiO2颗粒的L-02细胞存活率Tab.2 Cell viabilities of L-02cells after different concentrations of NAC pretreatment and SiO2nanoparticle exposure (,η/%)
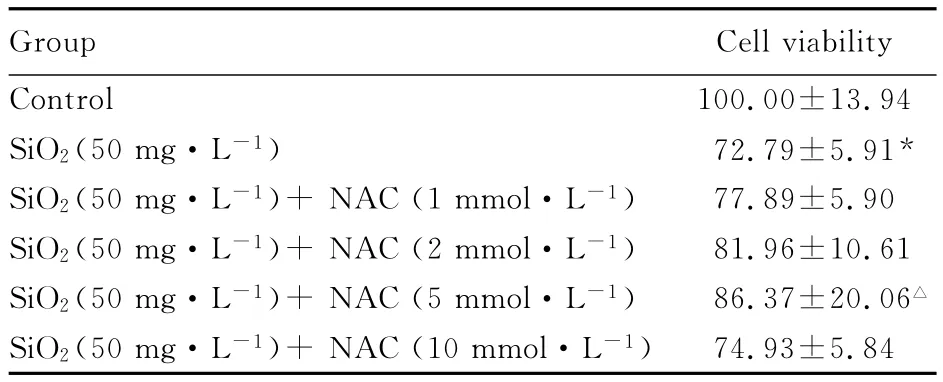
表2 不同浓度NAC预处理后暴露于纳米SiO2颗粒的L-02细胞存活率Tab.2 Cell viabilities of L-02cells after different concentrations of NAC pretreatment and SiO2nanoparticle exposure (,η/%)
*P<0.05 vs control group;△P<0.05 vs SiO2(50mg·L-1)group.
Group Cell viabilit y Control 100.00±13.94 SiO2(50mg·L-1)72.79±5.91*SiO2(50mg·L-1)+NAC(1mmol·L-1)77.89±5.90 SiO2(50mg·L-1)+NAC(2mmol·L-1)81.96±10.61 SiO2(50mg·L-1)+NAC(5mmol·L-1)86.37±20.06△SiO2(50mg·L-1)+NAC(10mmol·L-1)74.93±5.84
表3 各组L-02细胞中ROS水平Tab.3 Intracellular ROS levels in L-02cells in various groups ()

表3 各组L-02细胞中ROS水平Tab.3 Intracellular ROS levels in L-02cells in various groups ()
*P<0.05 vs control group;△P<0.05 vs SiO2(10mg·L-1)group;#P<0.05 vs SiO2(20mg·L-1)group;○P<0.05 vs SiO2(20mg·L-1)group;▲P<0.05 vs SiO2(100mg·L-1)group.
Group ROS level(fluorescence intensity Control 12.47±1.53 SiO2(10mg·L-1)12.79±0.71 SiO2(20mg·L-1)13.98±1.58 SiO2(50mg·L-1)15.40±1.98*SiO2(100mg·L-1)15.84±3.85*NAC(5mmol·L-1)10.52±0.29*SiO2(10mg·L-1)+NAC(5mmol·L-1)10.68±0.56△SiO2(20mg·L-1)+NAC(5mmol·L-1)10.58±0.21#SiO2(50mg·L-1)+NAC(5mmol·L-1)10.49±0.24○SiO2(100mg·L-1)+NAC(5mmol·L-1) 10.26±0.22)▲
3 讨 论
纳米SiO2是目前世界上大规模生产的产量最高的一种纳米粉体材料,具有化学纯度高、分散性好和比表面积大等特性,在材料、化工、纺织、军事和化妆品等领域得到广泛应用。此外,其在医药领域如药物载体、生物传感器和癌症治疗方面也有十分广阔的应用前景[10]。纳米SiO2颗粒的职业暴露、环境暴露和医源性暴露使其可通过呼吸道、消化道以及皮肤等途径进入人体,对机体造成潜在危害[11-12]。因此,本实验以人正常肝细胞 L-02作为模型研究纳米SiO2颗粒的细胞毒性,具有实际意义。
近年来,国内外一些课题组的研究[13]结果表明:纳米SiO2颗粒可被细胞摄取,分布于胞质、溶酶体和线粒体等细胞器中。纳米SiO2颗粒可导致细胞凋亡、细胞自噬,还可直接和间接损伤细胞DNA[14-15]。本课题组前期的体外实验[4]表明:急性纳米SiO2颗粒暴露可引起小鼠肝细胞出现以炎细胞浸润和肉芽肿形成为主的病理改变。随纳米SiO2颗粒给药剂量的升高,小鼠肝脏病理变化逐渐明显。在高剂量组可观察到肝细胞的空泡样改变和多处小面积的炎性细胞浸润灶。肝脏是纳米SiO2颗粒毒作用的重要靶器官。
纳米材料作用于细胞后,导致细胞中ROS水平升高是其细胞毒性和遗传毒性的主要原因。纳米颗粒特殊的理化特性,使其表面活性位点与细胞接触后,与接触面上的氧分子反应,发生超氧离子歧化反应,产生ROS。当细胞中产生大量ROS而抗氧化系统不足以清除时,一方面可以损伤细胞膜,造成多细胞器的氧化损伤;另一方面,可导致碱基氧化损伤甚至DNA链断裂。NAC是细胞实验中常用的一种ROS抑制剂,具有直接抗氧化活性和间接抗氧化活性。NAC的巯基结构可结合ROS的亲电子基团,从而消除ROS毒性。此外,NAC易于透过细胞膜,脱乙酰基后生成半胱氨酸,作为GSH 前体,实现抗氧化作用[16-18]。有研究[9]表明:NAC作为抗氧化剂可以有效抑制纳米材料对细胞的氧化损伤作用。本研究观察比较NAC对纳米SiO2颗粒所致细胞毒性的抑制作用。MTT实验结果表明:5mmol·L-1NAC既不影响L-02细胞的正常生长,又能最大限度地保护细胞。ROS测定结果表明:随着纳米SiO2颗粒浓度的升高,细胞中ROS水平呈现明显的升高趋势。纳米SiO2颗粒的浓度越高,NAC对ROS的抑制效果就越强;表明NAC能够较好地抑制细胞中ROS产生,降低纳米SiO2颗粒的细胞毒性。
综上所述,纳米SiO2颗粒可以导致L-02细胞的存活率下降和细胞中ROS水平升高,NAC能够通过抑制ROS产生,对暴露于纳米SiO2颗粒的L-02细胞起到保护作用。细胞中ROS水平升高是纳米SiO2颗粒导致人正常肝细胞毒性的作用机制之一。
[1]Radad K,Al-Shraim M,Moldzio R,et al.Recent advances in benefits and hazards of engineered nanoparticles [J].Environ Toxicol Pharmacol,2012,34(3):661-672.
[2]Wahid F,Khan T,Shehzad A,et al.Interaction of nanomaterials with cells and their medical applications[J].J Nanosci Nanotechnol,2014,14(1):744-754.
[3]Wu X,Wu M,Zhao JX.Recent development of silica nanoparticles as delivery vectors for cancer imaging and therapy[J].Nanomedicine,2014,10(2):297-312.
[4]Yu Y,Li Y,Wang W,et al.Acute toxicity of amorphous silica nanoparticles in intravenously exposed ICR mice [J].PLoS One,2013,8(4):e61346.
[5]Ye Y,Liu J,Xu J,et al.Nano-SiO2induces apoptosis via activation of p53and Bax mediated by oxidative stress in human hepatic cell line [J].Toxicol In Vitro,2010,24(3):751-758.
[6]Liu X,Sun J.Endothelial cells dysfunction induced by silica nanoparticles through oxidative stress via JNK/P53and NF-kB pathways[J].Biomaterials,2010,31(32):8198-8209.
[7]董 婷,嵇源源,王剑文,等.活性氧参与多壁碳纳米管诱导的 RAW264.7细胞毒性 [J].生态毒理学报,2013,8(1):55-60.
[8]赵宇侠,林匡飞,张 卫,等.量子点-Cu2+对L02细胞的联合毒性及NAC的防护作用 [J].中国环境科学,2012,32(1):162-167.
[9]Srivastava RK,Rahman Q,Kashyap MP,et al.Ameliorative effects of dimetylthiourea and N-acetylcysteine on nanoparticles induced cyto-genotoxicity in human lung cancer cells-A549[J].PLoS One,2011,6(9):e25767.
[10]Peng F,Su Y,Zhong Y,et al.Silicon nanomaterials platform for bioimaging,biosensing,and cancer therapy[J].Acc Chem Res,2014,47(2):612-623.
[11]Tarantini A,Huet S,Jarry G,et al.Genotoxicity ofsynthetic amorphous silica nanoparticles in rats following short-term exposure.Part 1:Oral route [J].Environ Mol Mutagen,2015,56(2):218-227.
[12]Ryu HJ,Seong NW,So BJ,et al.Evaluation of silica nanoparticle toxicity after topical exposure for 90days[J].Int J Nanomedicine,2014,9(Suppl 2):127-136.
[13]Park MV,Verharen HW,Zwart E,et al.Genotoxicity evaluation of amorphous silica nanoparticles of different sizes using the micronucleus and the plasmid lacZ gene mutation assay[J].Nanotoxicology,2011,5(2):168-181.
[14]Yu Y,Duan J,Yu Y,et al.Silica nanoparticles induce autophagy and autophagic cell death in HepG2cells triggered by reactive oxygen species[J].J Hazard Mater,2014,270:176-186.
[15]Gong C,Tao G,Yang L,et al.The role of reactive oxygen species in silicon dioxide nanoparticle-induced cytotoxicity and DNA damage in HaCaT cells [J].Mol Biol Rep,2012,39(4):4915-4925.
[16]Rushworth GF,Megson IL.Existing and potential therapeutic uses for N-acetylcysteine:the need for conversion to intracellular glutathione for antioxidant benefits [J].Pharmacol Ther,2014,141(2):150-159.
[17]Zafarullah M,Li WQ,Sylvester J,et al.Molecular mechanisms of N-acetylcysteine actions [J].Cell Mol Life Sci,2003,60(1):6-20.
[18]Sadowska AM,Verbraecken J,Darquennes K,et al.Role of N-acetylcysteine in the management of COPD [J].Int J Chron Obstruct Pulmon Dis,2006,1(4):425-434.
