鹿茸多肽对人骨髓间充质干细胞BMP-2和Runx2表达的影响
2015-11-29张洪长刘明昕律广富姜鸿远郭骏骐
张洪长,张 莹,刘明昕,潘 志,律广富,陈 港,姜鸿远,郭骏骐
(1.长春中医药大学中医药与生物工程研究开发中心药理研究室,吉林 长春 130117;2.吉林大学药学院药理学教研室,吉林 长春 130021;3.长春中医药大学图书馆参考咨询部,吉林 长春 130117;4.长春中医药大学科技处,吉林 长春 130117)
鹿茸多肽(velvet antler polypeptides,VAP)是从梅花鹿茸中提取的一种多肽类生物活性因子,具有促进骨及软骨愈合[1]、促神经再生功能[2]、加速皮肤创面的愈合[3]和提高人体的免疫能力[4-5]等功能。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨髓内的多功能干细胞,一定条件下可向成骨细胞方向转化。骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)是一种多功能蛋白,可以诱导新骨形成和骨折愈合[6],在胚胎发育过程中调节干细胞增殖分化方面有着重要的作用,且在体外能够诱导干细胞成骨和成软骨分化[7-8];BMP-2主要通过经典的Smads信号通路调节成骨分化关键转录调控因子骨特异性转录因子2(runt-related transcription factor 2,Runx2)等的表达,进而转导成成骨信号,最终促进干细胞的分化。有关VAP通过对Smads信号转导通路的影响从而促进人BMSCs(hBMSCs)中BMP-2和Runx2表达的研究目前少有报道。本研究观察VAP对hBMSCs中碱性磷酸酶(alkaline phosphatase,ALP)活性、增殖分化及BMP-2和Runx2基因、蛋白表达的影响,探讨其在BMP2/Runx2信号通路中对hBMSCs增殖和成骨分化的调控作用。
1 材料与方法
1.1 细胞、主要试剂和仪器 hBMSCs来自本课题组志愿者骨髓液(符合伦理要求实验用标本);梅花鹿VAP由长春中医药大学化学研究室提供;胎牛血清购自美国Thermo公司;DMEM培养基购自美国Gibco公司;ALP、CCK-8细胞增殖-毒性检测试剂盒、RNA-OUT总RNA提取试剂盒、总蛋白定量测试盒(BCA法)和RIPA细胞裂解液均购自南京建成生物工程研究所,Anti-Runx2、Anti-human BMP-2、辣根过氧化物酶 HRP标记的羊抗鼠二抗均购自美国R&D Systems公司,Runx2、BMP-2和β-actin蛋白均购自英国Abcam公司。CO2培养箱(新加坡ESCO公司),550型酶标仪(美国Bio-Rad公司),ABI7500PCR扩增仪(德国Biometra公司),垂直板电泳装置(美国BIO-RAD公司,Mini-ProteinⅢ),DYY40B型转印电泳槽(北京六一仪器厂),Chemi Imager 5500凝胶电泳成像分析系统(美国 Alphainno-tech Chemi Imager公司)。
1.2 hBMSCs的分离培养 本课题组志愿者签署知情同意书后,在髂后上棘穿刺采集志愿者的骨髓液5mL,将骨髓液肝素抗凝后,加等量PBS混匀,使之成为单细胞悬液,2500r·min-1离心15min。吸出试管中间骨髓单个核细胞层,加入PBS 3mL,1000r·min-1离心5min,共洗2次。弃PBS,加入培养液混匀,移至塑料细胞培养瓶中,置于37℃、5%CO2培养箱内培养48h后弃除悬浮细胞半量换液,之后每2d换液1次,利用hBMSCs可黏附于塑料培养瓶壁生长这一特性进行分离纯化[9]。细胞传代2次后基本除去非贴壁的球形骨髓造血干细胞,得到纯化的hBMSCs,选取生长良好的第3代细胞进行实验。
1.3 细胞分组和给药 将处于对数生长期的hBMSCs接种于含有10% 胎牛血清DMEM培养基的培养皿中,37℃、5%CO2的细胞培养箱中常规培养。细胞分为对照组和给药组。对照组:连续用含10%胎牛血清的DMEM培养液培养;给药组:含10%胎牛血清的DMEM培养液加终浓度为5、10、15和20g·L-1VAP培养。
1.4 ALP活性检测 hBMSCs以5×104mL-1的密度接种于96孔板,24h待其铺满孔底后更换为VAP培养液,给药组分别加入终浓度为5、10、15和20g·L-1VAP,每3d换VAP培养液1次,诱导培养3、6、9和12d后弃培养液,采用ALP试剂盒测定细胞的ALP活性,酶联免疫检测仪测定420nm处吸光度(A)值,以A值表示ALP活性,将ALP活性最高时的VAP浓度确定为其最佳浓度,作为后续实验中VAP的浓度。
1.5 CCK-8法检测hBMSCs增殖率 选择生长良好的第3代hBMSCs,以5×104mL-1的密度接种于96孔板中,每孔100μL,对照组及终浓度为10g·L-1VAP组各5孔,共60孔,置于5%CO2、37℃培养箱中,24h贴壁后每隔3d各取5孔测定细胞增殖情况。检测时吸出培养液,每孔加入不含胎牛血清的DMEM培养液100μL及CCK-810μL,CO2培养箱中孵育2h,用酶联免疫检测仪测定450nm处的A值,计算细胞增殖率。细胞增殖率=(实验组A值-对照组A值)/对照组A值×100%。
1.6 荧光定量PCR法检测hBMSCs中BMP-2和Runx2mRNA表达水平 hBMSCs以5×104mL-1的密度接种于6孔板中,每孔2mL,对照组及终浓度为10g·L-1VAP组诱导培养9d后回收,用RNA-OUT提取总RNA,逆转录,荧光定量PCR方法测定BMP-2和Runx2mRNA的表达水平,以β-actin为内参。BMP-2上游引物:5′-AGCCCTTCACTGCCATCCTGTC-3′,下游引物:5′-ATTCTCTCGTTCACCGCCCAC-3′,扩增产物长度为 89bp;Runx2 上游引物:5′-CAAAGGTGCAGCCTTTGTGTC-3′,下游引物:5′-TCACAGTCCGGATTGAGCTCA-3′,扩增产物长度为105bp;β-actin上游引物:5′-GGCAACACAGCTCACAAGAA-3′,下游引物:5′-CGCTGTTTTCACAGAGGTCA-3′,扩增产物长度为117bp。PCR反应条件:95℃、60s;95℃、15s;60℃、15s;72℃、45s;共36个循环。通过Oligo 6.0引物设计软件设计引物序列,由北京奥科生物技术有限公司合成。由计算机自动计算得出CT 值,根据所得CT值应用2-△△CT法计算BMP-2和Runx2mRNA表达水平。
1.7 Western blotting法检测hBMSCs中 BMP-2和Runx2蛋白表达水平 hBMSCs以5×104mL-1的密度接种于6孔板中,每孔2mL,对照组及终浓度为10g·L-1VAP组诱导培养9d后回收,PBS漂洗2次,加入细胞裂解液RIPA,冰上静置15min后收集裂解液,将裂解产物反复冻融裂解3次,12000r·min-1离心30min,按照 BCA-200蛋白定量试剂盒说明书进行蛋白定量,取20μg蛋白经SDS-PAGE凝胶电泳分离后,转移至PVDF膜5% 脱脂牛奶封闭2h后,孵育一抗(1∶500)4℃ 过夜。0.1%TBST洗涤3次,每次5min;加 入 用 0.1%TBST稀释的二抗(1∶1000稀释),室温孵育1h。0.1%TBST洗5次,每次5min。以ECL化学发光法检测蛋白印迹,并进行曝光、显影和定影。数码相机拍照,Image J2X软件进行分析,以特定蛋白与β-actin蛋白的灰度值比值表示蛋白表达水平。蛋白表达水平 = 特定蛋白灰度值/β-actin蛋白灰度值。
1.8 统计学分析 采用SPSS 13.0统计软件进行数据分析。各组hBMSCs中ALP活性、细胞增殖率、BMP-2及Runx2基因和蛋白表达水平以表示,多组间样本均数比较采用单因素方差分析。
2 结 果
2.1 各组hBMSCs中ALP活性 ALP活性检测结果显示:5、10、15和20g·L-1VAP组hBMSCs诱导培养3、6、9和12d后,ALP活性均高于对照组(P<0.01),10g·L-1VAP组细胞中ALP活性为最高,故后续实验皆采用此浓度。见表1。
2.2 VAP作用不同时间后hBMSCs增殖率CCK-8法检测结果显示 :与对照组比较,10g·L-1VAP组hBMSCs生长速度明显加快,贴壁后VAP诱导3d即出现了生长速度的差异,此后出现明显的生长速度差异,到第9天时,对照组和10g·L-1VAP组hBMSCs的增殖均达到高峰,且进入平台期。见表2。
2.3 荧光定量PCR检测hBMSCs中BMP-2和Runx2mRNA表达水平 hBMSCs诱导培养9d后,10g·L-1VAP组hBMSCs中 BMP-2和Runx2mRNA表达水平明显高于对照组(P<0.05)。见表3。
表1 各组hBMSCs中ALP活性Tab.1 ALP activities in hBMSCs in various groups (n=6,)
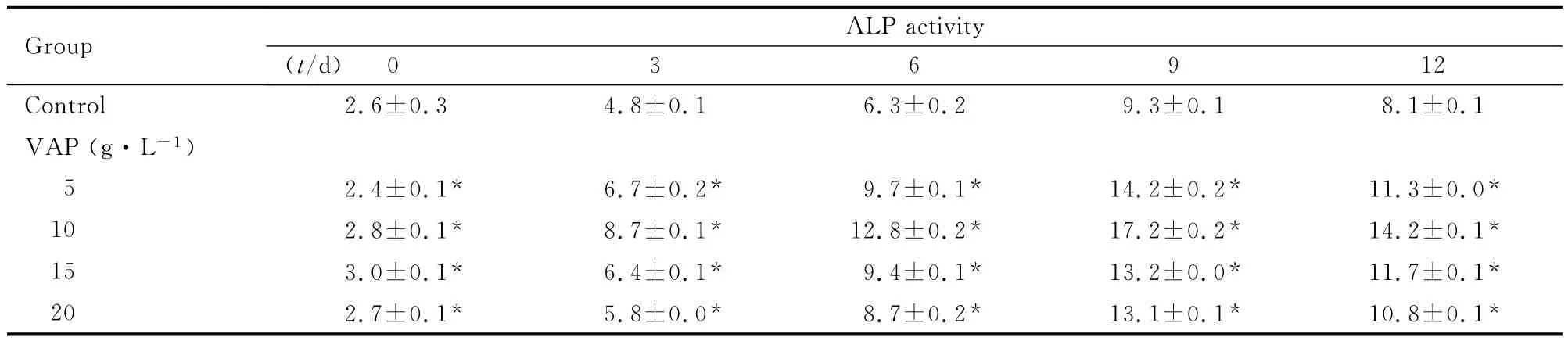
表1 各组hBMSCs中ALP活性Tab.1 ALP activities in hBMSCs in various groups (n=6,)
*P<0.01 vs control group.
y 0 3 6 9 12 Control 2.6±0.3 4.8±0.1 6.3±0.2 9.3±0.1 8.1±Group ALP activit(t/d)0.1 VAP(g·L-1)5 2.4±0.1* 6.7±0.2* 9.7±0.1* 14.2±0.2* 11.3±0.0*10 2.8±0.1* 8.7±0.1* 12.8±0.2* 17.2±0.2* 14.2±0.1*15 3.0±0.1* 6.4±0.1* 9.4±0.1* 13.2±0.0* 11.7±0.1*20 2.7±0.1* 5.8±0.0* 8.7±0.2* 13.1±0.1* 10.8±0.1*
表2 对照组和10g·L-1VAP组hBMSCs增殖率Tab.2 Proliferation rates of hBMSCs in control group and 10g·L-1VAP group(n=6,,η/%)
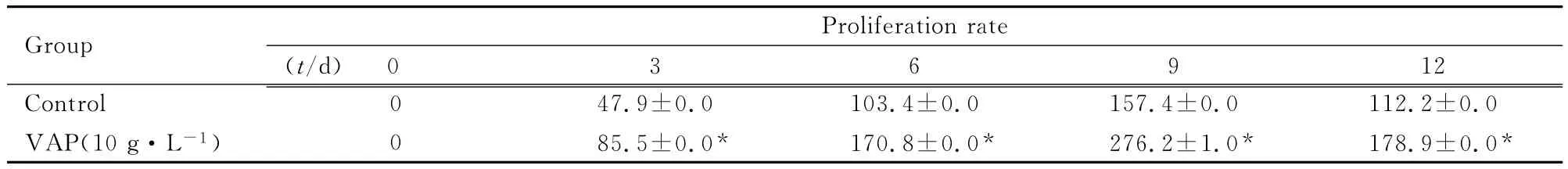
表2 对照组和10g·L-1VAP组hBMSCs增殖率Tab.2 Proliferation rates of hBMSCs in control group and 10g·L-1VAP group(n=6,,η/%)
*P<0.05 vs control group.
0 3 6 9 12 Control 0 47.9±0.0 103.4±0.0 157.4±0.0 112.2 Group Proliferation rate(t/d)±0.0 VAP(10g·L-1)0 85.5±0.0* 170.8±0.0* 276.2±1.0* 178.9±0.0*
表3 对照组和10g·L-1VAP组hBMSCs中BMP-2和Runx2mRNA表达水平Tab.3 Expression levels of BMP-2and Runx2mRNA in hBMSCs in control group and 10g·L-1VAP group()

表3 对照组和10g·L-1VAP组hBMSCs中BMP-2和Runx2mRNA表达水平Tab.3 Expression levels of BMP-2and Runx2mRNA in hBMSCs in control group and 10g·L-1VAP group()
*P<0.05 vs control group.
Group BMP-2 Runx2 Control 2.62±0.12 2.55±0.11 VAP(10g·L-1)4.75±0.15* 4.67±0.14*
2.4 Western blotting法检测hBMSCs中 BMP-2和Runx2蛋白表达水平 hBMSCs诱导培养9d后,Western blotting检测结果显示:10g·L-1VAP组hBMSCs中BMP-2和Runx2蛋白表达水平明显高于对照组(P<0.05)。见表4和图1。
表4 对照组和10g·L-1VAP组hBMSCs中BMP-2和Runx2蛋白表达水平Tab.4 Expression levels of BMP-2and Runx2protein in hBMSCs in control group and 10g·L-1VAP group(n=6,)

表4 对照组和10g·L-1VAP组hBMSCs中BMP-2和Runx2蛋白表达水平Tab.4 Expression levels of BMP-2and Runx2protein in hBMSCs in control group and 10g·L-1VAP group(n=6,)
*P<0.05 vs control group.
Group BMP-2/β-actin Runx2/β-actin Control 0.482±0.012 0.518±0.011 VAP(10g·L-1)0.725±0.010* 0.851±0.012*

图1 对照组和10g·L-1VAP组hBMSCs中BMP-2和Runx2蛋白表达电泳图Fig.1 Electrophoregram of expressions of BMP-2and Runx2protein in hBMSCs in control group and 10g·L-1VAP group
3 讨 论
VAP是从梅花鹿茸中提取的一种多肽类生物活性因子,具有促进骨及软骨愈合、促神经再生功能、加速皮肤创面的愈合和提高人体的免疫能力等药理作用,是鹿茸中最有效的成分之一。VAP可使BMSCs的增殖速度加快、ALP活性增加及成骨分化明显[10],但其中确切信号传导通路机制还不完全清楚。BMSCs是骨髓内的多功能干细胞,一定条件下可向成骨细胞方向转化。骨形态发生蛋白(bone morphogenetic proteins,BMPs)作为骨生长的启动因子,可通过调控细胞核内成骨标志基因的表达而诱导未分化间充质细胞不可逆地分化为骨系细胞[11-13],其中BMP-2是活性最强且能单独诱导成骨的因子[14-16],BMP-2通过激活 Smads信号传导和调节成骨基因转录而发挥其成骨作用。对成骨性能的观察,可以通过检测ALP活性等来进行判定[17],ALP在骨化过程中发挥重要的作用。在BMSCs中检测ALP的活性变化,有助于研究BMP-2因素对BMSCs向成骨细胞方向分化的影响。在成骨分化过程中,BMSCs能够表达一系列的成骨相关基因产物,如Ⅰ型胶原、ALP、骨桥蛋白和骨钙蛋白等,Runx2就是调节这些产物生成的重要基因之一。Runx2是成骨细胞特异性的转化因子[18],在BMSCs分化为成骨细胞的过程中发挥主导作用[19]。促进BMSCs的成骨分化过程并调节成骨细胞的成熟是Runx2基因的主要功能。BMP-2是调控Runx2基因表达较为有效的上游细胞因子之一,其可通过多种Smads基因通路诱导Runx2表达,并可能通过调节Runx2等其他转录因子来影响干细胞的成骨分化[20-22]。本研究通过观察VAP对hBMSCs中BMP-2和Runx2基因、蛋白表达的影响,阐明在BMP2/Runx2信号通路中VAP对hBMSCs增殖和成骨分化作用的可能分子机制。
综上所述,VAP能够提高hBMSCs中ALP活性,促进hBMSCs增殖分化,上调hBMSCs中BMP-2及其下游Runx2基因和蛋白的表达,这可能是VAP对hBMSCs骨形成及骨代谢影响的分子调控机制之一。
[1]Xiu ZB,Lin JH,Wu ZY,et al.Effect of pilose antler polypeptides on chondrogenic phenotype differentiation of bone marrow derived mesenchymal stem cells in vitro [J].J Clin Rehabilit Tissue Engin Res,2011,15(19):3563-3566.
[2]陈 东,孟晓婷,刘佳梅,等.鹿茸多肽对胎大鼠脑神经干细胞体外诱导分化的实验研究 [J].解剖学报,2004,35(3):240-243.
[3]牛 琼,杨欣建,刘黎军.鹿茸多肽促进皮肤创面愈合的研究 [J].内蒙古中医药,2011(23):72-73.
[4]Zha E,Li X,Li D,et al.Immunomodulatory effects of a 3.2kDa polypeptide from velvet antler of Cervus nippon Temminck [J].Int Immunopharmacol,2013,16(2):210-213.
[5]Sui Z,Zhang L,Huo Y,et al.Bioactive components of velvet antlers and their pharmacological properties [J].J Pharm Biomed Anal,2014,87:229-240.
[6]Boden SD.The ABCs of BMPs [J].Orthop Nurs,2005,24(1):49-54.
[7]Wozney J,Seeherman H.Protein-based tissue engineering in bone and cartilage repair [J].Curr Opin Biotechnol,2004,15(5):392-398.
[8]Service RF.Tissue engineers build new bone [J].Science,2000,289(5484):1498-1500.
[9]Bosnakovski D,Mizuno M,Kim G,et al.Isolation and multilineage differentiation of bovine bone marrow mesenchymal stem cells [J].Cell Tissue Res,2005,319(2):243-253.
[10]王艳双,罗 速,张大方,等.梅花鹿鹿茸I型胶原诱导骨髓基质干细胞成骨分化及其分子机制的研究 [J].时珍国医国药,2013,24(12):3056-3059.
[11]Rutherford RB,Moalli M,Franceschi RT,et al.Bone morphogenetic protein-transduced human fibroblasts convert to osteoblasts and form bone in vivo [J].Tissue Eng,2002,8(3):441-452.
[12]Ripamonti U.Soluble osteogenic molecular signals and the induction of bone formation [J].Biomaterials,2006,27(6):807-822.
[13]Yoon BS,Lyons KM.Multiple functions of BMPs in chondrogenesis[J].J Cell Biochem,2004,93(1):93-103.
[14]Huang Z,Ren PG,Ma T,et al.Modulating osteogenesis of mesenchymal stem cells by modifying growth factor availability [J].Cytokine,2010,51(3):305-310.
[15]Noel D,Gazit D,Bouquet C,et al.Short-term BMP-2 expression is sufficient for in vivo osteochondral differentiation of mesenchymal stem cells[J].Stem Cells,2004,22(1):74-85.
[16]Ryoo HM,Lee MH,Kim YJ.Critical molecular switches involved in BMP-2-induced osteogenic differentiation of mesenchymal cells [J].Gene,2006,366(1):51-57.
[17]Shimizu K,Ito A,Honda H.Mag-seeding of rat bone marrow stromal cells into porous hydroxyapatite scaffolds for bone tissue engineering [J].J Biosci Bioeng,2007,104(3):171-177.
[18]Karsenty G.Role of Cbfa1in osteoblast differentiation and function [J].Semin Cell Dev Biol,2000,11(5):343-346.
[19]Satija NK,Gurudutta GU,Sharma S,et al.Mesenchymal stem cells:molecular targets for tissue engineering [J].Stem Cells Dev,2007,16(1):7-23.
[20]Matsubara T,Kida K,Yamaguchi A,et al.BMP2 regulates Osterix through Msx2and Runx2during osteoblast differentiation [J].J Biol Chem,2008,283(43):29119-29125.
[21]王翠艳,魏芳晶,阴淑莹,等.大鼠骨髓间充质干细胞的分离、培养和鉴定 [J].中国老年学杂志,2013,33(5):1086-1088.
[22]王婷婷,周雪颖,刘黎青,等.骨髓间充质干细胞诱导分化为心肌细胞的研究进展 [J].中国老年学杂志,2013,34(4):1144-1145.
