基于微流控芯片的尿酸和抗坏血酸并行电化学检测研究*
2015-11-29陆佳庆MorimotoRyo刘军山胡帅龙
徐 征,陆佳庆,Morimoto Ryo,刘军山,胡帅龙
(大连理工大学辽宁省微纳米技术及系统重点实验室,辽宁大连116024)
基于微流控芯片的尿酸和抗坏血酸并行
电化学检测研究*
徐 征*,陆佳庆,Morimoto Ryo,刘军山,胡帅龙
(大连理工大学辽宁省微纳米技术及系统重点实验室,辽宁大连116024)
尿样和血样中的尿酸水平是诊断痛风等疾病的重要指标,传统检测方法存在时间长、需要其他辅助试剂等不足,开展了在微流控芯片上对尿酸进行电化学检测的研究:以碳纳米管修饰的丝网印刷电极片为检测单元,构建了PDMS微流控芯片。以微流控芯片为平台,采用微分脉冲伏安法(DPV)对尿酸和抗坏血酸分别进行检测,确定其原始峰值电位。最后,实验测试和分析比较了不同浓度尿酸和抗坏血酸对电化学检测信号的影响。研究结果表明:用DPV法分别检测尿酸和抗坏血酸,测得峰电流与样品浓度均有较好的线性度;从并行检测信号中能够分辨出尿酸和抗坏血酸的氧化峰位;尿酸和抗坏血酸对彼此的DPV峰位无明显影响,但对DPV电流峰值有一定抑制作用。
微流控芯片,电化学检测,微分脉冲伏安法,尿酸
尿酸(Uric aAcid,UA)是嘌呤代谢的产物,正常人体尿酸约1 200 mg,负责体内羟基自由基和单态氧的还原。但当代谢异常等引起体内尿酸浓度升高时,会导致尿结石、痛风等疾病,尿酸水平已成为诊断痛风的重要指标[1-3]。目前临床上采用酶促反应和吸收光度法测量尿酸浓度,其不足是需要多种辅助试剂和检测时间较长[4]。电化学方法通过测定电化学氧化还原反应中电荷传递来确定物质种类和浓度,具有灵敏度高、响应速度快等特点,不需要使用透镜等光学元件[5-6]。但由于血样和尿样中往往存在与尿酸化学特性相近的多种抗氧化物,会对尿酸检测信号有干扰。近年来,人们针对电化学检测尿酸的灵敏度和特异性开展研究,发现利用纳米材料改性电极能够有效从样品中测得尿酸含量。例如:Sun等通过循环伏安法并行检测尿酸等,发现石墨烯/Pt复合修饰的电极在检测特异性和线性方面优于裸碳电极[7]。Sheng等使应用微分脉冲伏安法(Differential pulse voltammetry,DPV)同时测试尿酸等物质,其尿酸检测灵敏限可达5.0 μmol·L-1[8]。
微流控技术是指在平方厘米大小的基片上集成多种功能单元,形成微流控芯片。将电化学检测方法与微流控技术相融合,能够减少样品量、缩小仪器体积、提高检测速度[9],常用的制造微流控芯片材料包括玻璃以及各种聚合物,其中聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)在微流控芯片制造中使用最为广泛,具有制造简单、耐腐蚀、无毒性等优点。然而,制造电化学检测芯片需要在芯片上集成微细电极,但PDMS比表面能低(表面张力20.6 mN·m-1[10]),其热膨胀系数也与金属差异大(PDMS:3.1×10-6m·K-1,Pt:8.8×10-4m·K-1[11])。这样,通过溅射、沉积等MEMS工艺在PDMS表面制作电极极易出现断裂和褶皱现象,器件成品率低。Qiu等研制了一种用于尿酸等电化学检测的PDMS微流控芯片,首先对微沟道内的样品进行电泳分离,然后在微沟道出口处进行电化学检测,对尿酸和抗坏血酸的检测灵敏度分别为20 μmol·L-1和3.6 μmol·L-1,但芯片中的三电极体系是利用碳纤维和金属丝构建的,组装复杂,电极一致性难以保证[12]。另一种解决途径是在玻璃或其他热塑性聚合物表面制造电极图形,然后与具有微沟道结构的PDMS片组合形成复合微流控芯片[13-14],但由于电极薄膜具有百纳米级的凸起厚度,这会导致在电极区域附近出现密封不完全等问题,在使用中容易产生气泡和漏液。
本文针对上述问题,提出了一种利用碳纳米管修饰的丝网印刷电极片构建PDMS微流控芯片的新方法,通过增加中间胶合层解决了电极区域的密封问题,降低了芯片制造难度。采用DPV法在芯片中对尿酸和抗坏血酸进行了并行测试,最后分析了抗坏血酸含量对尿酸检测信号的影响。
1 实验设备及检测方法
1.1 微流控芯片设计与制作

图1 芯片
如图1(a)所示,芯片由具有微沟道结构的盖片、含电化学检测电极的基片和中间胶合层组成,其中微沟道宽度500 μm,反应区宽5 mm、长1 cm,采用PDMS材料制备。采用碳纳米管修饰的丝网印刷电极片(110CNT-GNP,Dropsens)作为电化学检测电极,其工作电极表面修饰有碳纳米管材料,起增强电荷传导和扩大接触面积的作用,如图1(a)所示,工作电极的直径为4 mm。对电极是与工作电极间隔0.75 mm的一段圆环,它的材料是碳,参考电极为银电极。为避免电极表面高出基片表面引起的键合不完全问题,本文选择了胶合法封接芯片,胶合层采用聚对苯二甲酸乙二醇酯(Polyethylene terephthalate,PET)双面胶。芯片制造步骤如下:
①基片模具制造。基片模具是利用SU8胶光刻固化成型制造的,过程如下:在抛光玻璃片上甩80 μm厚的SU8胶;前烘60分钟(80℃);曝光30 s(MA/BA6,SUSS MicroTec);后烘45分钟(80℃);显影去胶,得到微沟道的反模结构。基片成形:将混合均匀、除气充分的PDMS原液(Sylgard184,Dow Corning)倾倒于基片模具上,固化80分钟(70℃),手工脱模和打储液池孔,获得基片。
②盖片成形。将电极片相同尺寸的金属片粘接在抛光玻璃片上形成盖片模具,浇注PDMS原液,固化脱模,获得盖片。
③中间胶合层加工。利用开模工具在PET双面胶开与检测区域相近的通孔。
④封接。将上述部件在显微镜下对准和加压封接,获得芯片,如图1(b)所示。
1.2 电化学检测设备与材料
尿酸在电位适宜的条件下会被氧化成尿囊素,该反应一般看作不可逆反应。对于抗坏血酸,它与其氧化产物脱氢抗坏血酸有平衡关系。然而,由于脱氢抗坏血酸和水结合后分解,会生成二酮古洛糖酸,而二酮古洛糖酸是难以还原的物质,这样抗坏血酸的氧化反应也是近似不可逆的[15,16]。由于二者的电化学反应均不可逆,采用伏安循环法并不能测到还原峰,因此本文选择微分脉冲伏安法检测尿酸和抗坏血酸。检测仪器是CHI650E电化学分析仪(上海辰华),扫描电压范围为0.05 V~0.8 V,扫描增量为0.005 V,扫描周期为0.5 s,扫描脉冲宽度为0.05 s,扫描灵敏度为1 μA/V。样品溶液是在PBS缓冲液基础上配置的,PBS缓冲液采用磷酸二氢钠和磷酸氢二钠配置,pH值为3,配置溶液所用尿酸和抗坏血酸从大连美仑生物公司购买。
2 实验结果与分析
2.1 抗坏血酸和尿酸电化学特性的DPV测试
本文利用同一芯片和相同的检测参数,分别对不同浓度的尿酸和抗坏血酸进行检测,首先将待测溶液注入芯片,待样品分布基本稳定后开始电化学扫描。
图2是对于不同浓度的尿酸扫描检测结果,尿酸浓度范围为0.1 mmol·L-1~0.4 mmol·L-1。可知:尿酸的高峰电位基本与尿酸浓度无关,均保持在0.35 V左右,变化范围在0.01 V内。图2显示了是不同浓度的尿酸与氧化峰电流绝对值的对应关系,拟合可得到Ipa=4.14CUA+0.35,R=0.996(相关系数)。
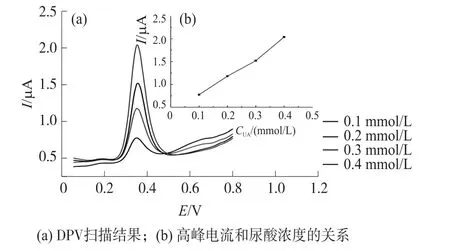
图2 不同浓度的尿酸检测结果
图3是对于不同浓度的抗坏血酸扫描检测结果,抗坏血酸浓度范围为0.01 mmol·L-1~1.00 mmol·L-1。当浓度低于0.025 mmol·L-1时,无法分辨出有效氧化峰;抗坏血酸的高峰电位与其浓度无关,保持在0.2 V左右,变化范围在0.04 V之内。图3给出了不同浓度的抗坏血酸与氧化峰电流对应关系,拟合可得到Ipa=1.91CAA+0.63,R=0.994(相关系数)。
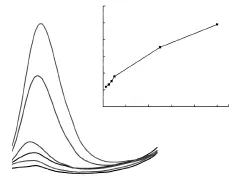
图3 不同浓度的抗血坏酸检测结果
2.2 抗坏血酸和尿酸的DPV法并行检测
DPV法能够检测到不同浓度尿酸和抗坏血酸的电化学响应,本节在两种溶液混合条件下对其电化学特性进行检测。实验分别对不同浓度的尿酸和抗坏血酸的混合溶液检测,将待测溶液注入芯片,在样品分布基本稳定后开始电化学扫描。本文对于检测溶液调配固定尿酸浓度分别为0.1 mmol·L-1、0.2 mmol·L-1、0.3 mmol·L-1、0.4 mmol·L-1,在同种浓度尿酸溶液中改变抗坏血酸的浓度,分别从0.025 mmol·L-1到0.1 mmol·L-1不等。
从图4可以观察到在不同浓度的尿酸溶液中检测中,在检测电压范围内都存在两个明显的峰值,且两个峰没有重叠。尿酸的高峰电位为0.35 V,不同浓度下高峰电位的差异在0.05 V以内;抗坏血酸的高峰电位在0.2 V左右,随着抗坏血酸浓度的增加,高峰电位有所增加,变化也在0.05 V之内。与尿酸和抗坏血酸单独检测的结果对比,两者的高峰电位基本不变,这说明抗坏血酸的加入对尿酸的高峰电位没有影响,反之亦然。
并行检测时尿酸和抗坏血酸的高峰电流差值如表1所示。对比分别对尿酸和抗坏血酸的独立检测的结果,尿酸的高峰电流差值从分别检测时的1.2 μA降低到0.94 μA;抗坏血酸的高峰电流差值从分别检测时的0.3 μA降低到0.14 μA。说明在并行检测尿酸和抗坏血酸时,两者的检测信号是存在相互干扰的。尿酸的存在对抗坏血酸的检测信号有抑制作用,在尿酸浓度为0.3 mmol·L-1时抑制效果最明显,此外抗坏血酸的存在对尿酸的检测信号也有抑制作用,这种作用在抗坏血酸浓度为0.075 mmol·L-1时最明显。

图4 尿酸和抗坏血酸并行检测的结果

表1 尿酸和抗坏血酸的高峰电流差值
进一步比较尿酸和抗坏血酸同时检测时两者高峰电流与浓度的关系,如图5所示。
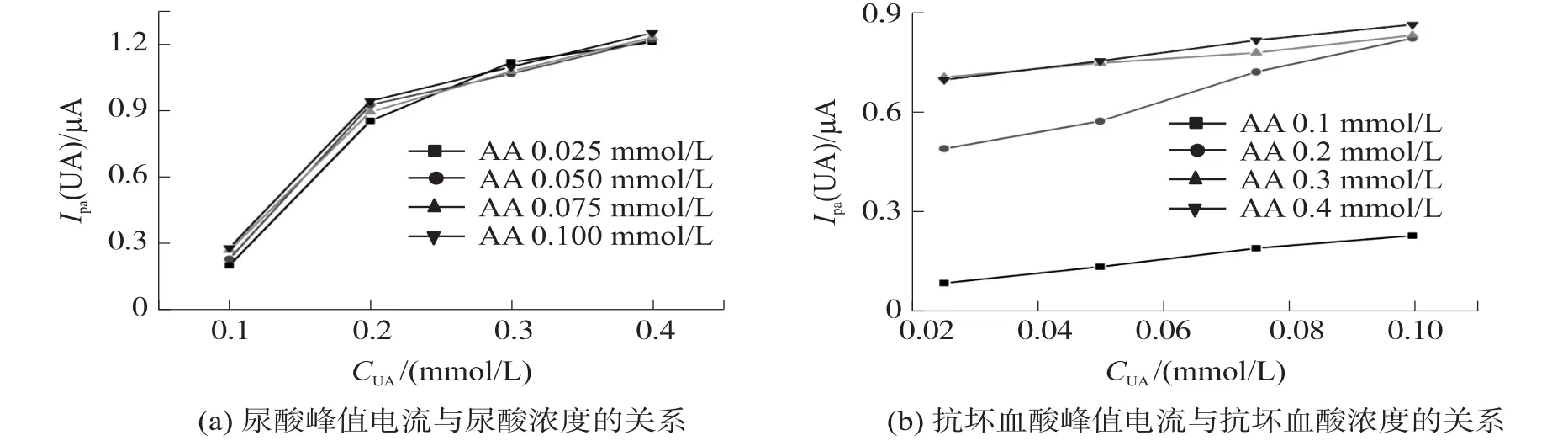
图5
尿酸浓度与高峰电流之间呈现了函数关系,在各浓度抗坏血酸中,尿酸浓度与高峰电流的线性相关系数R分别为0.933、0.918、0.938、0.926,均小于0.99,表明抗坏血酸的加入对于尿酸浓度与高峰电流值之间的线性关系是有影响,当尿酸浓度为0.1 mmol·L-1时对线性关系的影响最大。这是由于在并行检测尿酸和抗坏血酸时,由低到高依次扫描的,而抗坏血酸的反应电位低于尿酸,所以抗坏血酸会先反应,其产物吸附于电极表面,从而部分抑制了尿酸的反应。抗坏血酸浓度与其高峰电流值在不同浓度尿酸检测条件下仍呈近似线性关系,不同尿酸浓度下,相关系数R都接近于1,分别为0.997、0.994、0.995、0.998,与单独检测抗坏血酸时的现象相似。但是,与单独检测相比,曲线的拟合斜率有波动,从1.91分别变为1.95、4.6、1.65、2.26。
3 结论
①以碳纳米管修饰的丝网印刷电极片为检测单元,构建了PDMS微流控芯片,通过增加中间胶合层解决了电极区域的密封问题。
②以微流控芯片为平台,采用DPV法对尿酸和抗坏血酸分别进行检测,发现尿酸的氧化峰出现在0.35 V,而抗坏血酸的氧化峰出现在0.2 V。对两种物质,氧化峰的电位均与样品浓度无关,而高峰电流值与样品浓度呈现线性相关性。
③研究了并行检测中尿酸和抗坏血酸的相互干扰作用,发现能够从DPV扫描信号中分辨出尿酸和抗坏血酸的氧化峰位;尿酸和抗坏血酸对彼此的DPV峰位无明显影响,但对DPV电流峰值有一定抑制作用。
本文为尿酸等人体抗氧化物质的快速和低成本检测提供了一种可行的方法。
[1]Rock K L,Kataoka H,Lai J J.Uric Acid as a Danger Signal in Gout and Its Comorbidities[J].Nature Reviews Rheumatology,2013,9(1):13-23.
[2]王酉,徐惠,李光.基于碳纳米管修饰丝网印刷碳糊电极的葡萄糖和尿酸生物传感器[J].传感技术学报,2006,19(5):2077-2080.
[3]Sulem P,Gudbjartsson D F,Walters G B,et al.Identification of Low-Frequency Variants Associated with Gout and Serum Uric Acid Levels[J].Nature Genetics,2011,43(11):1127-1130.
[4]Zhao Y,Yang X,Lu W,et al.Uricase Based Methods for Determination of Uric Acid in Serum[J].Microchimica Acta,2009,164(1-2):1-6.
[5]Sancy M,Francisco Silva J,Pavez J,et al.Simultaneous Electrochemical Detection of Dopamine,Ascorbic Acid and Uric Acid Using Copper-Phthalocyanine Functionalized Mwcnts[J].Journal of the Chilean Chemical Society,2013,58(4):2117-2121.
[6]Yan J,Liu S,Zhang Z,et al.Simultaneous Electrochemical Detection of Ascorbic Acid,Dopamine and Uric Acid Based on Graphene Anchored with Pd-Pt Nanoparticles[J].Colloids and Surfaces B:Biointerfaces,2013,111:392-397.
[7]Sun C L,Lee H H,Yang J M,et al.The Simultaneous Electrochemical Detection of Ascorbic Acid,Dopamine,and Uric Acid Using Graphene/Size-Selected Pt Nanocomposites[J].Biosensors and Bioelectronics,2011,26(8):3450-3455.
[8]Sheng Z H,Zheng X Q,Xu J Y,et al.Electrochemical Sensor Based on Nitrogen Doped Graphene:Simultaneous Determination of Ascorbic Acid,Dopamine and Uric Acid[J].Biosensors and Bioelectronics,2012,34(1):125-131.
[9]许媛媛,边超,陈绍凤,等.基于微/纳米加工技术的微型电化学免疫传感器研究[J].传感技术学报,2006,19(5):2149-2152.
[10]Sauer B B,Dee G T.Molecular Weight and Temperature Dependence of Polymer Surface Tension:Comparison of Experiment with Theory[J].Macromolecules,1991,24(8):2124-2126.
[11]Weber M J.Handbook of Optical Materials[M].Boca Raton:CRC Press,2002.
[12]Qiu J,Hu P,Liang R.Separation and Simultaneous Determination of Uric Acid and Ascorbic Acid on a Dynamically Modified Poly(Dimethylsiloxane)Microchip[J].Analytical Sciences,2007,23(12):1409-1414.
[13]Liu J,Qin J,Li J,et al.Monolithic Integration of Three-Material Microelectrodes for Electrochemical Detection on PMMA Sub-Strates[J].Electrochemistry Communications,2013,31:20-23.
[14]Walker C E,Xia Z,Foster Z S,et al.Investigation of Airbrushing for Fabricating Microelectrodes in Microfluidic Devices[J].Electroanalysis,2008,20(6):663-670.
[15]Wang Yazhen.The Electrochemistry of Uric Acid at a Gold Electrode Modified with L-Cysteine,and Its Application to Sensing Uric Urine[J].Microchim Acta,2011,172:419-424.
[16]Li Gang,Yang Suling,Qu Lingbo,et al.Simultaneous Voltammetric Determination of Ascorbic Acid and Uric Acid Using a Nafion/Multi-Wall Carbon Nanotubes Composite Film-Modified Electrode[J].Solid State Electrochem,2011,15:161-166.

徐 征(1973-),男,河南郑州人,博士,副研究员,1997年于吉林工业大学获得学士学位,2000年于吉林工业大学获得硕士学位,2004年于大连理工大学获得博士学位,主要从事微纳制造和微纳流体等研究工作,xuzheng@dlut.edu.cn;

陆佳庆(1989-),女,硕士,研究方向为微机电系统。
Simultaneous Electrochemical Detection of Uric Acid and Ascorbic Acid with Microfluidic Chips*
XU Zheng*,LU Jiaqing,Morimoto Ryo,LIU Junshan,HU Shuailong
(Key Laboratory for Micro/Nano Technology and System of Liaoning Province,Dalian University of Technology,Dalian Liaoning 116024,China)
Uric acid(UA)level in urine and blood serum can be used to diagnose several diseases such as gout.However conventional methods based on enzymatic reaction and colorimetric techniques require a long time and a great amount of cost for other reagents.Electrochemical detection of uric acid with microfluidic chips was developed:A PDMS microfluidic chip with a screen-printed electrode plate modified by carbon nano-tubes was fabricated.With the chip,UA and ascorbic acid(AA)were detected using differential pulse voltammetry(DPV)method.The effect of UA and AA on the electrochemical responses was experimentally investigated and analyzed.The results showed that:The oxidation peak current was proportional to the concentration of UA and AA over the detection range respectively.For simultaneous detection of UA and AA,two well-separated voltammetric peaks could be obtained in various levels of concentration.Both UA and AA had no significant effect on the position of voltammetric peak,but restrained each other’s peak currents.
microfluidic chip;electrochemical detection;differential pulse voltammetry;uric acid
O657.1;R318.08
A
1004-1699(2015)08-1103-05
��2575;7320T
10.3969/j.issn.1004-1699.2015.08.001
项目来源:辽宁省教育厅重点实验室基础研究项目(NO.LZ2014005)中央高校基本科研业务费专项资金(NO.DUT14LAB07)
2015-03-14 修改日期:2015-05-16
