乙型肝炎表面抗原阳性对免疫抑制状态下小鼠肝癌复发的影响
2015-11-27高伟葛亮天津市第一中心医院器官移植中心天津3009天津市儿童医院天津300074
高伟,葛亮(.天津市第一中心医院器官移植中心,天津 3009; .天津市儿童医院,天津 300074)
供体缺乏已成为制约肝移植发展的主要瓶颈。边缘供肝的使用是目前扩大供体来源的主要方式之一。目前国内外均有应用乙型肝炎表面抗原(HBsAg)阳性供肝行肝移植术的研究报道,证实了HBsAg阳性供肝的安全性[1-3]。本中心曾尝试应用HBsAg阳性供肝治疗晚期肝癌患者,但术后随访患者均死于肝癌复发,因此HBsAg阳性供肝是否会促进肝癌患者肿瘤复发仍需进一步验证。本实验建立乙型肝炎病毒(HBV)转基因小鼠移植性肝癌模型,对其进行免疫抑制药物干预,比较免疫抑制状态下血清学HBsAg阳性与阴性小鼠肝脏肿瘤的复发及进展,为临床应用HBsAg阳性供肝进行肝移植治疗以挽救晚期肝癌患者的可行性提供理论依据。
1 材料与方法
1.1 研究材料
1.1.1 实验动物:Balb/c雄性小鼠30只,8~10周龄,体重18~22 g,购于天津市奥易德实验用品有限公司。HBV转基因Balb/c雄性小鼠30只,8~10周龄,体重18~22 g,购于中国人民解放军第四五八医院。
1.1.2 主要试剂:小鼠肝癌H22腹腔积液型肿瘤细胞株(购于北京银紫晶生物医药技术有限公司),甲泼尼龙琥珀酸钠(购于美国辉瑞公司),环孢素A(购于瑞士诺华制药公司),增殖细胞核抗原(PCNA)抗体(购于美国Epitomics公司),血管内皮生长因子(VEGF)抗体(购于美国Epitomics公司),细胞间黏附分子-1(ICAM-1)抗体(购于北京鼎国昌盛生物技术有限公司)。
1.2 研究方法
1.2.1 实验分组:30只雄性HBV转基因Balb/c小鼠为实验组,30只普通雄性Balb/c小鼠为对照组,分别于术后1、2、3周处死小鼠,每组每次为10只。
1.2.2 肿瘤细胞的制备:从液氮中取出冻存的小鼠H22肝癌细胞株,常规复苏,用生理盐水调整肿瘤细胞浓度为1×107个/ml,无菌条件下用1ml BD注射器直接注入Balb/c小鼠腹腔0.1 ml(细胞数为1×106个)。小鼠接种H22肝癌细胞9天后无菌抽取癌性腹腔积液,锥虫蓝染色,显微镜下观察肿瘤细胞存活率>95%,常规计数细胞,生理盐水调整肿瘤细胞浓度为2×107个/ml,4℃备用。
1.2.3 手术过程:称量小鼠体重,用5%水合氯醛(5 ml/kg)进行腹腔麻醉。麻醉满意后,以仰卧位用胶带将其固定于手术台上,切口周围备皮,并以安尔碘消毒。于腹正中线偏左作一长约0.8 cm左右的纵形切口,无菌棉棒充分暴露脾脏,用1 ml BD注射器于小鼠脾包膜下注入已制备好H22肝癌细胞株0.05 ml,细胞数为1×106个,缓慢退出针头,并在针眼处用无菌棉棒压迫5~10分钟,防止出血,观察无出血后逐层缝合关腹。
1.2.4 术后管理:术后给予自由饮食、饮水;仍以普通饲料为饮食,饮自来水。术后每天给予腹腔注射环孢素A 5 mg /(kg·d)、甲泼尼龙琥珀酸钠10 mg /(kg·d),模拟移植术后免疫抑制状态。
1.2.5 术后取材:分别于术后1、2、3周称量体重;眼球摘除法取血,检测血清HBsAg表达。剖腹观察肝脏肿瘤复发率、肿瘤大小、肿瘤数量;取下肝脏称重,置于4%甲醛水溶液固定,用于病理学检查及免疫组化染色。
本实验中动物处置方法符合动物伦理学标准。
1.2.6 指标检测及方法
1.2.6.1 肝癌复发观察分级:Ⅰ级,单个小的瘤灶1~5个(直径均在1 mm以下);Ⅱ级,小的瘤灶在肺内弥散分布,6~10个或单个中等转移灶(直径在1~2 mm之间);Ⅲ级,小的转移灶呈广泛分布(几乎所有肝叶),或存在几个大的转移灶(直径在2 mm以上)。
1.2.6.2 HBsAg检测、肝组织病理学观察及PCNA、VEGF、ICAM-1的表达检测:血清HBsAg检测采用ELISA试剂盒;肝组织病理标本以常规苏木素-伊红(HE)染色;应用免疫组化检测肝组织中PCNA、VEGF及ICAM-1的表达。分别计算阳性指数:高倍镜下取5个不同视野,各计数100个癌细胞,计算阳性细胞所占百分率。采用评分标准[4]:A为阳性细胞所占百分率分级:0%~1%=0分、1%~10%=1分、10%~50%=2分、50%~80%=3分、80%~100%=4分;B为阳性细胞显色强度分级:0分(阴性)、1分(弱阳性;淡黄色)、2分(阳性;棕黄色)、3分(强阳性;棕褐色)。免疫反应积分(IHS)=A×B。
1.3 统计方法:采用SPSS 17.0统计软件对数据进行处理。计量资料以均数±标准差(±s)表示,采用t检验或单因素方差分析;计数资料用率表示,采用χ2检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 两组小鼠不同时间点术前体重、处死时体重及肝脏的重量(表1):实验组与对照组术后1、2、3周术前体重(P值分别为0.16、0.27、0.07)、处死时体重(P值分别为0.48、0.96、0.73)与肝脏重量(P值分别为0.29、0.41、0.20)比较差异均无统计学意义。
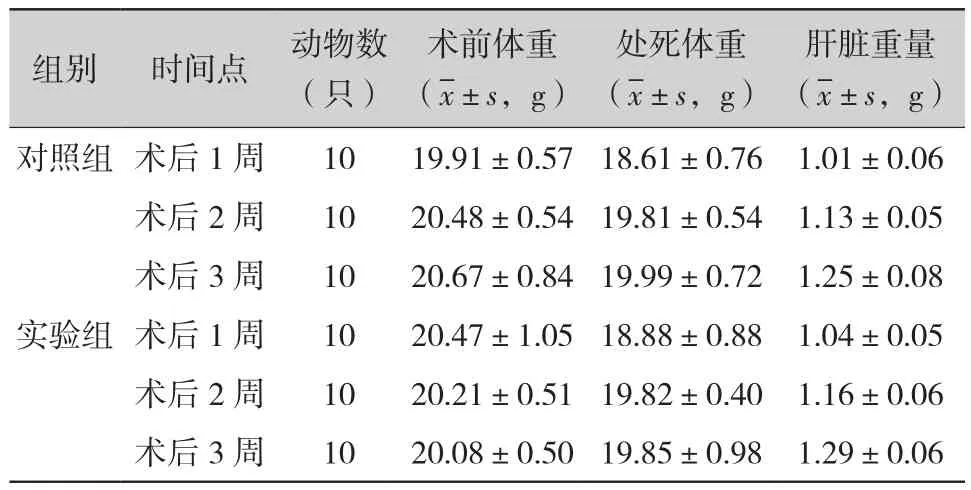
表1 两组小鼠不同时间点术前体重、处死时体重及肝脏重量的比较
2.2 两组小鼠不同时间点肿瘤复发情况(表2)实验组与对照组术后1、2、3周肿瘤复发率(P值分别为1、0.653、0.606)及肿瘤复发程度分级比较(P值分别为1、0.935、0.952)差异均无统计学意义(均P>0.05)。
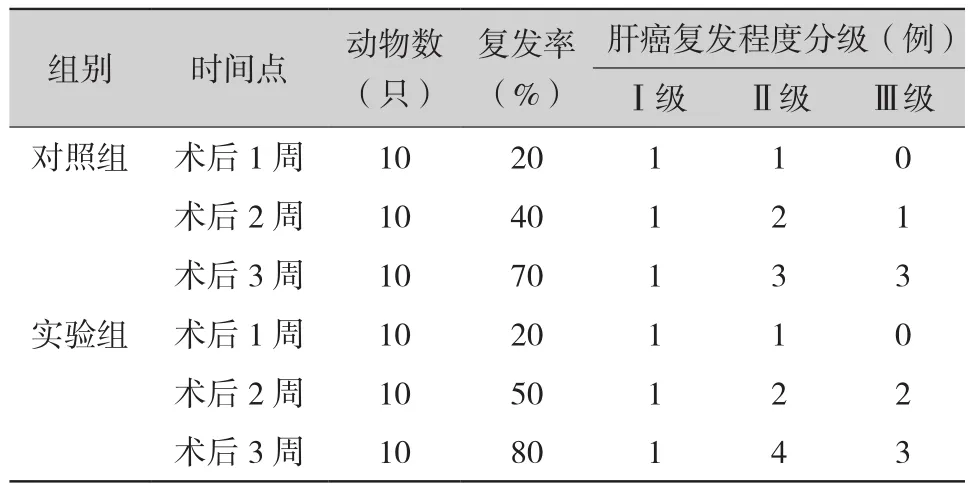
表2 两组小鼠不同时间点肿瘤细胞接种数及肝癌复发情况
2.3 两组小鼠不同时间点血清中HBsAg表达:实验组小鼠不同时间点血清HBsAg均为阳性,而对照组小鼠不同时间点均为阴性。
2.4 两组小鼠不同时间点肝组织病理学改变(图1):对照组(1a)和实验组(1b)小鼠术后1周肝组织HE染色偶见灶状的肿瘤组织,其余肝小叶结构正常;对照组与实验组小鼠术后2周肝组织HE染色(1c、1d)均可见肝组织内片状的肿瘤病灶,可见核分裂象;术后3周对照组与实验组(1e、1f)肝组织可见现弥漫性肿瘤病变,正常肝组织受压,肝小叶结构消失,核分裂象明显。术后1、2、3周两组病理学改变未见明显不同。
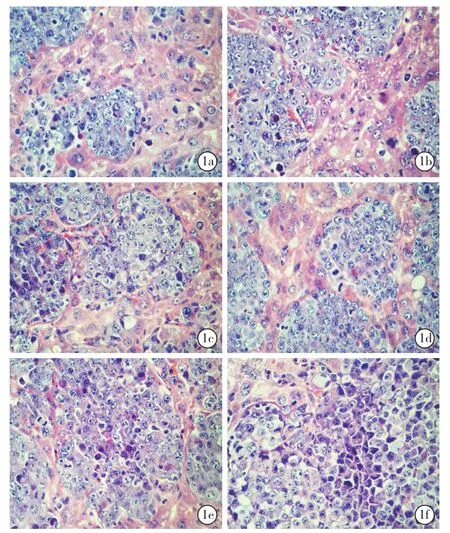
图1 光镜下观察两组小鼠不同时间点肝组织病理学改变 对照组小鼠术后1周(a)和实验组术后1周(b)肝组织偶见灶状的肿瘤组织,其余肝小叶结构正常;对照组术后2周(c)和实验组术后2周(d)肝组织均可见片状的肿瘤病灶;对照组术后3周(e)和实验组术后3周(f)可见弥漫性肿瘤病变,肝组织受压,肝小叶结构消失,核分裂现象明显 HE 高倍放大
2.5 两组小鼠不同时间点肝组织中PCNA、VEGF及ICAM-1的表达情况(表3;图2~4)
2.5.1 光镜下两组小鼠不同时间点PCNA的表达(图2):术后1周对照组(2a)和实验组(2b)均可见到肿瘤细胞核少量表达,其阳性率分别为22.80%±5.51%、22.20%±5.85%;术后2周对照组(2c)和实验组(2d)均可见到肿瘤细胞核阳性表达增强,其阳性率分别为43.60%±6.95%、44.20%±6.07%;术后3周对照组(2e)和实验组(2f)均可见肿瘤细胞广泛表达,其阳性率分别为56.80%±9.14%、53.40%±7.92%。实验组与对照组之间术后1、2、3周PCNA的阳性指数(P值分别为 0.81、0.84、0.39)和 HIS(P 值分别为 0.40、0.62、0.50)比较差异均无统计学意义(均P>0.05)。
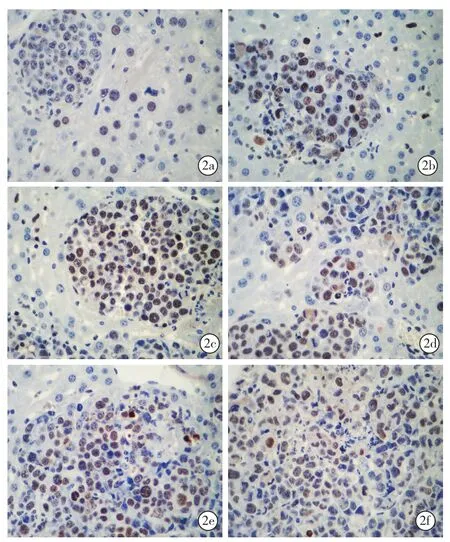
图2 光镜下观察两组小鼠不同时间点肝组织PCNA的表达 术后1周:对照组(a)和实验组(b)均可见肿瘤细胞核少量表达;术后2周:对照组(c)和实验组(d)可见肿瘤细胞核表达均增强;术后3周:对照组(e)和实验组(f)均可见肿瘤细胞广泛表达 免疫组化 高倍放大
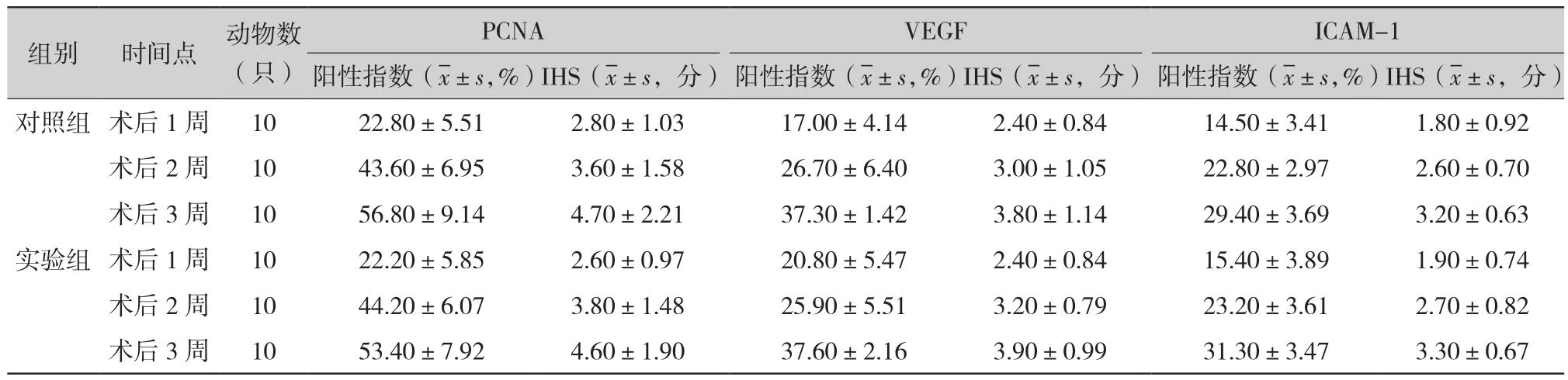
表3 两组小鼠不同时间点PCNA、VEGF及ICAM-1表达情况比较
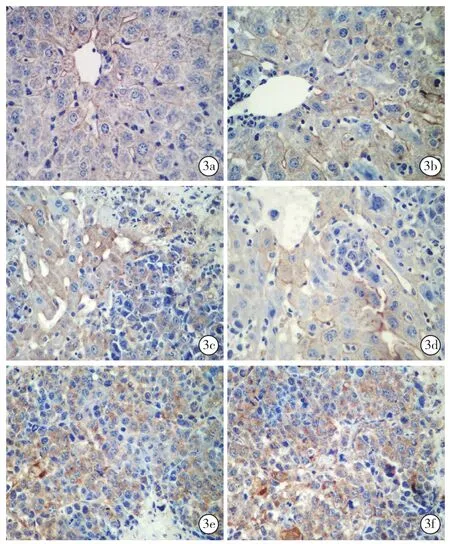
图3 光镜下观察两组小鼠不同时间点VEGF的表达术后1周:对照组(a)和实验组(b)可见肝窦少量表达;术后2周:对照组(c)和实验组(d),可见肝窦及肿瘤细胞间少量表达;术后3周:对照组(e)和实验组(f)可见肿瘤细胞间表达明显呈阳性免疫组化 高倍放大
2.5.2 光镜下两组小鼠不同时间点VEGF的表达(图3):术后1周对照组(3a)和实验组(3b)可见肝窦少量表达,阳性率分别为17.00%±4.14%、20.80%±5.47%;术后2周对照组(3c)和实验组(3d)可见肝窦及肿瘤细胞间少量表达,阳性率分别为26.70%±6.40%、25.90%±5.51%;术后3周对照组(3e)和实验组(3f)可见肿瘤细胞间表达明显呈阳性,其阳性率分别为37.30%±1.42%、37.60%±2.16%。实验组与对照组之间术后1、2、3周VEGF的阳性指数(P值分别为0.09、0.77、0.91)和HIS(P值分别为1、0.64、0.84)比较差异均无统计学意义(均P>0.05)。
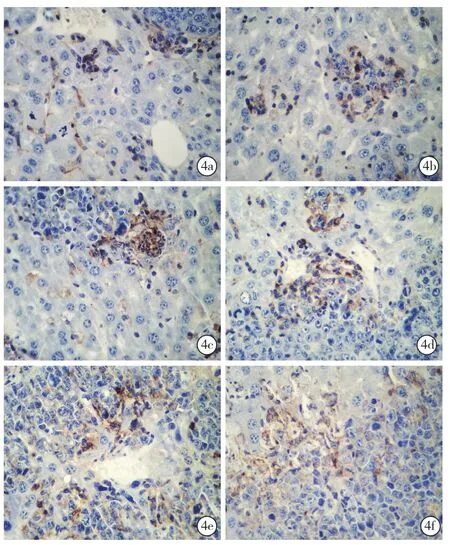
图4 光镜下观察两组小鼠不同时间点肝ICMA-1的表达 术后1周:对照组(a)和实验组(b)可见肝组织间少量表达;术后2周:对照组(c)和实验组(d)可见肿瘤组织少量表达,阳性率分别为22.80±2.97、23.20±3.61;术后3周:对照组(e)和实验组(f)可见肿瘤细胞均较多表达,免疫组化 高倍放大
2.5.3 光镜下两组小鼠不同时间点ICAM-1的表达(图4):术后1周对照组(4a)和实验组(4b)可见肝组织间少量表达,阳性率分别为14.50%±3.41%、15.40%±3.89%;术后2周对照组(4c)和实验组(4d)可见肿瘤组织少量表达,阳性率分别为22.80%±2.97%、23.20%±3.61%;术后3周对照组(4e)和实验组(4f)可见肿瘤细胞均较多表达,阳性率分别为29.40%±3.69%、31.30%±3.47%。实验组与对照组之间术后1、2、3周ICAM-1的阳性指数(P值分别为0.59、0.79、0.25)和HIS(P值分别为0.79、0.77、0.74)比较差异均无统计学意义(均P>0.05)。
3 讨 论
本实验通过建立小鼠肝癌复发模型,比较HBsAg阳性与HBsAg阴性小鼠在不同时间点的肿瘤复发情况。结果显示,两组小鼠在肿瘤复发率、肿瘤复发程度、肝组织病理学以及免疫组化(PCNA、VEGF及ICAM-1表达)方面均未见显著性差异,由此表明在免疫抑制状态下血清学HBsAg阳性对小鼠肝癌复发并无显著影响。该实验结果与目前研究认识不一致,因为HBV是导致肝癌形成的重要因素的观点已被大量研究所证实[5-8]。综合考虑,其原因可能为:① 乙肝病毒导致癌作用并不是在感染病毒之后很快就表现出来,而是经过一个长期的过程,或历经肝脏纤维化后才导致肿瘤形成,HBV转基因小鼠通常需要18月才会产生原发性肝癌。所以在肝癌肝移植术后早期HBsAg阳性供肝对肿瘤复发并未产生影响。② 肝癌肝移植术后肿瘤复发的机制主要是微转移灶的形成,其对肝癌复发的作用可能要远远超过HBsAg阳性供肝的影响,从而可能掩盖后者对肿瘤复发的作用。本实验是通过脾包膜下接种肿瘤细胞,是从肝癌复发机制出发来建立的动物模型,存在较为明显的微转移灶,因此得出了免疫抑制状态下血清学HBsAg阳性对小鼠肝癌复发并无明显影响的结论。③ 由于时间、技术和费用的关系,本实验动物模型并未完全符合临床肝癌肝移植术后肿瘤复发的标准,有可能对实验结果造成影响。
肝脏移植目前已成为治疗各种终末期肝病和部分肝脏恶性肿瘤的最有效手段之一,但供体缺乏是制约肝移植发展的最主要瓶颈。边缘供肝的使用是目前扩大供体来源的主要方式之一[9]。目前,国内外均有应用HBsAg阳性供肝行肝移植术的安全性报道。我们也尝试应用HBsAg阳性供肝治疗晚期肝癌患者,但术后患者均死于肝癌复发。因此HBsAg阳性供肝是否会促进肝癌患者肿瘤复发需要进一步验证。本实验结果证实HBsAg阳性在免疫抑制状态下对肝癌复发无显著影响。本实验部分模拟HBsAg阳性供肝对肝移植术后肿瘤复发的动物模型,这对研究HBsAg阳性供肝对肝移植术后肿瘤复发的影响具有一定的指导意义。因此,笔者认为在HBV相关的肝癌患者中,可考虑应用HBsAg阳性供肝行肝移植术。该方法是安全有效的,一方面能够使患者缩短等待供体时间,提高患者预后,另一方面能够在一定程度上缓解供肝短缺的窘境,具有非常重要的意义。
