吲哚-2,3-二酮衍生物抗病毒活性研究进展
2015-11-27郝小江
陈 刚,郝小江
(1.西安石油大学 化学化工学院,陕西 西安 710065;2.中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,云南 昆明 650204)
吲哚-2,3-二酮是一种广泛存在于天然产物中结构较为简单的生物碱,在伞形科植物当归、十字花科植物菘蓝(俗称Chinese woad)、草大青的根和爵床科植物马蓝的根、茎中都有发现,也是著名中药青黛中的一种重要成份[1-3].此外,其在人体器官、体液,尤其在脑内海马等部位有较多分布[4-6].吲哚-2,3-二酮及其衍生物具有多种生物活性,对其在抗肿瘤、抗病毒、神经保护等方面的活性进行研究非常有意义[7-9].吲哚-2,3-二酮由于其结构简单,目前可以采用苯胺为原料大量合成,其价格也相对较低,并且在吲哚-2,3-二酮的1,2,3位及苯环上可以发生不同类型的反应,为其衍生物的合成提供了便利的条件,因此目前其合成和活性的研究备受关注.本文对近年来吲哚-2,3-二酮衍生物的抗病毒活性研究进行介绍和综述.
1 抗HIV活性
AIDS病是由艾滋病病毒,即人类免疫缺陷病毒(HIV)感染而引起的一种传染性疾病.HIV病毒进入人体后破坏人体的免疫功能,继而发生一系列不易治愈的机会性感染(OI)和肿瘤,最后导致患者死亡.OI的感染与发展导致的疾病伴随有HIV复制的加快,使得携带HIV病毒的人迅速转化为典型的艾滋病人,因此理论上理想的药物应该既能抑制HIV的复制又能够治疗像肺结核这样的机会性感染.SRIRAMA等[10-15]基于此设想在吲哚-2,3-二酮的1,3位引入了有较好生物活性的噻唑环、嘧啶、磺胺类、喹诺酮类诺氟沙星等化合物来寻找一种既能抑制HIV复制又能抑制其他病菌感染的药物.
噻唑环及其衍生物广泛存在于具有生物活性的分子中,常见于抗生素类药物.PANDEYA等[10]通过缩合反应和Mannich反应得到了图1所示的I类Schiff碱-Mannich碱化合物,化合物中R为H或者Cl、Br,N原子上为通过Mannich反应得到的胺甲基结构单元.这一类化合物虽对沙门氏菌等微生物和HIV病毒有一定的抑制作用,但是活性并不高,尤其是对HIV病毒的选择性系数(SI)小于1.他们将喹诺酮类引入到吲哚-2,3-二酮的3位合成了如图1所示的II类吲哚-2,3-二酮Schiff碱-Mannich碱衍生物[11].通过对这些合成的化合物抑制人MT-4细胞中HIV-1的复制活性评价发现:该类化合物的EC50和CC50在>8~>54μmol/L,但SI均小于1,这一类化合物在显示出明显毒性时还未表现出有效的活性.
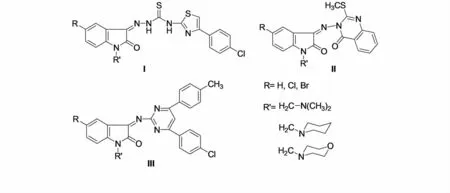
图1 PANDEYA和SELVAM合成的Schiff碱-Mannich碱化合物Fig.1 The Schiff base and Mannich base synthesized by PANDEYA and SELVAM
嘧啶类化合物具有较好的生物活性,SELVAM等[12]将氨基嘧啶引入该类化合物得到了图1所示的III类化合物.该类化合物对鼠伤寒沙门氏菌等28种细菌的抑制活性,与甲氧苄啶和磺胺甲噁唑相比,除对绿脓杆菌和肠炎沙门氏菌的活性较低外,对其他26种细菌的抑制活性均高于后两者或者相当.从所有化合物的活性来看,R取代基的活性顺序为Br>Cl>H.对白色念珠菌等8种真菌的抑制作用与克霉唑相比,除对奥杜盎小孢子菌、石膏样毛癣菌、石膏小孢子菌的抑制作用相当或者略低,对其他的真菌的抑制作用都低于后者.通过对这些合成的化合物抑制人MT-4细胞中HIV-1的复制活性的评价发现:该类化合物的EC50为>1~>10μmol/L,但SI均小于1.
磺胺类药物是常用的杀菌药物,SELVAM等[13]将磺胺类化合物与吲哚-2,3-二酮通过缩合反应合成了如图2所示的吲哚-2,3-二酮Schiff碱衍生物,其中R1为H或者乙酰基,R2为H、CH3或者Cl、Br.这些化合物在严重感染的人MT-4细胞中都有抑制HIV-1、HIV-2复制的活性,乙酰基取代的R1活性有所下降,卤素取代的R2也使底物的活性下降;当R1为甲基、R2为H时对HIV-1抑制活性最高,EC50=8.1mg/L;当R1、R2为H时对HIV-2抑制活性最高,EC50=41.5mg/L.这些化合物对HIV-1的抑制活性(EC50)高于HIV-2,虽活性高于X类化合物但明显的低于ATZ,而CC50却高于ATZ(>125∶65.9).
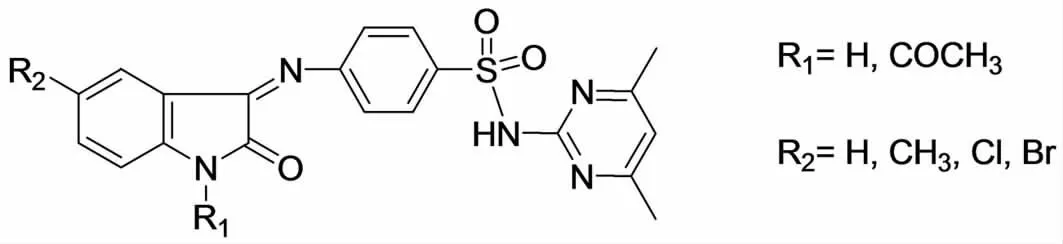
图2 SELVAM合成的吲哚-2,3-二酮磺胺类Schiff碱化合物Fig.2 The Schiff base of sulfonamide and indole-2,3-dione synthesized by SELVAM
诺氟沙星(Norfloxacin)也是常用的杀菌消炎药物,具有广谱低毒的特点.SURENDRA等[14]首先将吲哚-2,3-二酮与磺胺类化合物缩合得到Schiff碱化合物,进而通过Mannich反应将Norfloxacin结合到吲哚酮上得到如图3所示的Schiff碱-Mannich碱化合物.该类化合物有较广谱的抑菌活性,除对葡萄状球菌等28种细菌的抑制活性较差外,对新型隐球菌等8种真菌都有较好抑制活性,活性高于Norfloxacin或者与之相当,并且对荚膜组织孢浆菌的抑制作用高于克霉唑(Clotrimazol).当R为卤素、R′为第三个取代基的化合物S8、S9显示了良好的抗HIV-1活性,其EC50为11.3、13.9,并且SI也较高,分别为5和4.
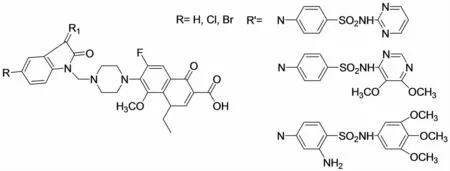
图3 SURENDRA合成的吲哚-2,3-二酮Schiff碱-Mannich碱化合物Fig.3 The Schiff base-Mannich base synthesized by SURENDRA
TANUSHREE等[15]通过对一系列抗HIV病毒药物结构的研究,推测图4中所示的蝶形单元(butterfly-like)为药物的药效中心:一个亲水点A为母体,两个疏水点B、C为翅膀.而后以3-缩氨基硫脲为先导化合物通过Mannich反应得到了图5所示的化合物,R为通过Mannich反应得到的胺甲基结构单元.该类化合物对HIV-1都有一定的抑制作用,EC50在2.62~>14.50μmol/L.具有图示R1、R3取代基的化合物对HIV-1有较好的抑制作用,其EC50在3μmol/L左右,并且SI也较高(4.12、17.14、12.02).
肺结核病(TB)是艾滋病人最常感染的病,能最终导致死亡.感染HIV的病人其初期的症状多数是肺结核,因此是否具有抗TB活性也是抗HIV药物的重要评价指标.拉米夫定(Lamivudine)能有效抑制活跃的病毒继续繁殖,对慢性B型肝炎患者控制病情有显著疗效.DHARMARAJAN等[16]将Lamivudine与吲哚-2,3-二酮缩合得到Schiff碱化合物,再与甲醛和诺氟沙星衍生物在微波促进下经Mannich反应得到了如图6所示的Schiff碱-Mannich碱化合物.合成的所有化合物都对HIV-1有一定的抑制作用,但Mannich碱单元并未使活性提高;化合物3b(R1为F,N上H未被取代)则显示了很高的活性:EC50=(0.074 2±0.04)μmol/L,并且SI大于2 100;对照实验品Lamivudine的EC50=(0.1±0.05)μmol/L,SI大于2 000.同时对肺结核病毒抑制活性的研究发现:在6.25mg·L–1时化合物3对病毒的抑制率达到82%,而Lamivudine在此浓度下对病毒没有抑制作用.该化合物活性虽好,但前体药物的利用不但要依靠其穿过细胞膜时的稳定性,还要看在细胞体内向母体化合物的转化情况.离体实验表明这两类化合物较易水解,其水解半衰期为120~240min,还需对此进行进一步的优化.

图4 目前治疗艾滋病药物和先导化合物中的蝶形单元Fig.4 The butterfly-like unit in anti-ADIS drugs and lead compound
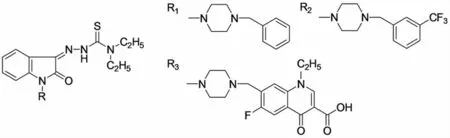
图5 具有蝶形单元的吲哚酮类似物Fig.5 The indole analogues with the butterfly-like unit
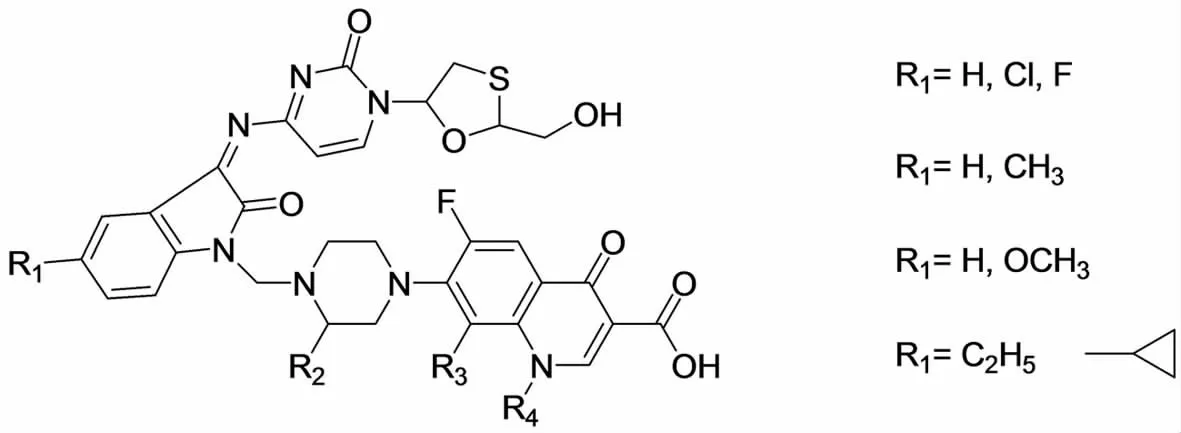
图6 DHARMARAJAN合成的吲哚-2,3-二酮Schiff碱-Mannich碱化合物Fig.6 The Schiff base-Mannich base synthesized by DHARMARAJAN
2 抗痘病毒活性
痘病毒(Orthopoxviruses)为病毒粒最大的一类DNA病毒,其结构较为复杂.病毒粒呈砖形或椭圆形,大小为(300~450)nm×(170~260)nm.有核心、侧体和包膜,核心含有与蛋白结合的病毒DNA.DNA为线型双链,相对分子质量为(85~240)×106,鸟嘌呤和胞嘧啶的碱基含量低.病毒粒中有30种以上的结构蛋白和几种酶,核心蛋白中含依赖于DNA的RNA多聚酶.病毒在细胞质内增殖,形成包涵体,病毒粒由微绒毛或细胞裂解而释放.感染人和动物后常引起局部或全身化脓性皮肤损害,昆虫、鸟类、哺乳动物都能感染,并可能在种间传播,因此高致病的痘病毒害有可能用作生物武器.吲哚-2,3-二酮-3-缩氨基硫脲(IBT)和N-甲基吲哚-2,3-二 酮-3-缩氨基硫脲(marboran或者methisazone)是痘病毒的一种强的抑制剂,早期用来治疗天花[17].后来体内和离体的实验都没有能够确切地证实IBT类衍生物的功效,尤其是在疾病传播模型试验中[18-19].后来BORYSIEWICZ等[20-22]在离体和Swiss鼠体内实验证明methisazone能够抑制天花病毒(VV)并能够降低脑内接种VV-IHD的Swiss鼠死亡率.Cidofovir(CDV)等抑制痘病毒的药物的作用机制是干扰DNA聚合酶的活性[23],但是如果天花作为生物武器使用那就必须要具有多种作用机制的治疗药物[24].PRICHARD等[25-26]的研究显示IBT和marboran能够中止病毒信使核苷酸的形成,在病毒转录伸长时IBT和marboran直接作用在DNA聚合酶复合物,或者在转录过程中作为上调或者下调转录延长因子.MICHAEL等[27]对IBT又从苯环取代基和1位取代基进行了结构优化得到了如图7所示的4个化合物.这4个化合物对VV的抑制作用除3{8,4}稍差之外其余3个活性和IS值均高于CDV、IBT和marboran;对CV的抑制作用3{8,4}、3{8,9}活性稍差与marboran相当,3{8,1}、3{8,10}活性和IS值均 高 于CDV、IBT和marboran.前人的研究表明IBT和marboran具有预防和治疗天花病的作用.DEBRA等[22]通过腹膜内对感染VV或者CV的小鼠给药,发现这两种药物降低了VV的致死量,marboran能够延迟或抑制病毒在肝、脾、肾部的复制但是IBT却不能;这两种药物对皮肤感染VV或者CV的小鼠不能降低病毒复制或者减轻症状.结果显示这类药物由于缺乏体内抑制CV活性,用来治疗“原痘病毒”(orthopox)的可能性不大.
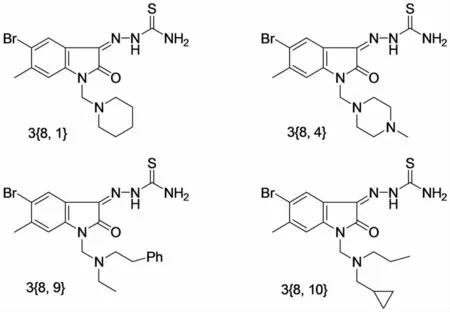
图7 MICHAEL对IBT结构优化得到的4个化合物Fig.7 The 4compounds optimized from IBT by MICHAEL
3 抗SARS病毒活性
非典型肺炎给人类健康带来极大的危害,引起全球关注.导致严重急性呼吸系统综合症(SARS)的病毒属于冠状病毒科,病毒粒子多呈圆形,有囊膜,外周有冠状排列的纤突,病毒直径在80~120 nm之间.病毒分布于细胞浆中,感染病毒的细胞线粒体肿胀,部分线粒离体膜或嵴溶解.2003年SARS在中国的爆发引起了巨大的恐慌,研究SARS病毒的抑制剂为将来防治SARS提供保障意义重大.CHEN等[28-29]的研究发现N-取代的吲哚-2,3-二酮化合物对SARS冠状病毒有抑制作用.他们合成了一系列苯环上取代的和N原子上有取代基的吲哚-2,3-二酮衍生物,实验发现该类化合物选择性 抑 制SARS冠 状 病 毒3CL蛋 白(SARS-CoV 3CLpro,图8),并且活性较高,其中如图所示的两个化合物的IC50值达到了0.98和0.95μmol/L,并且对其他半胱氨酸和丝氨酸蛋白也有较好的抑制活性.
LIU等[30]通过图9和图10的途径合成了两类吲哚酮衍生物,并评价了其对SARS-CoV 3CLpro的抑制活性,结果显示具有磺酸基的吲哚-2,3-二酮结构的8k1具有最好的活性,IC50达到1.04μmol/L.总体来看关于SRAS病毒的研究比较薄弱,目前也仅停留在对其CoV 3CL蛋白的抑制作用的研究方面,如需成药还要进行大量的实验.
4 其他病毒
柯萨奇病毒B3(CVB3)是一类常见的经呼吸道和消化道感染人体的病毒,感染后人会出现发热、打喷嚏、咳嗽等感冒症状.妊娠期感染可引起非麻痹性脊髓灰质炎性病变,并致胎儿宫内感染和致畸.ZHANG等[31]合成了一系列吲 哚-2,3-二酮腙(图11),研究发现ID45抑制CVB3复制的活性最高.用ID45处理CVB3感染前后的细胞,都可以显著减小病毒颗粒的大小,可以起到保护细胞,减小受到病毒诱导凋亡的风险.同时,ID45可以引起细胞葡萄糖调节蛋白78(GRP78)活性的显著上调,活化蛋白激酶样ER激酶(PERK),不能上调eIF2α磷酸化,但激活了核转录因子Nrf2.
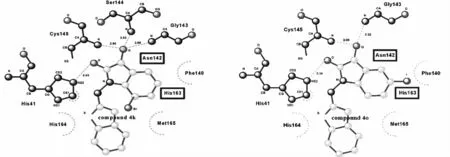
图8 化合物4k和4o及其与SARS CoV 3CLpro结合的模拟Fig.8 The combination model of 4kand 4owith SARS CoV 3CLpro

图9 LIU等合成的羧基和环烷基吲哚-2,3-二酮Fig.9 The carboxyl and naphthenic indole-2-3-dione synthesized by LIU
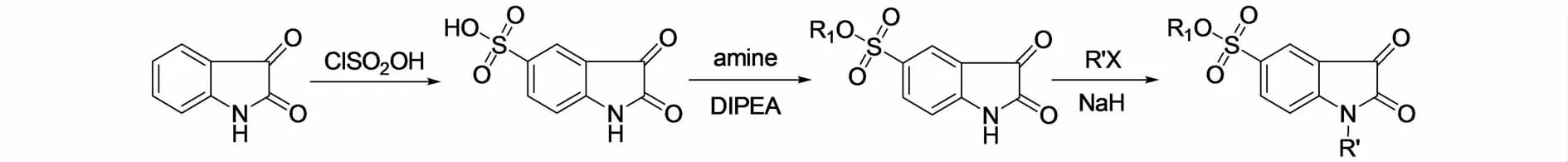
图10 LIU等合成的磺酸基吲哚-2,3-二酮Fig.10 The sulfo indole-2-3-dione synthesized by LIU
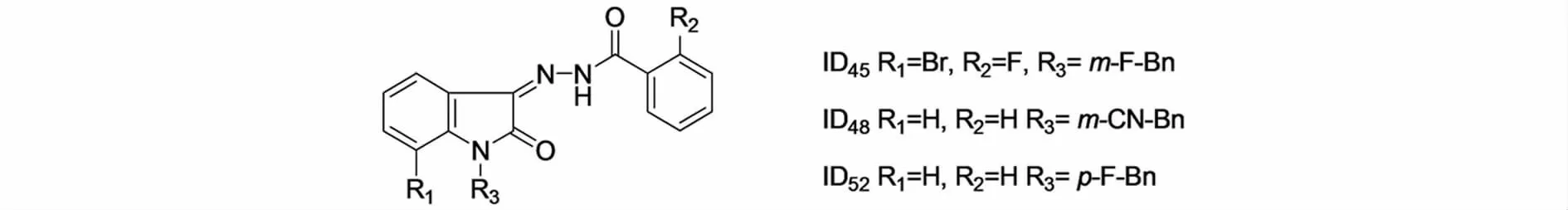
图11 ZHANG等合成的吲哚-2,3-二酮腙类化合物Fig.11 The indole-2-3-dione hydrazone synthesized by ZHANG
烟草花叶病毒列全球十大植物病毒之首,被称 为“植物癌症”,可感染烟草等多种重要的经济作物,全球每年造成的直接经济损失一亿美元以上,迄今为止尚未有特效药.昆明植物研究所郝小江课题组受植物在进化过程中能够形成抵御病虫害的化学防御体系这一学术思想的启发,经多方合作,从马兰中发现了烟草系统获得抗性的新型化学激活剂3-丙酮基-3-羟基羟吲哚(AHO,图12左),阐明了其依赖于水杨酸途径的作用机制[32-34],大田试验表明AHO对植物病毒和病原菌的防治效果突出,具有发展为新型植保素的前景.该课题组以AHO为先导化合物,合成了系列3-羟基-吲哚-2-酮衍生物(图12右),筛选了其作为植物系统获得抗性的化学激活剂,用于防治烟草及其他经济作物感染病毒病或病原菌,有效防治烟草花叶病及白粉,发现了若干具有良好活性的化合物[35].进一步的研究表明:含1%AHO二甲基亚砜溶液1 000倍液、含0.4%苦木素的2%AHO微乳液500倍液两种制剂在接种烟草花叶病毒4周后仍然保持44.04%和47.71%的相对防效[36];多肽保与AHO种诱导剂的组合应用对控制TMV有良好效果,能明显推迟带毒隐症烟株TMV的发病时间,移栽后70d对以清水和东旺毒消为对照的大田期烟株TMV的平均防效分别达到69.64%和43.25%,且在株高、叶数方面表现出明显优势,叶片生长发育状况良好,防治效果明显优于对照药剂[37].最近研究还发现AHO对大田烟株番茄斑萎病毒属病毒病有很好的防控效果,其对番茄斑萎病毒属病毒病的效果优于部分市售药剂,具有开发成为防控番茄斑萎病毒属病毒病抗病毒剂的潜力[38].该项成果“以植物之道,还治植物之身”,建立了一种新的学术观点,使植物抗病毒药物的靶点更加精准,揭开了抗烟草花叶病毒新型植保素的神秘面纱.
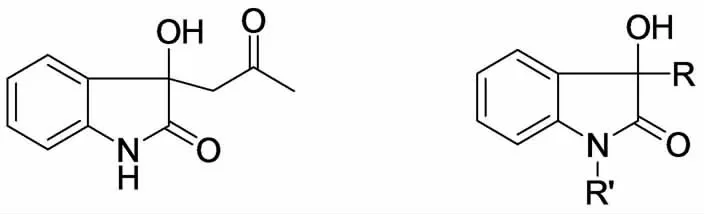
图12 3-丙酮基-3-羟基羟吲哚(AHO,左)及其类似物(右)Fig.12 3-Acetonyl-3-hydroxyoxindole(AHO,left)and analogues(right)
5 结论
综上所述,基于吲哚-2,3-二酮结构的特殊性,其衍生物在抗病毒活性方面的研究已经成为药物化学领域的热点之一.目前存在的问题是:吲哚-2,3-二酮衍生物结构多样,但是用来研究其抗病毒活性的仅占很少一部分,大部分化合物都未进行生物活性研究;筛选的病毒类型相对集中,缺乏较为全面的研究;抗病毒活性研究还不够深入,目前还未有进入临床的药物报道.因此,在该领域需要从广度和深度两方面开展研究,其中广度既包括吲哚-2,3-二酮衍生物的结构,也包括筛选病毒的种类,这样才更有可能发现新的药物先导化合物.
[1]彭少平,顾振纶.板蓝根化学成分、药理作用研究进展[J].中国野生植物资源,2005,24(5):4-7.
[2]GIL-TURNES M S,HAY M E,FENICAL W.Symbiotic marine bacteria chemically defend crustacean embryos from a pathogenic fungus[J].Science,1989,246:116-118.
[3]GLOVER V,HALKET J M,WATKINS P J.Isatin:Identity with the purified monoamine oxidase inhibitor tribulin[J].J Neuroche,1988,51:656-659.
[4]GLOVER V,SANDLER M.Tribulin and isatin:An update.In:Monoamine oxidase:basic and clinical frontiers[M].Utrecht:VSP,1993:61-71.
[5]BREWERTON T D,ZEALBERG J J,LYDIARD R B.CSF isatin is elevated in bulimia nervosa[J].Biol Psychia,1995,37:481-483.
[6]MEDVEDEV A E,CLOW A,SANDLER M.Isatin:a link between natriuretic peptide and monoamines[J].Biol Psychia,1996,52:385-391.
[7]LAIRD A D,VAUKOCZY P,SHAWVER L K.SU6668is a potent antiangiogenic and antitumor agent that induces regression of established tumors[J].Cancer Res,2000,60(15):4152-4160.
[8]SRIRAM D,BAL T R,YOGEESWARI P.Design,synthesis and biological evaluation of novel non-nucleoside HIV-1reverse transcriptase inhibitors with broadspectrum chemotherapeutic properties[J].Bioorg Med Chem,2004,12:5865-5873.
[9]陈刚,郝小江.靛红生物活性研究进展[J].天然产物研究与开发,2010,22(2):356-360.
[10]PANDEYA S N,SRIRAMA D,NATH G,et al.Synthesis,antibacterial,antifungal and anti-HIV activities of Schiff and Mannich bases derived from isatin derivatives and N-[4-(49-chlorophenyl)thiazol-2-yl]thiosemicarbazide[J].Eur J Pharm SCI,1999,9:25-31.
[11]PANDEYA S N,SRIRAM D,NATH G,et al.Synthesis,antibacterial,antifungal and anti-HIV evaluation of Schiff and Mannich bases of isatin derivatives with 3-amino-2-methylmercapto quinazolin-4-(3 H)-one[J].Pharm Acta Helv,1999,74:11-17.
[12]PANDEYA S N,SRIRAM D,NATH G,et al.Synthesis and antimicrobial activity of Schiff and Mannich bases of isatin and its derivatives with pyrimidine[J].Il Farmaco,1999,54:624-628.
[13]SELVAM P,CHANDRAMOHAN M,DE CLERCQ E,et al.Synthesis and anti-HIV activity of 4-[(1,2-dihydro-2-oxo-3H-indol-3-ylidene)amino]-N(4,6-dimethyl-2-pyrimidinyl)-benzene sulfonamide and its derivatives[J].Eur J Phar SCI,2001,14:313-316.
[14]PANDEYA S N,SRIRAM D,NATH G,et al.Synthesis,antibacterial,antifungal and anti-HIV activities of norfloxacin Mannich bases[J].Eur J Med Chem,2000,35:249-255.
[15]TANUSHRE R B,BALASUBRAMANI A,PERUMAL Y,et al.Synthesis and evaluation of anti-HIV activity of isatinβ-thiosemicarbazone derivatives[J].Bioorg Med Chem Lett,2005,15:4451-4455.
[16]DHARMARAJAM S,PERUMAL Y,GAYATRI G.Synthesis,anti-HIV and antitubercular activities of lamivudine prodrugs[J].Eur J Med Chem,2005,40:1373-1376.
[17]BAUER D J,DUMBELL K R,FOX-HULME P,et al.The chemotherapy of variola major infection[J].Bull World Health Organ,1962,26:727-732.
[18]BAUER D J,SADLER P W.New antiviral chemotherapeutic agent active against smallpox infection[J].Lancet,1960,1:1110-1111.
[19]BAUER D J.The antiviral and synergic actions of isatin-β-thiosemicarbazone and certain phenoxypyrimidines in vaccinia infection in mice[J].Br J Exp Pathol.1955,36:105-114.
[20]BORYSIEWICZ J,WITALINSKI W.Effect of N,Nbis(methylisatin-betathiose-micarbazone)-2-methylpiperazine on vaccinia virus replication invitro and in vivo[J].Arch Virol,1979,62:83-86.
[21]ZGORNAIK-NOWOSIELSKA I,GATKIEWICZ A,VECKENSTEDT A,et al.Effect of N,N-bis(methylisatin-β-thiosemicarbazone)-2-methylpiperazine against virus-induced encephalitis in mice[J].Acta Virol,1980,24:439-444.
[22]DEBRA C Q,KATHY A K,EARL R K.In vitro and in vivo evaluation of isatin-β-thiosemicarbazone and marboran against vaccinia and cowpox virus infections[J].Antivir Res,2006,71:24-30.
[23]MAGEE W C,HOSTETLER K Y,EVANS D H.Mechanism of inhibition of vaccinia virus DNA polymerase by cidofovir diphosphate.Antimicrob[J].Agents Chemother,2005,49:3153-3162.
[24]DE C E.Cidofovir in the treatment of poxvirus infections[J].Antiviral Res,2002,55:1-13.
[25]PRICHARD M N,KERN E R.Orthopoxvirus targets for the development of antiviral therapies[J].Curr Drug Targets Infect Disord,2005,5:17-28.
[26]PRINS C,CRESAWN S G,CONDIT R C.An isatinβ-thiosemicarbazoneresistant vaccinia virus containing a mutation in the second largest subunit of the viral RNA polymerase is defective in transcription elongation[J].J Biol Chem,2004,279:44858-44871.
[27]MICHAEL C P,SUNIL V P,KOSHIK D S,et al.Combinatorial optimization of isatin-β-thiosemicarbazones as anti-poxvirus agents[J].J Med Chem,2005,48:3045-3050.
[28]CHEN L R,WANG Y C,YI W L,et al.Synthesis and evaluation of isatin derivatives as effective SARS coronavirus 3CL protease inhibitors[J].Bioorg Med Chem Lett,2005,15:3058-3062.
[29]ZHOU L,LIU Y,ZHANG W L,et al.Isatin compounds as noncovalent sars coronavirus 3c-like protease inhibitors[J].J Med Chem,2006,49:3440-3443.
[30]LIU W,ZHU H M,NIU G J,et al.Synthesis,modification and docking studies of 5-sulfonyl isatin derivatives as SARS-CoV 3C-like protease inhibitors[J].Bioorgan Med Chem,2014,22:292-302.
[31]ZHANG H F M,DAI H Q,PAUL J H,et al.Antiviral activity of an isatin derivative via induction of PERKNrf2-mediated suppression of cap-independent translation[J].ACS Chem Biol,2014,9:1015-1024.
[32]李艳梅.若干天然产物抗病毒活性及其作用机制的研究[D].昆明:中国科学院昆明植物研究所,2006:7.
[33]郝小江,李艳梅,陈刚,等.化学激活剂,其制备方法和其应用.ZL200710065721.0[P].2007.
[34]陈刚,郝小江,何红平,等.3-丙酮基-3-羟基羟吲哚的制备方法.201010297533.2[P].2010.
[35]郝小江,陈刚,何红平,等.3-羟基-吲哚-2-酮衍生物以其为有效成分的抗植物病毒病药物及其应用.201110256034.3[P].2011.
[36]陈永对,刘春明,李宏光,等.植物源天然产物AHO对烟草花叶病毒的田间防效[J].中国植保导刊,2013,4:47-50.
[37]徐兴阳,董家红,端永明,等.植物诱导抗病剂组合应用对烟草花叶病的防控效果[J].安徽农业科学,2011,31:19186-19188.
[38]陈永对,张洁,吴阔,等.植物源天然产物AHO对番茄斑萎病毒属病毒病的田间防效[J].南方农业学报,2014,45(12):2167-2171.
