光果甘草乙酸乙酯相对酪氨酸酶的抑制作用
2015-11-27刘雨萌李影影李明静
刘雨萌,李影影,李明静,2*
(1.河南大学 化学化工学院,河南 开封 475004;2.河南大学 河南省天然药物与免疫工程重点实验室,河南 开封 475004)
甘草中主要活性成分有三萜类化合物、黄酮类化合物和多糖类化合物[1-3].甘草酸和光甘草定是光果甘草中的两种主要活性成分.目前发现,光甘草定是存在于光果甘草中异黄酮类成分,可清除自由基和抑制酪氨酸酶,阻止黑色素的形成.有实验表明,光甘草定能较强地抑制酪氨酸酶的活性同时具有体外抗氧化的作用[4].
目前,美白化妆品主要是以抑制酪氨酸酶的活性而发挥美白作用[5].此前这种功效成分不能兼具功能性与安全性,例如一些含汞化合物、对苯二酚等被禁止在化妆品中使用[6-7].近年来,人们新发现了许多抑制酪氨酸酶的活性成分,例如熊果苷、果酸、曲酸、VC衍生物及一些中药提取物等[8-11].这些活性成分功能性好、副作用较小,已经成为大家关注与研究的焦点.美白抑制剂不仅被应用在化妆品行业,还被研究治疗色素沉着过度引起的皮肤病等.
然而与光甘草定相比,以上的部分美白成分在长期使用过程中依然会产生毒副作用,例如在使用含有较高浓度果酸的化妆品时,长时间的阳光照射可能会引起皮肤癌;高浓度的曲酸有一定的细胞毒性,如果长期使用可能会影响试验动物器官的结构和功能,甚至引起癌症.光甘草定是天然的美白剂,安全性较高,作用温和,有“美白黄金”之称.
据文献报道光甘草定在二氯甲烷、乙酸乙酯等有机溶剂中的溶解性较好[12],但是由于二氯甲烷的毒性太大,故选用乙酸乙酯为溶剂提取甘草中的光甘草定,研究其对酪氨酸酶活性的抑制作用,并探究其抑制动力学类型,为光果甘草提取物及其他美白成分的开发应用提供理论参考.
1 实验部分
1.1 材料与试剂
光果甘草:由洛阳蓝斯利科技有限公司提供;光甘草定标准品:课题组提供,经鉴定纯度在96%以上;酪氨酸酶(505U/mg)、L-酪氨酸、L-多巴:上海宝曼生物科技有限公司;其他试剂均为国产分析纯试剂;实验用水为二次蒸馏水.
1.2 仪器与设备
JHBE-50S型闪式提取器:北京金鼎科技发展有限公司;DNM-9606型酶标分析仪:北京普朗新技术有限公司;PL601-L型电子天平:梅特勒-托利多仪器(上海)有限公司;电子分析天平:北京赛得利斯天平有限公司;LRH-400-GSI型珠江牌培养箱:韶关市泰宏医疗器械有限公司;RE-2000B型旋转蒸发器:巩义市予华仪器有限公司;DHG型电热恒温鼓风干燥箱:郑州国瑞仪器有限公司.
1.3 实验方法
1.3.1 样品制备
将光果甘草粉碎,过60目筛.本课题前期已考察过采用闪式提取法同时提取甘草酸和光甘草定的提取工艺,本实验采用经考察确定的最佳提取工艺.称取20g光果甘草粉末,提取溶剂为氨性醇溶液(体积分数为70%的乙醇+体积分数为0.5%的氨水+体积分数为29.5%的水),料液比为1∶25(g/mL),提取电压为95V,单次提取时间为2min,过滤后的滤渣再在相同条件下用500mL上述溶剂提取,如此提取3次,合并提取液并浓缩,平行提取3份,每份提取液最终浓缩至150mL.再用等体积乙酸乙酯萃取提取液(每份提取液萃取3次)得到乙酸乙酯相,蒸去乙酸乙酯至粘稠浸膏状,低温干燥后称量得浸膏质量,最后用二甲基亚砜溶解定容至50 mL的容量瓶中,待用.所配溶液中乙酸乙酯相的浓度为(39.59±0.05)g/L.
1.3.2 酶实验波长的选择
本实验采用酶标分析仪测定L-多巴经酪氨酸酶催化生成的多巴醌的吸光度[13-14],多巴醌的紫外全波长扫描图如图1所示,此酶标分析仪(DNM-9606)只可设4个固定波长,即405、450、492和630 nm.由图1可知,多巴醌在478nm处有最大吸收,但是此吸收峰较宽,在478nm处测定的吸光度值与492nm处测定的吸光度值相差不多,因此选择492nm作为测定波长.
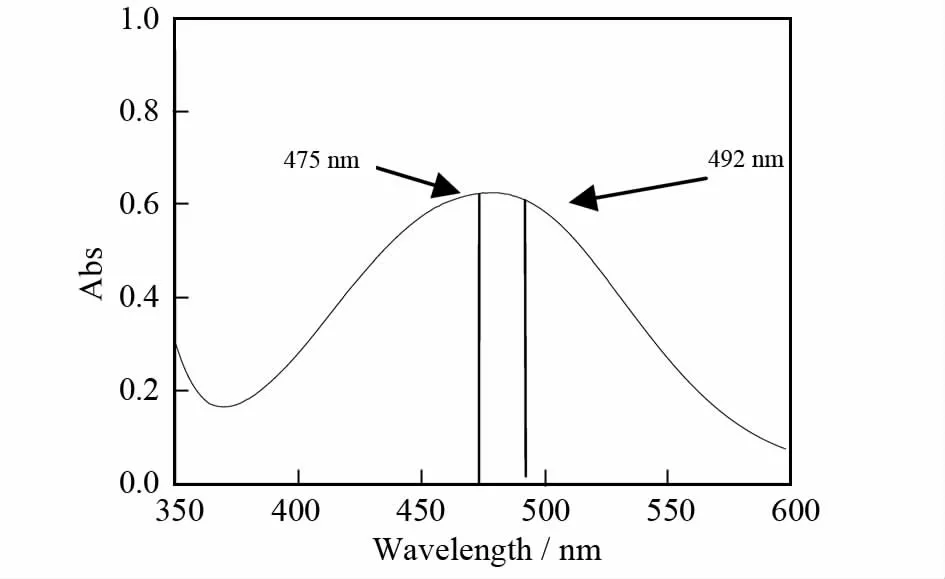
图1 多巴醌的紫外吸收光谱图Fig.1 The ultraviolet spectra of dopaquinone
1.3.3 乙酸乙酯相对酪氨酸单酚酶活力的影响
向96孔酶标板中加入不同量的抑制剂(乙酸乙酯相用二甲基亚砜溶解,磷酸盐缓冲液稀释,二甲基亚砜终体积为3%)、20μL的L-酪氨酸(10mmol/L)和75μL酪氨酸酶(4mmol/L),用0.1mol/L磷酸盐缓冲液(pH=6.5)补偿反应体系的终体积为200μL.混匀后在37℃条件下每隔60s测其在492 nm下的吸光度值.由曲线的直线部分线性回归得直线斜率求得稳态的酶相对活力,反向延长直线部分至横轴,截距为酶促反应的时间[15].
1.3.4 乙酸乙酯相对酪氨酸酶抑制活性影响
称取0.39g的L-多巴,用磷酸盐缓冲液定容至200mL,称取0.0158g酪氨酸酶(避光保存),用磷酸盐缓冲液(pH=6.5)定容至50mL.
以10mmol/L L-多巴为底物,向96孔酶标板中加入0.1mol/L磷酸盐缓冲液(pH=6.5)、20 μL L-多巴(10mmol/L)、不同体积的乙酸乙酯相和75μL酪氨酸酶(4mmol/L),反应混合物的体积共计为200μL.置于37℃人工气候箱中10min后,立刻测492nm下的OD值.用酶抑制率公式计算酪氨酸酶的抑制率:

其中,Aa是加酪氨酸酶不加提取液,只加多巴溶液时的吸光度;Ab是加酪氨酸酶不加提取液,不加多巴溶液时的吸光度;Ac是加酪氨酸酶加提取液和多巴溶液时的吸光度;Ad是加酪氨酸酶加提取液,不加多巴溶液时的吸光度.使用GraphPad Prime 5.0软件求得酪氨酸酶被抑制一半时抑制剂的浓度,即样品的IC50值.
1.3.5 乙酸乙酯相对酪氨酸酶抑制机理的判断
固定加入的L-多巴(10mmol/L)的体积为20 μL,改变加入的酪氨酸酶的量,测定不同浓度的乙酸乙酯相溶液对酪氨酸酶催化L-多巴的反应的影响[16-17].以酶催化L-多巴的氧化活力对酪氨酸酶浓度作图[18],如果得到一族通过原点的直线则为可逆抑制,如果得到一族平行的直线则为不可逆抑制,以此来判断该反应是否可逆.
1.3.6 乙酸乙酯相对酪氨酸酶抑制类型
固定加入的酪氨酸酶(4mmol/L)为75μL,改变加入的L-多巴的量,测定不同浓度的乙酸乙酯相溶液对酪氨酸酶催化L-多巴反应的影响[19-22].采用Lineweaver-Burk双倒数法判断该反应的抑制类型,如果得到一组相交于横轴的直线则为非竞争型抑制,如果得到一组相交于纵轴的直线则为竞争型抑制,如果得到一组相交于第二或第四象限的直线则为混合Ⅰ型和混合Ⅱ型抑制,如果得到一组平行的直线则为反竞争型抑制.
2 结果与讨论
2.1 乙酸乙酯相对酪氨酸酶单酚酶活力的影响
以L-多巴为底物,乙酸乙酯相对酪氨酸酶的抑制作用进程曲线如图2所示.反应开始后,产物多巴醌的生成量先缓慢的上升,反应到达一定程度后成直线上升,体系达到稳定.以稳定态酶相对活力和迟滞时间对乙酸乙酯相的浓度作图(图3),随着乙酸乙酯相浓度的增加,稳定态酶相对活力逐渐下降,迟滞时间逐渐增加.没有加入乙酸乙酯相时,迟滞时间为51s,当乙酸乙酯相的浓度达到570mg/L时,稳定态酶相对活力下降至45.79%,迟滞时间增加至144s,增加了2.82倍.

图2 乙酸乙酯相对酪氨酸酶抑制作用的进程曲线Fig 2 Progress curves of tyrosinase inhibited by ethyl acetate phase from glycyrrhiza glabra extracts
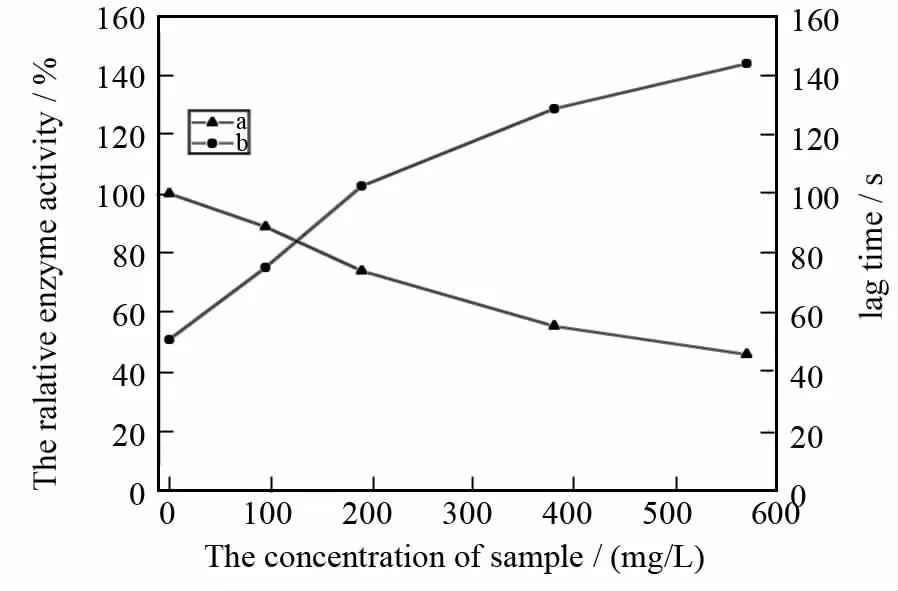
图3 稳态酶相对活力和迟滞时间与抑制剂浓度的关系Fig3 The relationship between steady-state relative enzyme activity and the concentration of samples as well as that between lag time and the concentration of samples
2.2 甘草乙酸乙酯相对酪氨酸酶的抑制作用影响
酪氨酸酶抑制率对样品浓度关系曲线见图4.由图可见,随着样品浓度的增大,对酪氨酸酶的抑制作用越来越大,即酶的活力大幅下降,表明甘草乙酸乙酯相对酪氨酸酶有较强的抑制作用;当样品浓度为89~133mg/L时对酶的抑制率较低,酶活力降幅较小,不到15%;当样品浓度为133~312mg/L时,对酪氨酸酶的抑制率逐渐增加;测定抑制率为50%时所需样品的浓度(即IC50)为(266.5±1.4)mg/L,n=3.
2.3 甘草乙酸乙酯相对酪氨酸酶的抑制机理的判断
剩余酶活力对酪氨酸酶量变化关系曲线如图5所示,得到的是一族交于原点的直线,横、纵轴截距均不随着样品浓度的变化而变化.随着样品浓度的增大,得到的直线的斜率减小,表明样品对酪氨酸酶二酚酶的抑制作用表现为可逆抑制,说明光果甘草乙酸乙酯相对酪氨酸酶二酚酶的作用是通过抑制酪氨酸酶的活力而使酶对多巴的催化作用减弱,而不会导致酶不可逆失活.
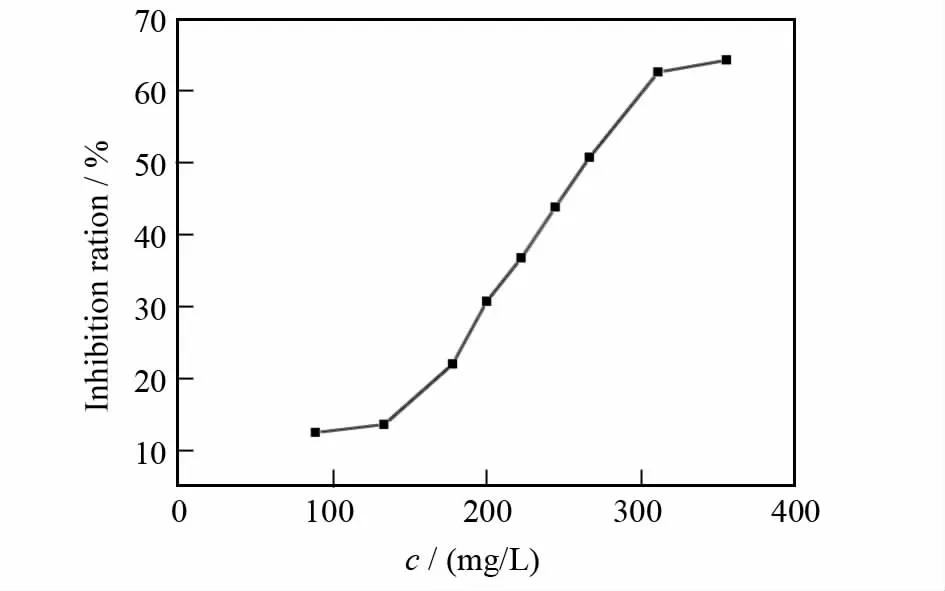
图4 甘草乙酸乙酯相对酪氨酸酶的抑制作用影响Fig.4 Inhibotory curves of ethyl acetate phase from glycyrrhiza glabra extractive on tyrosinase
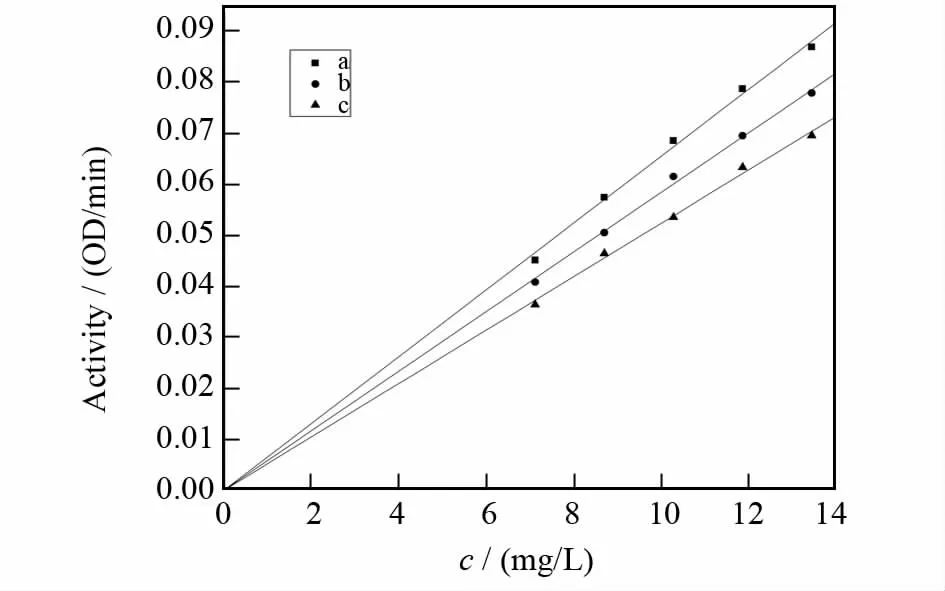
图5 甘草乙酸乙酯相对酪氨酸酶抑制机理的判断Fig 5 The determination of inhibition kinetics of the ethyl acetate phase from glycyrrhiza glabra extracts on tyrosinase
2.4 甘草乙酸乙酯相对酪氨酸酶的抑制类型判断
如图6所示,固定酪氨酸酶的加入量,改变L-多巴的加入量,得到一族交于第二象限的直线,横、纵轴截距都随着样品浓度改变而改变.由图可得样品的浓度变化,米氏常数和最大反应速率也会随之改变,样品浓度增大,米氏常数随之增大,最大反应速率随之减小.结果表明光果甘草乙酸乙酯相对酪氨酸酶二酚酶抑制类型为混合型抑制.这种作用类型与一些芳香酸,如对苯二甲酸,对酪氨酸酶的抑制作用相似.再以双倒数图的三条曲线的纵轴截距和直线斜率对乙酸乙酯相浓度分别作图,最后得到对游离酶的抑制常数KI为(182.86±1.43)mg/L,α值为(15.49±0.68)mg/L.说明乙酸乙酯相对酶-底物络合物抑制作用强度是对游离酶抑制作用强度的15.49倍.据文献报道[23],光甘草定的抑制机理为竞争型抑制,它只与自由酶结合,减少多巴与酶的结合,从而减少黑色素形成.

图6 甘草乙酸乙酯相抑制酪氨酸酶的类型的判断Fig 6 The determination of inhibition type of the ethyl acetate phase from glycyrrhiza glabra extracts on tyrosinase
3 结论
酪氨酸酶是黑色素形成的限速酶,酪氨酸酶抑制剂在化妆品、医药和食品等领域具有非常广泛的用途.本实验用乙醇水溶液提取光果甘草,并用乙酸乙酯萃取光果甘草提取液.以L-多巴为底物,研究光果甘草乙酸乙酯相对酪氨酸酶的抑制作用,其IC50值为266.5mg/L.结合动力学分析,光果甘草乙酸乙酯相对酪氨酸酶的抑制作用是通过抑制酶活力而使酶的催化作用减弱,抑制类型是混合型抑制,乙酸乙酯相可与酶和酶-底物络合物结合,但是乙酸乙酯相与酶-底物络合物的结合没有与游离酶的结合牢固.为进一步将光果甘草乙酸乙酯萃取物与其他美白成分进行复配应用研究奠定基础.
[1]高雪岩,王文全,魏胜利,等.甘草及其活性成分的药理活性研究进展[J].中国中药杂志,2009,34(21):2695-2700.
[2]李薇,宋新波,张丽娟,等.甘草中化学成分研究进展[J].辽宁中医药大学学报,2012,14(7):40-43.
[3]胡金锋,沈凤嘉.甘草属植物化学成分研究概况[J].天然产物研究与开发,1996,8(3):77-91.
[4]YI S Y,LEE S M,LIN C C,et al.Kinetic study on the tyrosinase and melanin formation inhibition activities of carthamus yellow isolated from carthamus tinctorius L[J].J Biosci Bioeng,2013,115(3):242-245.
[5]SDUTTA G,MASAKAPALLI S K.Mushroom tyrosinase inhibition activity of aloe vera L.gel from different germplasms[J].C J N Med,2013,11(6):616-620.
[6]傅博强,李欢,王小如,等.甘草黄酮类化合物对酪氨酸酶单酚酶的抑制[J].天然产物研究与开发,2007,17(4):391-395.
[7]CHANG T M.Tyrosinase and tyrosinase inhibitors[J].J Biocatal Biotrans,2012:1-2.
[8]SHILIMKAR V,LAKSHAMAN K.Tyrosinase enzyme inhibitory activity of selected Indian herbs[J].I J R Pharm Bio Sci,2012,3(3):977-982.
[9]RITARO M,HIROYUKI U,MASAYOSHI S W.Tyrosinase inhibitory activity of citrus essenital oils[J].J Agri Food Chem,2006,54(6):2309-2313.
[10]任红荣,单承莺,姜洪芳,等.香水莲花提取物抑制酪氨酸酶活性的研究[J].天然产物研究与开发,2011,23:1122-1126.
[11]石嘉怿.青梅花提取物的酪氨酸酶抑制作用及激励研究[J].食品工业科技,2011,32(10):205-211.
[12]范玉涵,骆从燕,陈文.光甘草定-富勒醇联合应用对抑制酪氨酸酶活性和清除DPPH·的协同作用[J].中国医院药学杂志,2011,31(21):1752-1755.
[13]木合布力·阿布力孜,闵杰,迪力夏提·艾尼瓦尔,等.光甘草定的制备方法及药理作用研究进展[J].新疆医科大学学报,2009,32(11):1626-1628.
[14]JANG M S,PARK H Y,NAM K H.Whitening effects of 4-hydroxyphenthyl alcohol isolated from water boiled with Hiziki fusiformis[J].Food Sci Bio,2014,23(2):555-560.
[15]KIM Y J,CHUNG J E,MOTOICHI K,et al.New tyrosinase inhibitors(+)-catechin-aldehyde polycondensates[J].Biomacromolecules,2004,5(2):474-479.
[16]YUN E J,LEE S Y,KIM J H,et al.Enzymatic production of 3,6-anhydro-L-galactose from agarose and its purification and in vitro skin whitening and anti-inflammatory activities[J].Bio R Enzy Pro,2013,97:2961-2970.
[17]邱爱东,芶琳,郭舒予.L-苹果酸对酪氨酸酶的抑制作用研究[J].食品科技,2010,35(11):261-263.
[18]FU B Q,LI H,WANG X R,et al.Isolation and identification of flavonoids in licorice and a study of their inhibitory effects on tyrosinase[J].J Agri Food Chem,2005,53(9):7408-7414.
[19]杨景冲,王晓岚,金坚.滨海白首乌提取物对酪氨酸酶活力的影响[J].天然产物研究与开发,2007,19:753-756.
[20]张捷,陈忠浩,叶森,等.羊栖菜多糖提取物对酪氨酸酶的抑制作用研究[J].食品工业科技,2012,33(20):116-120.
[21]CHANG T S.An updated review of tyrosinase inhibitors[J].Inter J Mol Sci,2009,10:2440-2475.
[22]HYUNG J J,MASAFUMI N,MASAFUMI M,et al.Identification and kinetic study of tyrosinase inhibitors found in sake lees[J].J Agri Food Chem,2006,54(26):9827-9833.
[23]骆从艳,幕春海,王园姬.光甘草定抑制酪氨酸酶及其体外抗氧化活性的研究[J].中药材,2010,33(11):1776-1780.